- Учителю
- Урок по химии на тему 'Фосфор' (9 класс)
Урок по химии на тему 'Фосфор' (9 класс)
Тема: Фосфор.
Цель урока: Сформировать представления учащихся о фосфоре.
Задачи урока: 1. Сформировать представления и обеспечить в ходе урока усвоение
следующих основных понятий о фосфоре: положение в периодической
системе, строение атома, нахождение в природе, аллотропные
видоизменения (белый, красный, черный фосфор), получение,
химические свойства, применение.
2. Развивать внимание, память, логическое мышление, умение
анализировать, сравнивать, обобщать, выделять главное, делать
выводы, познавательно излагать свои мысли.
3. Воспитывать ответственное отношение к учению, дисциплину и
культуру поведения на уроке, активность, самостоятельность,
устойчивый интерес к предмету.
Структура урока:
-
Оргмомент
-
Содержательная часть
-
Повторение пройденного материала
-
Химический диктант
-
Объяснение нового материала (флипчарт)
-
Положение фосфора в периодической системе
-
Строение атома
-
Нахождение в природе
-
Аллотропные видоизменения фосфора
-
Получение фосфора
-
Химические свойства
-
Применение фосфора
-
Анализирующая часть
-
Закрепление нового материала (выполнение разноуровневых заданий)
-
Подведение итогов урока
-
Домашнее задание
Оборудование: карточки с разноуровневыми заданиями, интерактивная доска, химический диктант, учебники.
Методы и приемы:
-
Словесные: вопросы, беседа, объяснение
-
Наглядные: флипчарт
-
Практические: химический диктант, выполнение разноуровневых заданий, работа с интерактивной доской.
Ход урока:
I. Оргмомент: Здравствуйте, ребята, садитесь. Сегодня на уроке мы продолжим разговор о неметаллах. Мы уже изучили серу, азот и их соединения. Сегодня вам предстоит изучить - фосфор. Но прежде чем приступить к изучению новой темы, вспомним особенности азота и его соединений.
II. Содержательная часть
-
Повторение пройденного материала.
Выполним небольшой, химический диктант. Я перечисляю некоторые утверждения содержащие сведения о строении и свойствах изученных соединений азота, а вы решаете о каких из них идет речь. Если утверждение справедливо для аммиака, то учащиеся I варианта, записывают номер данного утверждения. Учащиеся II варианта записывают утверждения, справедливые для азотной кислоты.
(флипчарт №1, №2 (проверка))

Ответы: Вариант №1 аммиак NH3: 2, 4, 6, 9, 10, 12, 13, 15
Вариант №2 азотная кислота HNO3: 1, 3, 5, 7, 8, 11, 14
-
Объяснение нового материала.
-
Положение фосфора в периодической системе.
Фосфор - элемент III периода, 3 ряда, главной подгруппы V группы (VА), порядковый номер 15, относительная атомная масса 31. (флипчарт №4)


-
Строение атома.
Порядковый номер фосфора 15, значит, в ядре фосфора содержится 15 протонов и 16 нейтронов (Ar=31), общее число электронов 15.
(флипчарт №5)
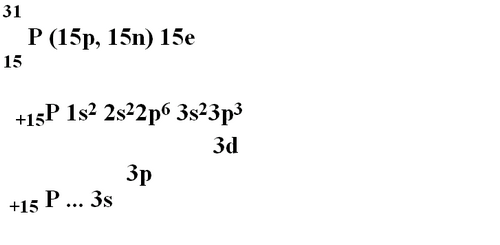

-
Нахождение в природе.
Из-за большой химической активности фосфор встречается в природе только в виде соединений. Важнейшие минералы, содержащие фосфор, - это фосфориты и апатиты, в состав которых входит ортофосфат кальция Ca3(PO4)2. Фосфориты и апатиты встречаются в месторождении Каратау. Фосфорные заводы, работающие на основе этого сырья, находятся в Жанатасе, Шымкенте и Таразе. (флипчарт №6)
-
Аллотропные видоизменения фосфора.
Фосфор встречается в природе в трех аллотропных видоизменениях: белый (желтый), красный и черный. Чаще встречается красный фосфор. При нагревании без доступа воздуха белый фосфор постепенно превращается в красный; а при высоком давлении белый фосфор превращается в черный.
(флипчарт №7)

-
Получение фосфора.
Фосфор получают из фосфоритов и апатитов, нагревая их в электрической печи без доступа воздуха в присутствии оксида кремния (IV) и угля:
t
Ca3(PO4)2 + 5C + 3SiO2 → 3CaSiO3 + 2P + 5CO↑
-
Химические свойства фосфора.
а). взаимодействие с простыми веществами:
-
с галогенами: 2P + 3CI2 → 2PCI3
-
c металлами: 3Ca + 2P → Ca3P2
-
с кислородом: 4P + 5O2 → 2P2O5
-
с серой: 2P + 3S → P2S3
б). взаимодействие со сложными веществами:
-
при взаимодействии фосфора с гидроксидом натрия образуются фосфин (PH3) и гипофосфит натрия:
t
4P + 3NaOH + 3H2O → 3NaH2PO2 + PH3↑
-
белый фосфор используется при получении фосфорной кислоты, для изготовления горючих смесей:
P + 5HNO3(конц) → H3PO4 + 5NO2 + H2O
(флипчарт №8, №9)
-
Применение фосфора.
Красный фосфор применяется в производстве спичек. Его вместе с тонко измельченным стеклом наносят на боковую поверхность коробка. При трении спичечной головки, в состав которой входят хлорат калия и сера, происходит воспламенение.
Белый фосфор в военное время использовали в зажигательных бомбах и для создания дымовых завес. (флипчарт №10)




![]()
III. Аналитическая часть:
-
Закрепление нового материала.
Ребята теперь вам предстоит выполнить разноуровневые задания по данной теме. Задания состоят из трех уровней сложностей. Самый простой первый уровень. Максимальное количество балов которое вы можете набрать - 9, это оценка «5», если набираете 7 баллов - оценка «4», меньшее количество баллов оценивается «3».
Разноуровневые задания по теме «Фосфор»
I уровень: (5 баллов)
-
Сравните строение атомов серы, азота и фосфора. Запишите формулы типичных соединений, образованных атомами указанных химических элементов. Назовите их.
-
Напишите уравнения химических реакций, происходящих между:
-
Фосфором и кислородом;
-
Фосфором и водородом;
-
Фосфором и серой.
-
Укажите вид химической связи в соединениях азота и фосфора:
-
С металлами;
-
С неметаллами.
-
Приведите два примера бинарных соединений фосфора с элементом, электроотрицательность которого: а) ниже; б) выше электроотрицательности фосфора.
-
По приведенным ниже схемам составьте уравнения реакций:
-
Mg + P →
-
Ca + P →
-
P + CI2 →
(флипчарт №11)

II уровень: (3 балла)
-
Установи соответствие. Сравни атомы азота, фосфора и серы. Какой из этих химических элементов:
-
Имеет наибольший атом;
-
Имеет наименьший атом;
-
Легче других отдает электроны;
-
Труднее других отдает электроны;
-
Сильнее других притягивает электроны;
-
Является наиболее сильным окислителем;
-
Является наиболее сильным восстановителем.









азот фосфор сера
-
Напишите уравнения химических реакций, при помощи которых можно осуществить следующие превращения:
PCI3 1). ____________________________________
1 2↑ 3 2). ____________________________________

 P2S3 ← P → Ca3P2 3). ____________________________________
P2S3 ← P → Ca3P2 3). ____________________________________
4 5↓ 6 4). ____________________________________
H3PO4 P2O5 NaH2PO4 5). ____________________________________
-
В железной ложечке подожгли красный фосфор и поместили его в закрытый сосуд, на дне которого находится нейтральный раствор индикаторора - фиолетового лакмуса. Через некоторое время окраска индикатора изменилась. Как? Почему? Запишите уравнения происходящих химических реакций.
(флипчарт №12)

III уровень: (1 балл)
-
При ожогах горящим фосфором накладывают повязки, обильно смоченные
а). раствором сульфата меди (II)с массовой долей в растворе 2% или
б). раствором гидрокарбоната натрия (NaHCO3) с массовой долей соли 5%. Вычислите массы солей и воды, необходимые для приготовления 100 г каждого раствора.
(флипчарт №13)

-
Подведение итогов урока, выставление оценок.
-
Домашнее задание: § 21 Упр А №3 №7 стр 74
Разноуровневые задания по теме «Фосфор»
I уровень: (5 баллов)
-
Сравните строение атомов серы, азота и фосфора. Запишите формулы типичных соединений, образованных атомами указанных химических элементов. Назовите их.
-
Напишите уравнения химических реакций, происходящих между:
-
Фосфором и кислородом;
-
Фосфором и водородом;
-
Фосфором и серой.
-
Укажите вид химической связи в соединениях азота и фосфора:
-
С металлами;
-
С неметаллами.
-
Приведите два примера бинарных соединений фосфора с элементом, электроотрицательность которого: а) ниже; б) выше электроотрицательности фосфора.
-
По приведенным ниже схемам составьте уравнения реакций:
-
Mg + P →
-
Ca + P →
-
P + CI2 →
II уровень: (3 балла)
-
Установи соответствие. Сравни атомы азота, фосфора и серы. Какой из этих химических элементов:
-
Имеет наибольший атом;
-
Имеет наименьший атом;
-
Легче других отдает электроны;
-
Труднее других отдает электроны;
-
Сильнее других притягивает электроны;
-
Является наиболее сильным окислителем;
-
Является наиболее сильным восстановителем.









азот фосфор сера
-
Напишите уравнения химических реакций, при помощи которых можно осуществить следующие превращения:
PCI3 1). ____________________________________
1 2↑ 3 2). ____________________________________

 P2S3 ← P → Ca3P2 3). ____________________________________
P2S3 ← P → Ca3P2 3). ____________________________________
4 5↓ 6 4). ____________________________________
H3PO4 P2O5 NaH2PO4 5). ____________________________________
-
В железной ложечке подожгли красный фосфор и поместили его в закрытый сосуд, на дне которого находится нейтральный раствор индикаторора - фиолетового лакмуса. Через некоторое время окраска индикатора изменилась. Как? Почему? Запишите уравнения происходящих химических реакций.
III уровень: (1 балл)
-
При ожогах горящим фосфором накладывают повязки, обильно смоченные
а). раствором сульфата меди (II)с массовой долей в растворе 2% или
б). раствором гидрокарбоната натрия (NaHCO3) с массовой долей соли 5%. Вычислите массы солей и воды, необходимые для приготовления 100 г каждого раствора.