- Учителю
- Проектная работа по химии «РЕШЕНИЕ 20 ЗАДАНИЯ ОГЭ ПО ХИМИИ» (9 класс)
Проектная работа по химии «РЕШЕНИЕ 20 ЗАДАНИЯ ОГЭ ПО ХИМИИ» (9 класс)
.
«РЕШЕНИЕ 20 ЗАДАНИЯ ОГЭ ПО ХИМИИ»
Исследование по химии
Касьянова Анастасия, 9б класс, МАОУСОШ №1, г. Кировград, steshamalik888@gmail.com
Руководитель Сафронова Екатерина Николаевна, учитель химии, МАОУСОШ №1,
г. Кировград, him1971@mail.ru
Почему я выбрала эту тему?
В 9 классе мне предстоит сдать ОГЭ по химии. При оценке тестов экзамена я поняла, что наиболее сложными являются задания повышенного уровня, а именно задание 20. И одним из умений, которым я должна владеть, является умение решать задания, связанные с понятиями «окислительно - восстановительная реакция», «метод электронного баланса», «степень окисления». Такой предмет, как химия, для меня очень важен и интересен. Я хочу знать больше школьного базового уровня.
Цель: создание буклета с алгоритмом решения 20 задания ОГЭ по химии
Передо мной стояло несколько задач:
-
Решить несколько заданий по химии на расставление коэффициентов в окислительно-восстановительных реакциях методом электронногобалланса
-
Выявить сущность заданий.
-
Создать ключ решения и буклет с алгоритмом выполнения заданий.
Главная идея и проблема работы.
Можно ли создать алгоритм решения задачи 20 ОГЭ по химии.
План работы.
-
Для создания своего проекта, я работала с заданиями ОГЭ, со справочными материалами, с федеральными сайтами. Для правильного и грамотного решения этих заданий необходимо знать алгоритм для определения степени окисления атома в соединении, использовать метод электронного баланса.
-
Решение задач на расстановку коэффициентов в окислительно - восстановительных уравнениях методом электронного балланса
-
Выявление сущность выполнения данных заданий.
-
Определение алгоритма и ключа решения задания 20 ОГЭ по химии
-
Создание проектного продукта - буклета.
Описание хода работы.
Итак, для осуществления своей цели я изучила несколько задач на расстановку коэффициентов в окислительно - восстановительных уравнениях методом электронного балланса. Для начала повторила определения «степень окисления», «окислительно - восстановительная реакция», «окислитель», «восстановитель», «метод электронного балланса».
Степень окисления - условныйбалланс, который приписывают атому, при допущении, что молекула построена по ионному типу.
Окислительно - восстановительная реакция - реакция, протекающая с изменением степени окисления атомов.
Окислитель - частица, принимающая электроны.
Восстановитель - частица, отдающая электроны.
Окисление - это процесс отдачи электронов.
Восстановление - это процесс принятия электронов.
Метод электронногобалланса. Суть метода электронного баланса заключается в:
-
Подсчете изменения степени окисления для каждого из элементов, входящих в уравнение химической реакции
-
Элементы, степень окисления которых в результате произошедшей реакции не изменяется - не принимаются во внимание
-
Из остальных элементов, степень окисления которых изменилась - составляется баланс, заключающийся в подсчете количества приобретенных или потерянных электронов
-
Для всех элементов, потерявших или получивших электроны (количество которых отличается для каждого элемента) находится наименьшее общее кратное
-
Найденное значение и есть базовые коэффициенты для составления уравнения.
Визуально алгоритм решения задачи с помощью метода электронного баланса представлен на диаграмме.
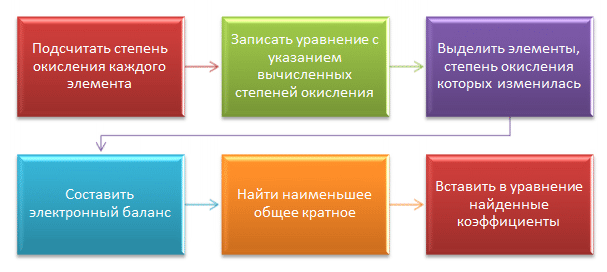
На следующем этапе я прорешала несколько заданий, используя сайт www.fipi.ru/content/otkrytyy-bank-zadaniy-oge</</font>
Задание 1
Используя метод электронного баланса, составьте уравнение реакции
H2SO4 + Al → Al2(SO4)3 + S + H2O
Определите окислитель и восстановитель.
Решение:
-
Расставить степени окисления всех атомов
+1+6-2 0 +3 +6-20 +1-2
H2SO4+ Al → Al2(SO4)3 + S + H2O
-
Подчеркнуть частицы, которые изменили степень окисления и составить электронный балланс:
+6 0
S+6е→S
0 +3
Al-3е→Al
-
Определить НОК числа отданных и принятых электронов - 6 и разделить на число отданных и принятых электронов, получится электронный балланс
+6 0
S+6е→S │1
0 +3
Al-3е→Al│2
-
Расставить коэффициенты, начиная с левой части уравнения.
4H2SO4 + 2Al → Al2(SO4)3 + S + 4H2Oвсех атомов в левой и правой части уравнения, убедится в одинаковом количестве, в последнюю очередь проверить число атомов кислорода.
-
Определить, что является окислителем и восстановителем.
Al - восстановитель, S+6 (H2SO4) - окислитель
Используя данный алгоритм, я прорешала еще несколько заданий.
Задание 2
Используя метод электронного баланса, составьте уравнение реакции
Ag + HClO3 → AgCl + AgClO3 + H2O
Определите окислитель и восстановитель.
Решение:
0 +1+5-2 +1-1 +1+5-2 +1-2
-
Ag + HClO3 → AgCl + AgClO3 + H2O
-
Ag0 -1е→ Ag+1
Cl+5 +6е→Cl-1
-
Ag0 -1е→ Ag+1│6
Cl+5 +6е→Cl-1│1
-
6Ag + 6HClO3 → AgCl + 5AgClO3 + 3H2O
-
Ag0 - восстановитель, Cl+5 (HClO3) - окислитель
Задание 3
Используя метод электронного баланса, составьте уравнение реакции
Ca + HNO3 → N2O + Ca(NO3)2 + H2O
Определите окислитель и восстановитель.
Решение:
0 +1+5-2 +1-2 +2 +5-2 +1-2
-
Ca + HNO3 → N2O + Ca(NO3)2 + H2O
-
Ca0 -2е→ Ca+2
N+5 +4е→ N+1
-
Ca0 -2е→ Ca+2 │2
N+5 +4е→ N+1 │1
-
4Ca + 10HNO3 → N2O +4 Ca(NO3)2 + 5H2O
-
Ca0 - восстановитель, N+5 (HNO3) - окислитель
Задания для самостоятельного решения
-
Используя метод электронного баланса, составьте уравнение реакции
NaMnO4 + NaOH → Na2MnO4 + O2 + H2O
Определите окислитель и восстановитель
-
Используя метод электронного баланса, составьте уравнение реакции
Br2 + KI + H2O → KIO3 + HBr
Определите окислитель и восстановитель.
-
Используя метод электронного баланса, составьте уравнение реакции
S + KOH → K2S + K2SO3 + H2O
Определите окислитель и восстановитель.
-
Используя метод электронного баланса, составьте уравнение реакции
K2S + HNO3 → K2SO4 + NO + H2O
-
Определите окислитель и восстановитель.
Ca + HNO3 → N2O + Ca(NO3)2 + H2O
Определите окислитель и восстановитель.
-
Используя метод электронного баланса, составьте уравнение реакции
PH3 + Cl2 + H2O → H3PO4 + HCl
Определите окислитель и восстановитель.
-
Используя метод электронного баланса, составьте уравнение реакции
H2SO4 + Fe → Fe2(SO4)3 + SO2 + H2O
Определите окислитель и восстановитель.
-
Используя метод электронного баланса, составьте уравнение реакции
MnCO3 + KClO3 → MnO2 + KCl + CO2
Определите окислитель и восстановитель
-
Используя метод электронного баланса, составьте уравнение реакции
PH3 + Cl2 + H2O → H3PO4 + HCl
Определите окислитель и восстановитель.
-
Используя метод электронного баланса, составьте уравнение реакции
H2SO4 + Fe → Fe2(SO4)3 + SO2 + H2O
Определите окислитель и восстановитель.
-
Используя метод электронного баланса, составьте уравнение реакции
MnCO3 + KClO3 → MnO2 + KCl + CO2
Определите окислитель и восстановитель.
-
Используя метод электронного баланса, составьте уравнение реакции
HNO3 + Na2SO3 → Na2SO4 + NO2 + H2O
-
Используя метод электронного баланса, составьте уравнение реакции
Cr + O2 + HCl → CrCl3 + H2O
Определите окислитель и восстановитель.
-
Используя метод электронного баланса, составьте уравнение реакции
B + HBrO3 + H2O → H3BO3 + HBr
Определите окислитель и восстановитель.
-
Используя метод электронного баланса, составьте уравнение реакции
CrO3 + NH3 → Cr2O3 + N2 + H2O
Определите окислитель и восстановитель.
-
Используя метод электронного баланса, составьте уравнение реакции
HNO2 + HI → I2 + NO + H2O
Определите окислитель и восстановитель.
-
Используя метод электронного баланса, составьте уравнение реакции
HNO3 + PbS → PbSO4 + NO + H2O
Определите окислитель и восстановитель.
Помимо этого, для решения подобных заданий я использовала правила определения степени окисления:
-
Водород обычно проявляет степень окисления (СО) +1 (исключение, соединения с металлами (гидриды) - у водорода СО равна (-1) Me+nHn-1)
-
Кислород обычно проявляет СО -2 (исключения:О+2F2, H2O2-1 - перекись водорода)
-
Металлы проявляют только +n положительную СО
-
Фтор проявляет всегда СО равную -1 (F-1)
-
Для элементов главных подгрупп:
Высшая СО (+) = номеру группы Nгруппы
Низшая СО (-) = Nгруппы-8
-
Степень окисления свободных атомов и атомов в молекулах простых веществ равнанулю - Na0, P40, O20
-
В сложном веществе алгебраическая сумма СО всех атомов с учётом их индексов равна нулю = 0, а в сложном ионе его заряду.
Заключительным этапом стало создание буклета. Вот такие буклеты я раздала своим одноклассникам (приложение).
Выводы
Повторив материал по теме «Степень окисления. Окислительно - восстановительные реакции» и выполнив ряд заданий по данному направлению, я научилась решать задания 20 Основного Государственного Экзамена по химии и надеюсь на получение высокого балла за это задание на итоговой аттестации. Я могу оказать помощь моим одноклассникам, которым сложно ориентироваться в данной теме. Буклет по данной теме может служить помощником для решения заданий по расстановке коэффициентов в окислительно-восстановительных реакциях методом электронного балланса.
Рефлексия
Самым сложным в моей работе было поместить информацию в буклете таким образом, чтобы она как можно точно отражала способ решения данных заданий, так как материал по данной теме достаточно объемен. В дальнейшем я могу использовать полученные знания в курсе химии 10 и 11 класса и выйти на сдачу Единого государственного экзамена по химии 11 класса, так как подобные задания встречаются и там.
Самооценка
Я считаю, что цели и задачи, которые я поставила для выполнения данного проекта, мной успешно достигнуты.
Рецензия
на проектную работу Касьяновой Анастасии
МАОУСОШ №1, 9-й класс, Кировградский городской округ
Научный руководитель проекта Сафронова Екатерина Николаевна
учитель химии.
Решение 20 задания ОГЭ по химии.
Тема проекта помогает обучающемуся освоить знания, находящиеся на повышенном уровне изучения химии. Ученица, только начав изучение нового предмета, с 8 класса проявляла особый интерес к предмету химии. И в конце 8 класса она пожелала подробнее изучить тему «Степень окисления. Окислительно-восстановительные реакции» для сдачи ОГЭ по химии после 9 класса. Налицо основные этапы, характерные для исследования в научной сфере, и выводы о сущности исследуемого явления. В своей работе она представила основной теоретический материал по данной теме, составила образец заданий, прорешала несколько задач на расставление коэффициентов методом электронного балланса в окислительно-восстановительных реакциях, составила буклет по данной теме, в помощь ученикам, сдающих ОГЭ по химии
Материалы и выводы проектного исследования могут быть использованы на уроках химии и элективном курсе.