- Учителю
- Краткосрочный план урока химии в 8 классе по теме 'Решение расчетных задач'
Краткосрочный план урока химии в 8 классе по теме 'Решение расчетных задач'
Краткосрочный план урока № 14 по предмету "Химия" в 8 классе
Дата:
Тема занятия:
Решение расчетных задач
- вычисление относительной молекулярной массы, молярной массы простых и сложных веществ;
- расчет массовой доли химических элементов в сложных веществах, вычисления по химической формуле молярной массы, массы и количества вещества
Ссылка:
Учебная программа, среднесрочное планирование
Общие цели:
Углубить знания учащихся в решении расчетных задач (Mr, М, ω, N, V, 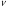 ), развивать химическую и математическую грамотность
), развивать химическую и математическую грамотность
Результаты обучения:
Будут уметь вычислять относительную молекулярную массу, массовую долю, количество вещества
Ключевые идеи:
Вовлечение всех учащихся в процесс обучения данному разделу через развитие речи, ведения диалогической и исследовательской беседы, памяти, мышления, анализа и сравнения на основе идей 7 модулей Программы
Ресурсы:
Цветы для психологического настроя, карточки для проверочной работы, тематические карточки для решения задач с примерами
Содержание урока
Деятельность учителя
Деятельность учеников
Организационный момент
(1 мин)
Психологический настрой "Волшебная поляна"
Внимательно просматривают презентацию
Проверочная работа
(7 мин)
Терминология, типы химических реакций
1 вариант
2 вариант
Дайте определение
Р. соединения - это
Р. обмена - это
Р. разложения - это
Р. замещения - это
Определите тип каждой реакции
CaO+H2O=Ca(OH)2
H2+Cl2=2HCl
Cu(OH)2=CuO+H2O
NH4Cl=NH3+HCl
4KClO3=3KClO4+KCl
NaOH+HCl=NaCl+H2O
PbO+SiO2=PbSiO3
4Fe(OH)2+2H2O+O2=4Fe(OH)3
CaCO3=CaO+CO2
4HNO3=2H2O+4NO2+O2
AgNO3+KBr=AgBr
CuSO4+Fe=FeSO4+Cu
.
Реализация
(25 мин)
Стратегия "Реши свою задачу" (ОКМ, УВО, УиЛ)
А) вычисление относительной молекулярной массы, молярной масс простых и сложных веществ;
Формула:
Mr(вещества)=n·Ar(Э)+n·Ar(Э)+… +n·Ar(Э)
Например:
Mr(H2O) = 2Ar(H) + Ar(O)= 2·1 + 16 = 18
M(H2O) = 18 г/моль
Задания:
Рассчитать относительную молекулярную и молярную массу веществ:
1 вариант
2 вариант
аш-эн-о-три
натрий-три-пэ-о-четыре
феррум-два-силициум-о-три-трижды
купрум-эс-о-четыре
аш-два-силициум-о-три
алюминий-два-эс-о-три-трижды
Б) расчет массовой доли химических элементов в сложных веществах
Формула:
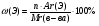
Например:
Вещество H2O
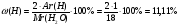

или
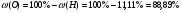
Задания:
Рассчитать массовую долю элементов в веществах:
1 вариант
2 вариант
аш-эн-о-три
натрий-три-пэ-о-четыре
феррум-два-силициум-о-три-трижды
купрум-эс-о-четыре
аш-два-силициум-о-три
алюминий-два-эс-о-три-трижды
Вычисления по химической формуле молярной массы, массы и количества вещества;
Формула:
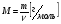
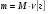
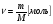
Например:
Задача 1
Дано:
m(H2O)=25 г
Решение:
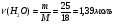
Ответ: 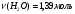
Найти:
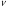 (Н2О)-?
(Н2О)-?
Задача 2
Дано:
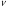 (Н2О) =3 моль
(Н2О) =3 моль
Решение:
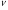
Ответ: 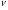
Найти:
m(H2O)-?
Задания:
Рассчитать массу веществ, если его количество вещества составляет 0,2 моль:
1 вариант
2 вариант
аш-эн-о-три
натрий-три-пэ-о-четыре
феррум-два-силициум-о-три-трижды
купрум-эс-о-четыре
аш-два-силициум-о-три
алюминий-два-эс-о-три-трижды
Рассчитать количество веществ, если его масса составляет 2 г:
1 вариант
2 вариант
аш-эн-о-три
натрий-три-пэ-о-четыре
феррум-два-силициум-о-три-трижды
купрум-эс-о-четыре
аш-два-силициум-о-три
алюминий-два-эс-о-три-трижды
Физминутка
(3 мин)
Панда
С удовольствием выполняют упражнения
Подведение итогов
(4 мин)
Выполняют дифференцированные задания
Оценка «3»
-
Вычислитеотносительную молекулярную массу, молярную массу веществ:
а) аш-хлор; б) калий-фтор
-
Рассчитайте массовую долю химических элементов в сложных веществах:
а) аш-хлор; б) калий-фтор
-
Вычислите по химической формуле массу вещества:
а) количество вещества (аш-хлор) = 0,3 моль;
б) количество вещества (калий-фтор) = 0,3 моль
-
Вычислите по химической формуле количество вещества:
а) масса (аш-хлор) = 4 г; б) масса (калий-фтор) = 4 г
Оценка «4»
-
Вычислитеотносительную молекулярную массу, молярную массу веществ:
а) сэ-о-два; б) эс-о-три
-
Рассчитайте массовую долю химических элементов в сложных веществах:
а) сэ-о-два; б) эс-о-три
-
Вычислите по химической формуле массу вещества:
а) количество вещества (сэ-о-два) = 0,7 моль;
б) количество вещества (эс-о-три) = 0,7 моль
-
Вычислите по химической формуле количество вещества:
а) масса (сэ-о-два) = 9 г; б) масса (эс-о-три) = 9 г
Оценка «5»
-
Вычислитеотносительную молекулярную массу, молярную массу веществ:
а) натрий-три-пэ-о-четыре; б) калий-два-сэ-о-три
-
Рассчитайте массовую долю химических элементов в сложных веществах:
а) натрий-три-пэ-о-четыре; б) калий-два-сэ-о-три
-
Вычислите по химической формуле массу вещества:
а) количество вещества (натрий-три-пэ-о-четыре) = 0,5 моль;
б) количество вещества (калий-два-сэ-о-три) = 0,5 моль
-
Вычислите по химической формуле количество вещества:
а) масса (натрий-три-пэ-о-четыре) = 2 г;
б) масса (калий-два-сэ-о-три) = 2 г
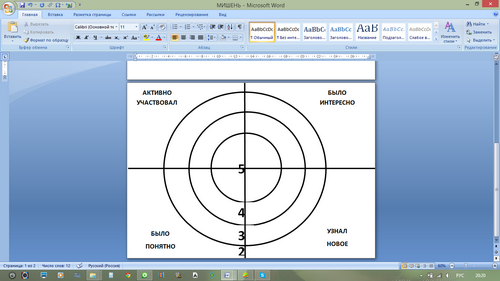
Рефлексия
(3 мин)
Стратегия "Мишень" (НП, ОКМ)
Домашнее задание
(2 мин)
Дифференцированные карточки с задачами (УВО, ТиО)