- Учителю
- Презентация Аминокислород 11 класс
Презентация Аминокислород 11 класс
Аминокислоты
Любое соединение, которое содержит одновременно карбоксильную и аминогруппу, является аминокислотой. Однако, чаще этот термин применяется для обозначения карбоновых кислот, аминогруппа которых находится в a-положении к карбоксильной группе.
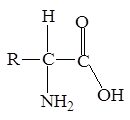
Аминокислоты, как правило, входят
в состав полимеров - белков. В природе встречается свыше 70 аминокислот, но только 20 играют важную роль в живых организмах. Незаменимыми называются аминокислоты, которые не могут быть синтезированы организмом из веществ, поступающих с пищей, в количествах, достаточных для того, чтобы удовлетворить физиологические потребности организма. Незаменимые аминокислоты приводятся в табл. 1. Для больных фенилкетонурией незаменимой аминокислотой является также тирозин (см. табл. 1).
Таблица 1
Незаменимые аминокислоты R-CHNH2COOH
СПОСОБЫ ПОЛУЧЕНИЯ АМИНОКИСЛОТ
1. Гидролизом белков можно получить около 25 аминокислот, но полученную смесь трудно разделить. Обычно одна или две кислоты получаются в значительно больших количествах, чем остальные, и эти кислоты удается выделить довольно легко - с помощью ионообменных смол.
2. Из галогензамещенных кислот. Один из наиболее распространенных методов синтеза a-аминокислот заключается в аммонолизе a-галогензамещенной кислоты, которую обычно получают по реакции Геля-Фольгарда-Зелинского:
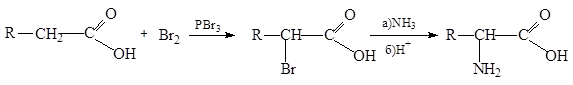
Этот метод можно модифицировать, получая a-бромзамещенную кислоту через малоновый эфир:
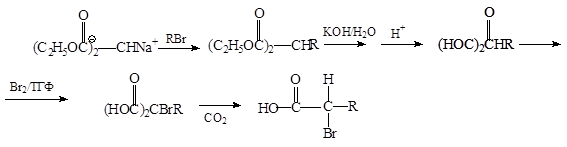
Ввести аминогруппу в эфир a-галогензамещенной кислоты можно с помощью фталимида калия (синтез Габриэля):
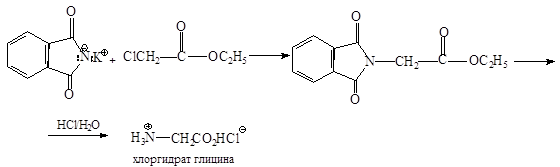
3. Из карбонильных соединений (синтез Штреккера). Синтез a-аминокислот по Штреккеру состоит в реакции карбонильного соединения со смесью хлорида аммония и цианистого натрия (это усовершенствование метода предложено Н.Д. Зелинским и Г.Л. Стадниковым).
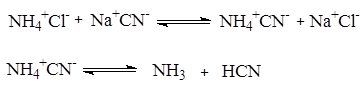
Реакции присоединения - отщепления с участием аммиака и карбонильного соединения дают имин, который реагирует с цианистым водородом, образуя a-аминонитрил. В результате его гидролиза образуется a-аминокислота.
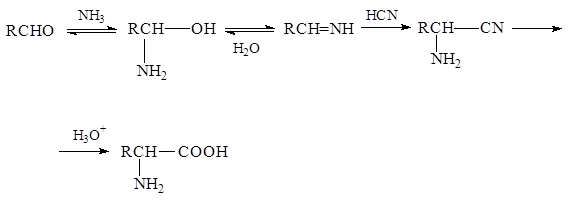
Химические свойства аминокислот
Все a-аминокислоты, кроме глицина, содержат хиральный a-углеродный атом и могут встречаться в виде энантиомеров:
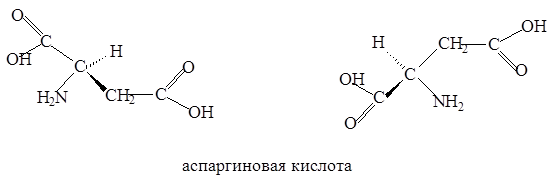
Было доказано, что почти все природные a-аминокислоты обладают одной и той же относительной конфигурацией при a-углеродном атоме. a-Углеродному атому (-)-серина была условно приписана L-конфигурация, а a-углеродному атому (+)-серина - D-конфигурация. При этом, если проекция a-аминокислоты по Фишеру написана так, что карбоксильная группа расположена сверху, а R - внизу, у L-аминокислоты аминогруппа будет находиться слева, а у D-аминокислоты - справа. Схема Фишера для определения конфигурации аминокислоты применима ко всем a-аминокислотам, обладающим хиральным a-углеродным атомом.
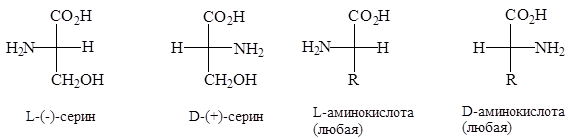
Из рисунка видно, что L-аминокислота может быть правовращающей (+) или левовращающей (-) в зависимости от природы радикала. Подавляющее большинство a-аминокислот, встречающихся в природе, относится к L-ряду. Их энантиоморфы, т.е. D-аминокислоты, синтезируются только микроорганизмами и называются «неприродными» аминокислотами.
Согласно номенклатуре (R,S), большинство «природных» или L-аминокислот имеет S-конфигурацию.
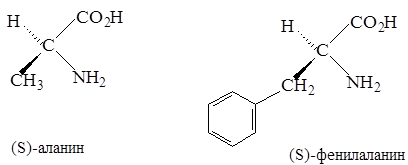
L-Изолейцин и L-треонин, содержащие по два хиральных центра в молекуле, могут быть любыми членами пары диастереомеров в зависимости от конфигурации при b-углеродном атоме. Ниже приводятся правильные абсолютные конфигурации этих аминокислот.
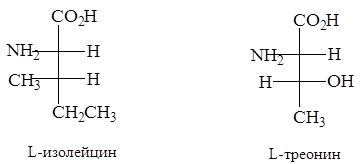
КИСЛОТНО-ОСНОВНЫЕ СВОЙСТВА АМИНОКИСЛОТ
Аминокислоты - амфотерные вещества, которые могут существовать в виде катионов или анионов. Это свойство объясняется наличием как кислотной (-СООН), так и основной (-NH2) группы в одной и той же молекуле. В очень кислых растворах NH2-группа кислоты протонируется и кислота становится катионом. В сильнощелочных растворах карбоксильная группа аминокислоты депротонируется и кислота превращается в анион.
В твердом состоянии аминокислоты существуют в виде цвиттер-ионов (биполярных ионов, внутренних солей). В цвиттер-ионах протон переносится от карбоксильной группы к аминогруппе:
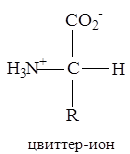
Если поместить аминокислоту в среду, обладающую проводимостью, и опустить туда пару электродов, то в кислых растворах аминокислота будет мигрировать к катоду, а в щелочных растворах - к аноду. При некотором значении рН, характерном для данной аминокислоты, она не будет передвигаться ни к аноду, ни к катоду, так как каждая молекула находится в виде цвиттер-иона (несет и положительный, и отрицательный заряд). Это значение рН называется изоэлектрической точкой (pI) данной аминокислоты.