- Учителю
- Методическое пособие по органической химии для учащихся – экстернов. 10 кл.III часть
Методическое пособие по органической химии для учащихся – экстернов. 10 кл.III часть
Методическое пособие по органической химии для учащихся - экстернов.
10 класс. 2 полугодие. II часть.
Органические соединения, содержащие функциональные группы.
СЛОЖНЫЕ ЭФИРЫ.
Продукты взаимодействия карбоновых кислот со спиртами ( см. тему карбоновые кислоты - реакция этерификации). Название сложного эфира состоит из названия радикала, образующего спирт и кислотного остатка: R1-COO-R2, где R1 -СОО- кислотный остаток и R2 - углеводородный радикал, например: СН3COOC2H5 - этилацетат, HCOOCH3- метилформиат, C3H7COOCH3 метилбутират и т.д.
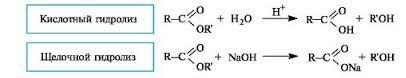
Основное химическое свойство эфиров - способность гидролизоваться в кислой и щелочной средах до исходных кислоты и спирта, т.е. реакция этерификации - обратимая реакция
§30, упр.14, с.117, упр.1,2,3,4,8, с.128.
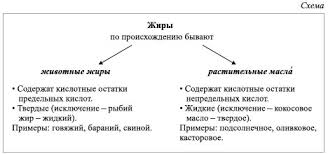
ЖИРЫ.
Сложные эфиры, образованные трехатомным спиртом глицерином и высшими карбоновыми кислотами
 .
.

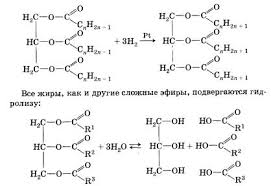
Растительные масла хорошо гидрогенизируются, превращаясь в маргарины:
§31, упр.9,12,14,15,с.129.
Бифункциональные соединения -УГЛЕВОДЫ-
Органические соединения, в состав которых входят одна карбонильная и несколько гидроксильных групп, причем водород и кислород входят в соотношении 2:1 (как в воде), отсюда и название.
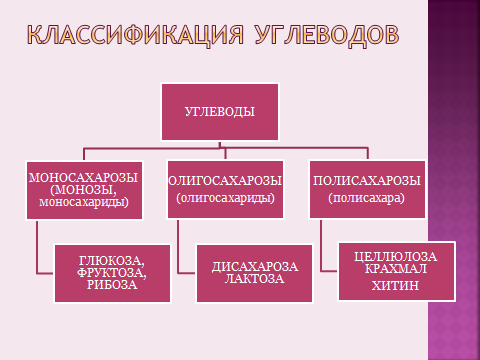
МОНОСАХАРИДЫ - углеводы, которые не гидролизуются. В зависимости от числа атомов углерода подразделяются на тетрозы, пентозы, гексозы. В зависимости от расположения в молекуле карбонильной группы подразделяются на альдозы и кетозы
ОЛИГОСАХАРИДЫ - низкомолекулярные полимерные соединения - углеводы, которые гидролизуются с образованием от двух до десяти молекул моносахаридов.
ПОЛИСАХАРИДЫ - высокомолекулярные полимерные соединения - углеводы, которые гидролизуются с образованием множества молекул моносахаридов.
МОНОСАХАРИДЫ.
-
Эмпирическая формула - Сx(Н2О)y, где x и y ≥ 4.
-
Родовое окончание -оза.
-
Изомерия:
-
Структурная - обусловлена расположением карбонильной группы: концевая - альдегидная и срединная - кетонная
-
Динамическая таутомерия - возможность одновременного существования молекулы в открытом виде (линейная) и закрытом виде (гетероцикличекая). Обусловлена возможностью вращения атомов углерода вокруг связей.
-
Пространственная изомерия- расположение гидроксильных групп при 1 и 2 углеродных атомов относительно плоскости гетероцикла
-
Оптическая изомерия.
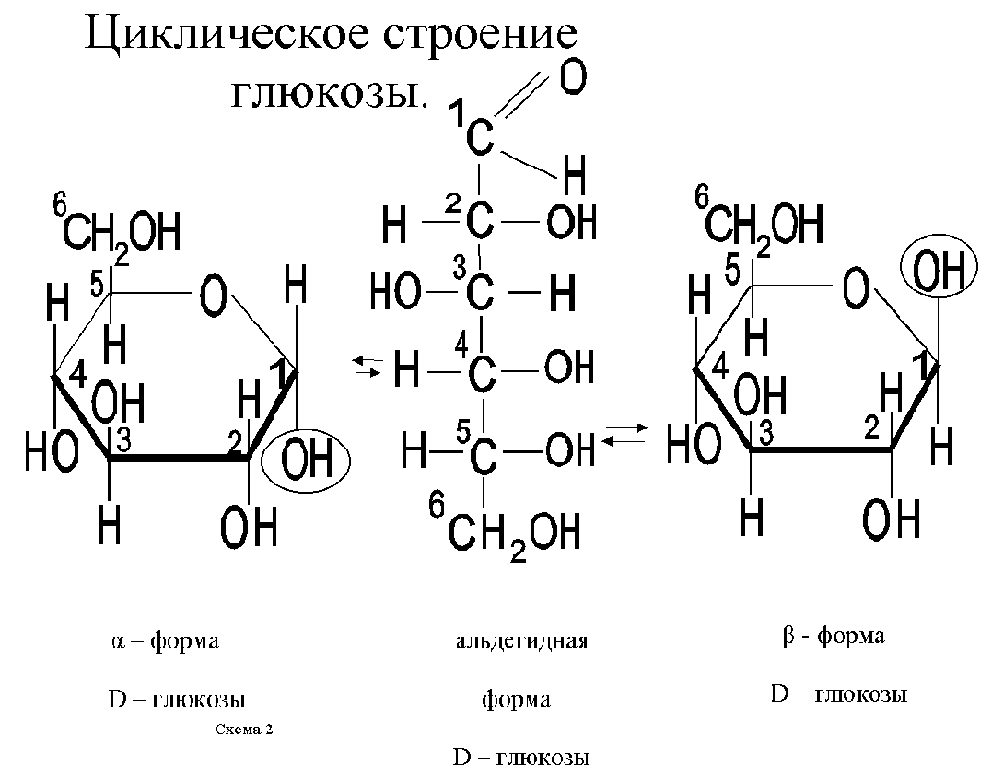
ГЛЮКОЗА.
-
С6Н12О6 - альдогексоза
-
Ее изомером является ФРУКТОЗА : С6Н12О6 - кетогексоза
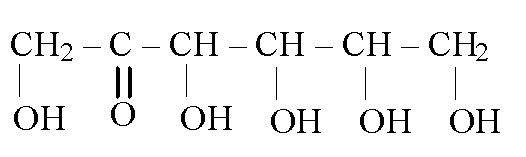 ИЛИ
ИЛИ
-
Пространственные изомеры глюкозы
α-глюкоза β-глюкоза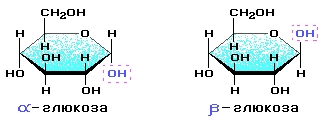
-
Получение глюкозы
-
Химические свойства - обусловлены наличием нескольких гидроксильных и одной карбонильной группы.
-
Реакция "серебряного зеркала"
СН2ОН - (СНОН)4 - СОН + Ag2O → СН2ОН - (СНОН)4 - СООН + +2Ag↓
2) Взаимодействие с гидроксидом меди (II)
СН2ОН - (СНОН)4 - СОН + 2Сu(ОН)2 → СН2ОН - (СНОН)4 - СООН + Сu2О + 2Н2 О
(осадок краснокирпичного цвета)
3) Гидрирование (восстановление) глюкозы
СН2ОН - (СНОН)4 - СОН + Н2 → СН2ОН - (СНОН)4 - СН2- ОН сорбит (шестиатомный спирт)
4) Специфическое свойство - брожение- разложение под действием ферментов
а) Спиртовое брожение (под действием дрожжей)
С6Н12О6 → 2 С2Н5ОН + 2СО2
б) Молочнокислое брожение (под действием молочнокислых бактерий)
С6Н12О6 → 2СН3-СН-СООН молочная кислота
ǀОН
в) Маслянокислое брожение
С6Н12О6 → С3Н7СООН + 2Н2↑ +2СО2↑ масляная кислота
ПРОДУКТЫ ПОЛИКОНДЕНСАЦИИ МОНОСАХАРИДОВ
-
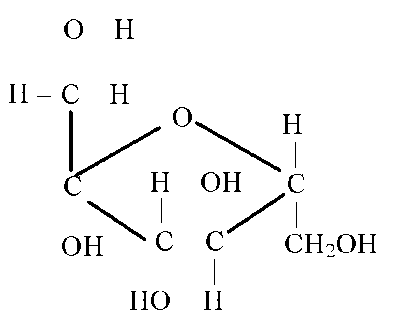
Олигосахариды - простой эфир глюкозы и фруктозы - САХАРОЗА:
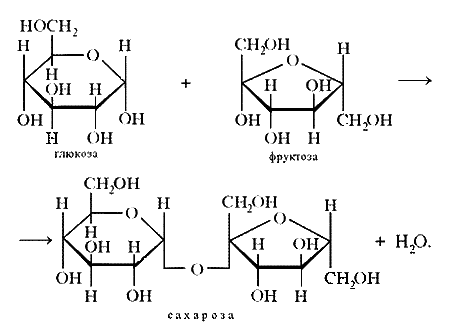
Легко подвергается гидролизу в присутствии Н2SО4: С12Н22011 → С6Н12О5 + С6Н12О6
глюкоза фруктоза
-
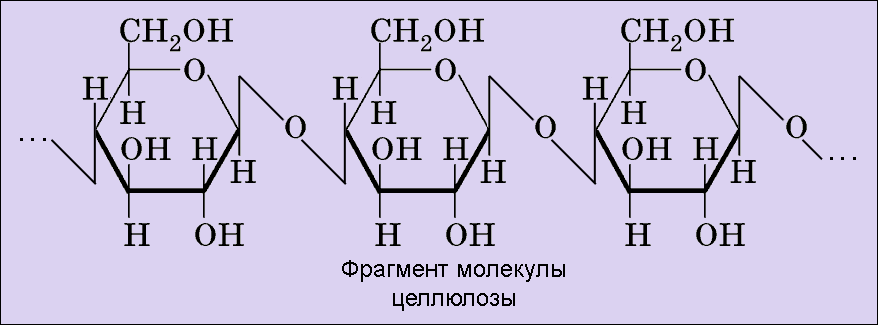
Полисахариды - крахмал и целлюлоза - простые полиэфиры α -глюкозы и β-глюкозы- являются пространственными изомерами
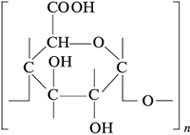
Элементарное звено α -глюкозы -
фрагмент молекулы крахмала
 линейная
и разветвленная структура крахмала
линейная
и разветвленная структура крахмала
Линейная структура целлюлозы

Полисахариды подвергаются гидролизу до глюкозы :
(C6H10O5)n + nH2O → nC6H12O6
-
Целлюлоза - характерно образование сложных эфиров (характерное свойство спиртовых групп)
-
С азотной кислотой - нитроэфиры - НИТРОЦЕЛЛЮЛОЗА
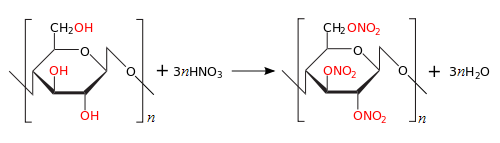
-
С уксусной кислотой - ацетаты целлюлозы
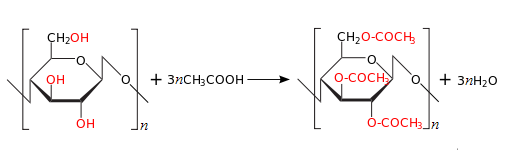
§§32,33,4,35, упр.5,7,11,18,21, с. 146
АЗОТСОДЕРЖАЩИЕ СОЕДИНЕНИЯ.
АМИНЫ.
Амины - продукты замещения атомов водорода в молекуле аммиака (NH3) на углеводородные радикалы.
Классификация:
-
по радикалу: предельные, непредельные, ароматические
-
по количеству аминогрупп: первичные, вторичные, третичные
ПЕРВИЧНЫЕ ПРЕДЕЛЬНЫЕ АМИНЫ
-
Общая формула: R-NH2
-
Молярная масса М=14п+17, где п≥1
-
Родовое окончание -АМИН, например, СН3-NH2 - метиламин; CH3-CH2-NH2 - этиламин
-
Смещение электронной плотности молекулы
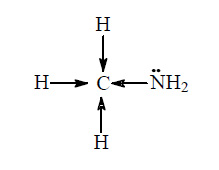
В результате электронная плотность на атоме азота увеличивается и метиламин является более сильным основанием, чем аммиак. В молекуле диметиламина атом водорода соединен с двумя метильными радикалами, и к атому азота передается электронная плотность от шести атомов водорода, поэтому электронная плотность на атоме азота больше, чем в молекуле метиламина, и диметиламин является более сильным основанием, чем метиламин. Наконец, в молекуле триметиламина три метильных радикала при атоме азота, и происходит смещение электронов к атому азота от девяти атомов водорода. Поэтому триметиламин является, в свою очередь, более сильным основанием, чем диметиламин. Таким образом, у метиламина основные свойства выражены слабее всего, а у триметиламина - сильнее всего.
-
Тип изомеризации - по радикалу
-
Физические свойства: низшие - газообразные, с увеличением молекулярной массы уменьшается растворимость в воде, жидкости или твердые.
-
Химические свойства похожи на свойства аммиака:
-
амины - органические основания, более сильные, чем аммиак
-
взаимодействуют с водой, с образованием аммонийных оснований
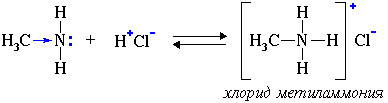
-
с кислотами - с образованием солей
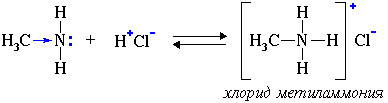 ,
которые
,
которые
-
взаимодействуют со щелочами - качественная реакция- вытесняя амины из солей:
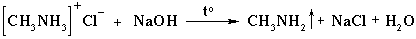
-
реакция жесткого окисления: горение с выделением свободного азота
4СH3NH2 + 9O2 → 4CO2↑ + 10H2O + 2N2↑
-
Получение: взаимодействие галогеналканов с аммиаком:
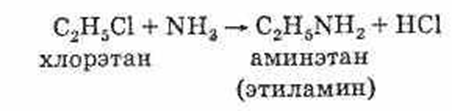
ПЕРВИЧНЫЙ АРОМАТИЧЕСКИЙ АМИН - АНИЛИН.
(аминобензол, фениламин)
-
Физические свойства - бесцветная маслянистая жидкость с характерным запахом, малорастворим в воде, ядовит.
-
Химические свойства: неподеленная электронная пара азота притягивается электронную плотность на атоме на атоме, поэтому обладает очень слабыми основными свойствами.
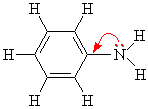
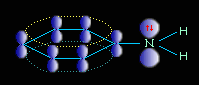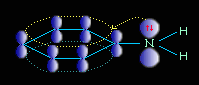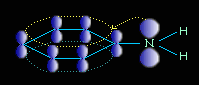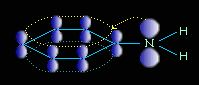
Уменьшение электронной плотности на атоме азота приводит к снижению способности отщеплять протоны от слабых кислот. Поэтому анилин взаимодействует лишь с сильными кислотами (HCl, H2SO4), а его водный раствор не окрашивает лакмус в синий цвет.
Таким образом, основные свойства изменяются в ряду:
C6H5NH2 < NH3 < RNH2 < R2NH < R3N (в газовой фазе)
-
Реакции с участием аминогруппы - аналогичны с алифатическими аминами
-
Реакции с участием бензольного кольца: поляризация орто- и пара- атомов углерода бензольного ядра облегчает реакции замещения, например:
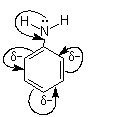
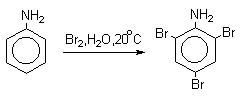
-
Получение - реакция Н.Н.Зинина: восстановление ароматических нитросоединений атомарным водородом ( в момент выделения при взаимодействии железа с сильной кислотой)
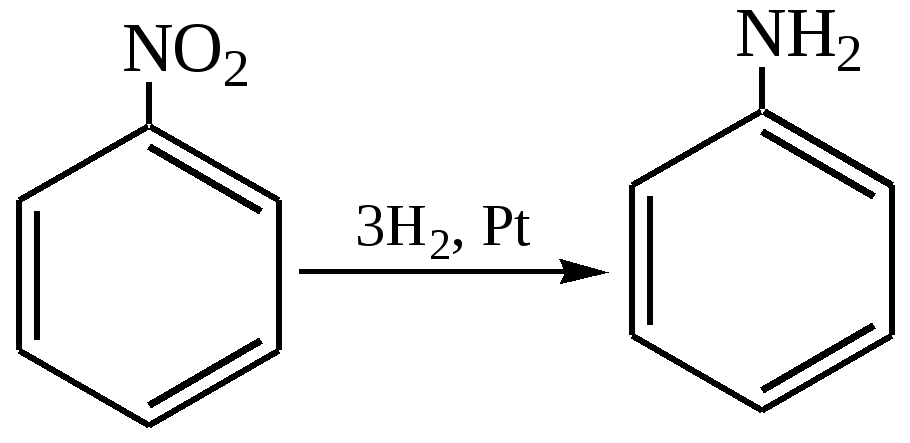
§36, упр.1-7 с.157,§37, упр.12,13, с.157
БИФУНКЦИОНАЛЬНЫЕ СОЕДИНЕНИЯ - АМИНОКИСЛОТЫ.
Производные углеводородов, содержащие аминогруппы (-NH2) и карбоксильные группы ( - C=O ).
\
OH
Классификация :
-
по числу функциональных групп
-
по положению аминогруппы
Изомерия аминокислот обусловлена различным строением углеродного скелета и различным расположением функциональных групп ( - NH2 и -COOH ) в молекуле. Наибольшее значение имеют α-аминокилоты ( группа -NH2 расположена у соседнего с карбоксильной группой атомом углерода), являющиеся строительным материалов белков. Представляют бесцветные кристаллические вещества, хорошо растворимые в воде.
Аминокислоты являются органическими амфотерными соединениями - по двум разным функциональным группам - поэтому при растворении в воде образуют биполярный ион (цвиттер):
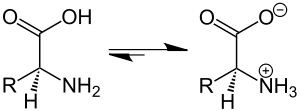
Основным свойством аминокислот является взаимодействие друг с другом с образованием ПЕПТИДОВ.
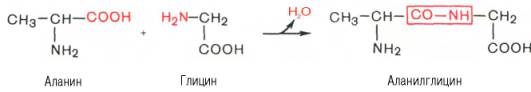
§37, упр.12,13, с.157
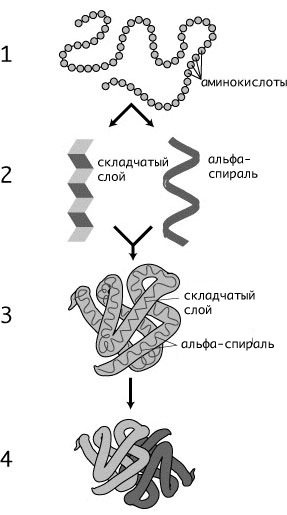
БЕЛКИ
Природные высокомолекулярные соединения (биополимеры), структурную основу которых составляют полипептидные связи, построенные из остатков α-аминокислот.
Различают 4 уровня структурной организации белковых молекул ( см .схему на сл. стр.).
-
Первичная структура - это число и последовательность аминокислотных остатков в полипептидной цепи. Потенциально возможное число белков с различной первичной структурой практически не ограничено(1).
-
Вторичная структура белков - это α-спираль, которая образуется в результате скручивания полипептидной цепи за счет водородных связей между группами (2)
-С- и - N -
‖ │
O H
-
Третичная структура белка - пространственная конфигурация спирали - глобула (свернут в «клубок»), которая поддерживается за счет дисульфидных, ионных и других связей (3)
-
Четвертичная структура белка -способ совместной укладки нескольких полипептидных цепей (ассоциаты)(4)
Денатурация - разрушение 3-х надструктур (кроме первичной) под воздействием температуры, спиртов, солей тяжелых металлов, радиации.
-
 §38,
упр.1-4,6, с.162
§38,
упр.1-4,6, с.162
-
Вопросы для самопроверки.
-
Составьте формулы сложных эфиров: уксуснобутилового и муравьинопропилового.
-
Какова масса этилового эфира муравьиной кислоты, если масса спирта 46 г и масса кислоты 23 г? Выход эфира равен 80%. /29,6г/
-
Какой вид изомеров характерен для эфиров?
-
В чем отличие простого эфира от сложного по строению и получению?
-
К какому классу сложных веществ относятся мыла?
-
Напишите уравнения реакций окисления и восстановления глюкозы.
-
Как доказать, что в молекуле глюкозы имеется 5 гидроксогрупп?
-
Почему глюкоза обладает свойствами альдегида?
-
При сжигании 46,5 г анилина выделилось 1698 кДж. Составьте термохимическое уравнение этой реакции. /13584,8 кДж/
-
Напишите уравнение Н.Н.Зинина.
-
Какова причина двойной функции аминокислот?
-
Что такое денатурация белка?
-
</ Источник информации.
-
Г.Е.Рудзитис и др. Органическая химия: учебник для 10 кл. общеобразовательных учреждений. 12 изд., М.:Просвещение, ОАО «Московские учебники, 2009.