- Учителю
- Методическая разработка урока по химии Алканы
Методическая разработка урока по химии Алканы
Конспект урока по теме «Алканы. Предельные, насыщенные углеводороды»
Цель урока: познакомить студентов с алканами (строение молекул алканов, ознакомление с изомерией предельных углеводородов, номенклатурой алканов, их физическими и химическими свойствами, основными способами получения) и выявить их важную роль в промышленности.
Задачи урока:
Образовательная: рассмотреть гомологический ряд предельных углеводородов, строение, физические и химические свойства, способы их получения при переработке природного газа, возможности их получения из природных источников: природного и попутного нефтяного газов, нефти и каменного угля. Развивающая: развить понятие о пространственном строении алканов; развитие познавательных интересов, творческих и интеллектуальных способностей, развитие самостоятельности в приобретении новых знаний с использованием новых технологий. Воспитательная: показать единство материального мира на примере генетической связи углеводородов разных гомологических рядов, получаемых при переработки природного и попутного нефтяного газов, нефти и каменного угля.
Оборудование: компьютер, мультимедиа проектор, экран, презентация, таблица,модель молекулы метана.
Тип урока: формирования умений и навыков.
Ход урока.
I. Организационный момент. (Сообщить цель и тему урока).
II. Изучение нового материала.

План изучения алканов.
1.Определение. Общая формула класса углеводородов. Гомологический ряд. 2.Изомерия алканов. Строение алканов. Физические свойства. Способы получения. Химические свойства. Применение.
1. Определение. Общая формула класса.( Слайд 1)
Что такое углеводороды?
«Это органические соединения состоящие из двух элементов - углерода и водорода».
Алканы - углеводороды в молекулах которых все атомы углерода связаны одинарными связями (-) и имеют общую формулу: CnH2n+2.
Задание. Выведите формулу алкана, если n=3, 5, 7.
2. Гомологический ряд. ( Слайд 2)
Что такое гомологи?
-«Гомологи - это вещества, сходные по строению и свойствам и отличающиеся на одну или более групп СH2.»
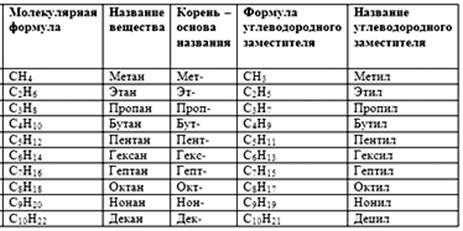
Простейшим представителем алканов является - метан СН4. Следующим за ним гомологом является - этан С2Н6.
Мысленно прибавляя к этану группу СH2, скажите формулы следующих за ними гомологов.
Итак у нас получился гомологический ряд алканов. Как видим суффикс «ан» является общим для всех алканов, а начиная с пятого гомолога название алкана образуется от греческого числительного, указывающего число атомов углерода в молекуле и суффикса «ан».
Таблица «Гомологический ряд алканов». (Слайд 3)
 (Слайд 4)
(Слайд 4)
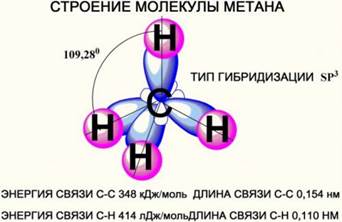
Тетраэдрическое строение метана (Слайд 5)
s-связи между атомами Н и С прочные, практически неполярные (очень мало полярные).
Атомы вокруг простых связей постоянно вращаются. Поэтому молекулы алканов могут принимать разные формы. При этом длина связи и угол между связями остаются постоянными. Формы, переходящие друг в друга за счет вращения молекулы вокруг σ-связей, называют конформациями молекулы. Рис. 2.
Технологическая карта урока
Фронтальный опрос:
1. Что такое углеводороды?
2.Что такое гомологи?
Проектор для показа,
Отвечают на вопросы, работа в тетрадях.
3. Усвоение новых знаний 25 мин.
Организация работы с учебником, проверка записей в тетради.
Презентация
указывают признаки реакций
записывают уравнения реакций, указывают признаки реакций
4. подведение итогов урока 4 мин
На уроке была рассмотрена тема «Алканы. Строение молекул, номенклатура, физические свойства». Вы узнали о том, что представляют собой алканы (нециклические углеводороды, в которых атомы углерода соединены простыми связями), как их правильно обозначать и какими физическими свойствами обладают эти вещества, области их применения.
Делают выводы
5. закрепление
5 мин.
Учитель организует фронтальную проверку выполнения задания
Просмотр видеофрагмента
« Алканы», тесты.
Тест по теме алканы.
6. Рефлексия.
Составьте в группе кластер - опорный конспект, графический организатор, сделать вывод о изомерии предельных углеводородов, номенклатуре алканов, их физические и химические свойства, основные способы получения) и выявить их важную роль в промышленности .
Предлагает создать синквейн по теме.
Выделяют, проговаривают вслух .Работают самостоятельно в тетрадях, затем представляют синквейн.
7. домашнее задание с комментированием 2 мин.
Учитель сообщает учащимся о домашнем задании, разъясняет методику его выполнения: стр.120-127( зад.4-6), конспекты.
лддд
Записывают домашнее задание .
3. Изомерия алканов. (Слайд 6)
Что такое изомерия?
«Изомерия - это явление при котором вещества, имеют один и тот же химический состав, но разное строение и свойства.»
Первые три члена гомологического ряда алканов - метан, этан, пропан - не имеют изомеров. Четвертый член - бутан C4H10 отличается тем, что имеет два изомера: нормальный бутан с неразветвленной углеродной цепью и изобутан с разветвленной цепью.
CH3-CH2-CH2-CH3(бутан) CH3-CH-CH3 (2-метилпропан)
I СН3
Вид изомерии, при которой вещества отличаются друг от друга порядком связи атомов в молекуле, называется структурной изомерией или изомерией углеродного скелета.
4. Строение алканов. (Слайд 7)
Химические связи какого типа присутствуют в молекулах углеводородов?
«Химические связи, образующиеся в результате перекрывания орбиталей вдоль линии, соединяющей центры ядер двух атомов, называют сигма - связями»
«Химические связи, образующиеся в результате перекрывания орбиталей в двух областях, т. е. вне линии, соединяющей центры ядер атомов, называют пи-связями». (Слайд 8)
Атом углерода во всех органических веществах находится в "возбуждённом" состоянии, т. е. имеет на внешнем уровне четыре неспаренных электрона. В образовании химической связи участвуют 1 s и 3 р электронные орбитали. В результате их слияния происходит образование 4 гибридных облаков (sp3 - гибридизация. (Слайд 9)
5. Физические свойства. (Слайд 10)
Таблица « Зависимость температур кипения и плавления алканов от молекулярной массы».
Гомологи отличаются молекулярной массой и, следовательно, физическими характеристиками. С увеличением числа углеродных атомов в молекуле алкана (с ростом молекулярной массы) в гомологическом ряду наблюдается закономерное изменение физических свойств гомологов (переход количества в качество): повышаются температуры кипения и плавления, увеличивается плотность. (Слайд 11)
Алканы от СН4 до С4Н10 - газы, от С5Н12 до С17Н36 - жидкости, далее - твердые вещества.
6. Получение. (Слайд 12)
В промышленности алканы выделяют из природных источников (природный и попутный газы, нефть, каменный уголь).
В лаборатории алканы получают сплавлением ацетата натрия с твердым гидроксидом натрия.
1. CH3COONa + NaOH ¾® CH4 + Na2CO3
Более сложные алканов получают при взаимодействии галогенопpоизводных предельных углеводоров с металлическим натрием.
2. 2CH3Cl + 2Na ¾® CH3-CH3 + 2NaCl (реакция Вюpца). (Слайд 13)
7. Химические свойства. (Слайд 14)
Химические свойства любого соединения определяются его строением, т. е. природой входящих в его состав атомов и характером связей между ними.
1. Предельные углеводороды при нагревании горят:
СН4 + 2О2 →СО2 + 2Н2О
смесь метана с кислородом (1:2) при поджигании взрывается. (Слайд 15)
2. Разлагаются при нагревании при 1000 ºС до простых веществ:
СН4 → С+ 2Н2
при нагревании до 1500С из метана получают ацетилен. (Слайд 16)
2СН4 → С2Н2+3Н2
3. Хлорирование метана: (Слайд 17)
1 стадия CH4 + Cl2 ® CH3Cl +HCl
2 стадия CH3Cl + Cl2 ® CH2Cl2 +HCl
3 стадия CH2Cl2 + Cl2 ® CHCl3 + HCL
4 стадия CHCl3 + Cl2 ® CCL4 + HCL
4. Реакции изомеризации идут при нагревании и в присутствии катализатора. Изомеризация пентана (с хлоридомалюминия)
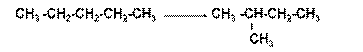
8. Применение. (Слайд 18)
Метан и его производные имеют большое практическое применение: в качестве топлива, являются сырьем для производства органических веществ, растворителей, горючего для дизельных и турбореактивных двигателей.
III. Закрепление.
Тест по теме «Алканы».
1. Состав алканов отражает общая формула. . .
а) CnH2n б) CnH2n+2 в) CnH2n-2 г)СnH2n-6
Варианты ответов (выберите правильный):
Ответ_1: формула а
Ответ_2: формула б
Ответ_3: формула в
Ответ_4: формула г
2. Какие соединения относятся к гомологическому ряду метана:
а) С2Н4 б) С3Н8 в) С4Н10 г) С5Н12 д) С7Н14 ?
Ответ_1: соединения а, в, г
Ответ_2: соединения б, г, д
Ответ_3:соединения б, в, г
Ответ_4: соединения г, д
3. Какое из соединений, получится при нагревании метана без доступа воздуха при температуре 1500О
Ответ_1: этилен
Ответ_2: ацетилен
Ответ_3: углекислый газ
Ответ_4: сажа
4. С какими реагентами могут взаимодействовать алканы:
а) Br2 (р-р); б) Br2, t°; в) H2SO4 (25 °С);
г) HNO3 (разб), t°; д) KMnO4 (25 °С); е) NaOH?
Ответ_1: а, б, г, д
Ответ_2: б, в, е
Ответ_3: а, д
Ответ_4: б, г
5. К какому типу относится реакция взаимодействия хлора с метаном (на свету)
Ответ_1: окисления
Ответ_2: изомеризации
Ответ_3: замещения
Ответ_4: соединения
6. Какой галогеналкан нужен для получения
2,5-диметилгексана по реакции Вюрца без побочных продуктов?
Ответ_1: 2-бром-2-метилпропан
Ответ_2: 2-бромпропан + 1-бром-3-метилбутан
Ответ_3: 1-бром-2-метилпропан
Ответ_4: бромэтан + 1-бромбутан
Подведение итога урока
На уроке была рассмотрена тема «Алканы. Строение молекул, номенклатура, физические свойства». Вы узнали о том, что представляют собой алканы (нециклические углеводороды, в которых атомы углерода соединены простыми связями), как их правильно обозначать и какими физическими свойствами обладают эти вещества.
III.Рефлексия. Составьте в группе кластер - опорный конспект, графический организатор, сделать вывод о изомерии предельных углеводородов, номенклатуре алканов, их физические и химические свойства, основные способы получения) и выявить их важную роль в промышленности . . Предлагает создать синквейн по теме.
IV. Домашнее задание: стр.120-127( зад.4-6), конспекты.О.С. Габриелян Химия для профессий и специальностей социально-экономического и гуманитарного профиля.
Список литературы
1. Химия. О.С. Габриелян для профессий и специальностей социально-экономического и гуманитарного профиля.-М .Академия, 2013.-206с.
2. Химия. 10 класс. Профильный уровень: учеб. для общеобразоват. учреждений/ В.В. Еремин, Н.Е. Кузьменко, В.В. Лунин и др. - М.: Дрофа, 2012. - 463 с.
3. Химия. 11 класс. Профильный уровень: учеб. для общеобразоват. учреждений/ В.В. Еремин, Н.Е. Кузьменко, В.В. Лунин и др. - М.: Дрофа, 2013. - 462 с.
Дополнительные рекомендованные ссылки на ресурсы сети Интернет
1. Interneturok.ru (Источник).
2. Органическая химия (Источник</).