- Учителю
- Урок химии в 8 классе Кислоты
Урок химии в 8 классе Кислоты
Урок химии в 8-м классе по теме: "Кислоты."
Цели урока:
-
Образовательная: Познакомить учащихся с одним из важнейших классов неорганических соединений, изучить классификацию и номенклатуру кислот.
-
Развивающая: Совершенствовать практические умения и навыки работы с лабораторным оборудованием и химическими реактивами; дополнить знания учащихся о правилах работы в химическом кабинете; развивать умение наблюдать, делать выводы.
-
Воспитательная: Продолжить формирование умения высказывать свои взгляды, суждения, развития химической речи; формировать мировоззренческие понятия о познаваемости природы.
Тип урока: урок формирования новых знаний.
Форма урока: комбинированный урок.
Методы и методические приемы: объяснительно-иллюстративные (рассказ с элементами беседы, демонстрация презентации), создание проблемной ситуации, практическая работа.
Предполагаемые результаты обучения:
-
знать: понятие «кислота», формулы кислот, классификацию кислот, признаки действия кислот на индикаторы; правила ТБ при работе с кислотами, химические свойства кислот.
-
уметь: выбирать формулы кислот среди предложенных формул веществ, классифицировать кислоты по наличию кислорода, по числу атомов водорода, определять кислоту с помощью индикаторов, работать с растворами кислот, соблюдая правила техники безопасности, составлять химические уравнения реакций.
Оборудование:
-
компьютер, мультимедийный проектор, презентация Power Point;
-
набор для практической работы учащихся: штатив с пробирками, прибор для нагревания, индикаторы (лакмус, универсальная индикаторная бумага), растворы кислот HCl, H2SO4, основания NaOH, оксиды - CuO, соли CaCO3, Ba(NO3)2,таблетки аскорбиновой кислоты, яблоко, лимон.
-
рабочий лист</<font face="Times New Roman, serif">, содержащий задания и описания опыта.
-
Ход урока
Раздел «Воспоминаний» (10 мин.) слайд 4-9
Мы знакомимся с основными классами неорганических соединений.
Вспомним, с какими классами веществ вы уже знакомы?
Загадка:
Если в паре элементов
Кислород вторым стоит,
Ты же знаешь, эта пара
Называется … (оксид).
Вопросы:
Что такое оксиды? Чем они отличаются от других классов
веществ?
Загадка:
Если формулы начало
Представляется с металла,
ОН - красуется затем,
Вещества знакомы всем.
Не надо придумывать им название
Ведь эти вещества… (основания).
Дают определение оксидам.
Вопросы:
Что такое основания? Как отличить основание от других
классов?
Дают определение основаниям. Объясняют что такое индикаторы.
Если видишь с водорода
Вдруг, да формула начнется,
То таких с десяток формул
Выучить тебе придется!
Вот эта видишь с кислородом,
Бескислородная вон та,
Но у них одна природа,
Все с названьем…. (кислота)!
Что такое кислоты? Где кислоты встречаются в природе? Как получают кислоты?
Задание:
Распределите формулы по классам в таблицу
Работают по заданию в рабочем листе; распределяют предложенные
формулы в таблицу по классам:
HCl, HNO3, H2SO4,
Ca(OH)2, K2O, Na2O,
Al2O3, Zn(OH)2,
Al(OH)3.
Таблица 1.
ОСНОВАНИЯ
КИСЛОТЫ
III. Изучение нового материала.
Тема урока «Кислоты»
Записывают в рабочем листе.
1) Классификация кислот (5мин.) (работа со
слайдом №11).
Вопросы:
Чем отличаются приведённые пары кислот? На какие группы можно
разделить кислоты? (слайды №12,№13, 14,15)
Задание:
Чем отличаются приведённые пары кислот?
По примерам кислот называют признаки классификации.
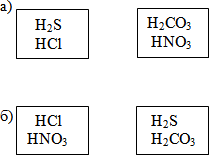
Ответ:
а) По наличию кислорода: бескислородные и
кислородсодержащие (заполнение схемы 1 в рабочем листе).
б) По количеству водорода: одноосновные, двухосновные,
трёхосновные (заполнение схемы1 и 2 в рабочем листе).
Вопрос:
Какие кислоты вам знакомы из жизненного опыта?
Яблочная, лимонная, уксусная, молочная и др.
в) По происхождению: органические и неорганические.
2) Физические свойства кислот. (3
мин.)
а) Физические
Задание:
определить вкус аскорбиновой кислоты, рассмотреть агрегатное
состояние вещества, внешний вид серной и соляной кислот и
растворимость кислот в воде.
- вкус
- агрегатное состояние
- растворимость в воде
Опытное определение вкуса аскорбиновой кислоты, яблочной
кислоты и лимонной кислоты (В химической лаборатории запрещено
вещества пробовать на вкус).
Выводы:
большинство кислот кислые на вкус
жидкости (исключение H2SiO3)
хорошо растворимые в воде (исключение
H2SiO3)
3) Химические свойства кислот
б) Правила ТБ при работе с едкими веществами. (1 мин.)
Слайд 20
в) Химические свойства кислот (форма работы: парная). (15
мин.)
Опыт1. Исследование окраски индикаторов в кислотных
средах.
Опыт 2. Взаимодействие кислот с основаниями - реакция нейтрализации.
Опыт 3. Взаимодействие кислот с металлами.
Опыт 4. Взаимодействие кислот с солями.
Опыт 5 Взаимодействие кислот с оксидами
Выполнение опыта по описанию в рабочем листе. Исследование окраски индикаторов в кислотных средах и занесение результатов в таблицу 2. (проверка по слайду 21).
Работа в рабочих листах: Задание 2. Составление уравнений реакций.
4) Применение кислот. (1
мин.)
Медицина: аскорбиновая, фолиевая, линолевая, ацетилсалициловая
(слайд 24).
IV. Закрепление знаний.
Рассмотрены ли вопросы намеченные по теме «Кислоты»
(Состав,
классификация,
свойства.
Повторение основных разделов темы: определение кислот; классификация; физические и химические свойства; правила ТБ.
Задание 3 на рабочем листе. (2 мин.)
Индивидуальное выполнение заданий и взаимопроверка.
IV. Итог урока, рефлексия. (1 мин.)
Закончите предложение
«Урок был ...»
Характеризуют урок, образуя разные формы от слова «кислый».
V. Домашнее задание (1 мин.)
Рабочий лист
Дата ______________
Ф. И. ________________
Урок по теме: «Кислоты. Химические свойства кислот в свете теории электролитической диссоциации»
Задание №1.
Распределите предложенные формулы по классам:
HCl, HNO3, H2SO4, Cа(OH)2, K2O, Nа2O, Al2O3, Zn(OH)2, Al(OH)3.
Таблица 1.
Классификация кислот.
Схема 1. Схема 2.
Кислоты Кислоты
__________ ____________ _____________ ____________
________________
Опыт. Химические свойства кислот.
Налейте в 2 пробирки 1-2мл соляной кислоты HCl и добавьте в пробирку №1 несколько капель индикатора, а в пробирку №2 универсальную индикаторную бумагу.
Запишите свои наблюдения в таблицу 3.
Таблица 2. Изменение окраски индикатора.
Задание №2 Химические свойства кислот.
Составить уравнения химических реакций взаимодействия кислот в молекулярном и ионном виде:
-
С основаниями (Реакция нейтрализации)
__________________________________________________________________________
-
С металлами: ______________________________________________________
-
С солями более слабых кислот:
__________________________________________________________________________________________________________________________________________________________
-
С оксидами:
_______________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Задание №3 «Третий лишний»
Укажите кислоту, которая не соответствует признаку, объединяющему две другие. Назовите кислоты.
а) H2S б)H2SO4 в)HNO3
HNO3 H3PO4 HF
H3PO4 H2CO3 HBr
Урок был _________________________
Домашнее задание: Заполнить таблицу №3.
Таблица 3. Номенклатура кислот и солейФормула
кислоты
Название кислоты
Кислотный
остаток
Пример
соли
Название соли
1
HCl
2
HBr
3
H2S
4
H2SO4
5
H2SO3
6
HNO3
7
H2CO3
8
H2SiO3
9
H3PO4
Итоговая оценка: ________________________
Рабочий лист
Дата ______________ Вариант 2.
Ф. И. ________________
Урок по теме: «Кислоты»
Задание №1.
Распределите предложенные формулы по классам:
HBr, H2CO3, Fe(OH)3, MgO, SO3, KOH, H2SO3, Cu(OH)2, WO3
Таблица 1.
Классификация кислот.
Схема 1. Схема 2.
Кислоты Кислоты
__________ ____________ _____________ ____________
________________
Опыт. Химические свойства кислот.
Налейте в 4 пробирки 1-2мл соляной кислоты HCl и добавьте в пробирки №1 - №3 несколько капель индикаторов, а в пробирку №4 универсальную индикаторную бумагу.
Запишите свои наблюдения в таблицу 3.
Таблица 2. Изменение окраски индикатора.
Задание №2 Химические свойства кислот.
Составить уравнения химических реакций взаимодействия кислот:
-
С металлами Zn+H2SO4 =
-
С основными оксидами MgO+H2SO4 =
-
С основаниями Fe(OH)2+H2SO4 =
-
С солями Ba(NO3)2+H2SO4 =
Задание №3 «Третий лишний»
Укажите кислоту, которая не соответствует признаку, объединяющему две другие. Назовите кислоты.
а) H2S O4 б)H2SiO3 в)HNO3
HJ H3PO4 H2SO4
H3PO4 H2SO3 HBr
Урок был _________________________
Домашнее задание: Заполнить таблицу №3.
Фамилия, имя________________
Таблица 3. Номенклатура кислот и солейФормула
кислоты
Название кислоты
Кислотный
остаток
Пример
соли
Название соли
1
HF
2
HCl
3
HBr
4
HI
5
H2S
6
H2SO4
7
H2SO3
8
HNO3
9
HNO2
10
H2CO3
11
H2SiO3
12
H3PO4
«КИСЛОТЫ»

