- Учителю
- Промежуточная аттестация 9 класс
Промежуточная аттестация 9 класс
Демонстрационный вариант № 1
контрольных измерительных материалов для
проведения в 2017 году промежуточной аттестации
по ХИМИИ
1. Начало формы1. На приведённом рисунке
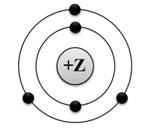
изображена модель атомабора
2)
алюминия
3)
азота
4)
бериллия
Конец формы
2. Кислотному оксиду и кислоте соответствуют формулы веществ
Na2O и NaOH
2)
N2O и NaNO3
3)
NO и H3N
4)
N2O5 и HNO3
3. Одинаковое число молей катионов и анионов образуется при полной
диссоциации в водном растворе 1 моль
1) H2SO4 2) (NH4)2S 3) BaCl2 4) CuSO4
4. Взаимодействию гидроксида меди(II) с раствором серной
кислоты соответствует сокращённое ионное уравнение =
Cu(OH)2
2)
Сu2+ + SO42- = СuSO4
3)
Cu(OH)2 + 2H+ = Cu2+ + 2H2O
4)
Cu(OH)2 + SO42- = CuSO4 + 2OH-
5.На какой диаграмме распределение массовых долей элементов соответствует количественному составу силиката калия?
2)
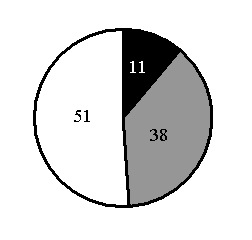
3)
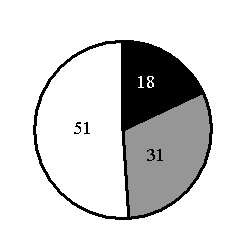
4)
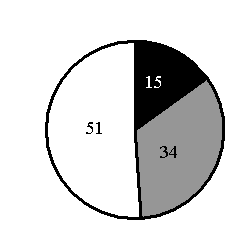
6. Верны ли суждения о безопасном обращении с химическими веществами?
А. Разбитый ртутный термометр и вытекшую из него ртуть следует
выбросить в мусорное ведро.
Б. Красками, содержащими соединения свинца, не рекомендуется покрывать
детские игрушки и посуду.
1) верно только А 2) верно только Б
3) верны оба суждения 4) оба суждения неверны
Ответом к заданиям 7-9 является последовательность цифр,
которые следует записать в БЛАНК ОТВЕТОВ справа от номера
соответствующего задания, начиная с первой клеточки. Ответ
записывайте без пробелов, запятых и других дополнительных символов.
Каждую цифру пишите в отдельной клеточке в соответствии с
приведёнными в бланке образцами.
7. В ряду химических элементов O → S → Se увеличивается число
электронов в атоме
2)
уменьшаются заряды ядер атомов
3)
возрастает способность атомов принимать электроны
4)
возрастают радиусы атомов
5)
уменьшается число электронов во внешнем электронном слое атомов
8. Установите соответствие между веществами и признаком
протекающей между ними реакции. К каждому элементу первого столбца
подберите соответствующий элемент из второго столбца.
Б)
KCl и AgNO3
В)
NaOH и H2SO4
образование белого осадка
2)
выделение газа
3)
растворение осадка
4)
видимые признаки реакции отсутствуют
Б)
серная кислота
В)
цинк
KNO3, СО2
2)
Cl2, NaOH
3)
CO2, HCl
4)
KOH, Na2CO3
Конец формы
10. Используя метод электронного баланса, расставьте коэффициенты в
уравнении реакции, схема которой
HI + H2SO4 → I2 + H2S + H2O
Определите окислитель и восстановитель