- Учителю
- Конспект урока по химии и физике на тему Строение атома и физика ядра атома
Конспект урока по химии и физике на тему Строение атома и физика ядра атома
Интегрированный урок химия + физика
по теме «Строение атома. Физика атомного ядра».
Авторы: Маркова Л.Н. - учитель химии,
Пирогова Т.Г. - учитель физики.
Роль и место данной темы в курсе.
-
В школьном курсе физики и химии довольно много времени отводится на изучение темы «строение атома, физика атомного ядра», в тестах ЕГЭ предлагаются задания по этой теме, они включены в тесты централизованного тестирования. Эта тема изучается в 8-х,9-х классах, но более углубленно изучается в 11-м классе.
Тип урока.
-
Урок обобщения и изучения нового материала.
Вид урока.
-
Интегрированный урок (химия, физика) 11 класс.
Цель урока.
-
Сформировать целостное представление об атоме и показать единство законов физики и химии.
Задачи:
-
Обобщить знания из курсов физики и химии о строении атома.
-
Познакомить учащихся с историей открытия атома и его сложного строения.
-
Рассмотреть факты, доказывающие сложное строение атома.
-
Показать, что заряд ядра является главной характеристикой химического элемента.
-
Развивать познавательный интерес к предметам. Показать значение опытных фактов.
Оборудование. Таблица периодической системы химических элементов Д. И. Менделеева, презентации учителей, компьютер для учителя, проектор, экран.
План урока.В течение урока
30 мин
Беседа по презентации.
II
Изучение нового материала: понятие
Рассказ учителя. Работа с таблицей. Беседа. Записи в тетради. Показ презентации. Работа с учебником.
III
Физминутка: «Зарядка для глаз»
3 мин
Фронтальная работа
IV
Обобщение урока
10 мин
Работа в группах
V
Подведение итогов. Домашнее задание.
3-5 мин.
Беседа. Сообщение учителя.
Ход урока. I этап
Учитель химии. Сегодня мы покажем взаимосвязь двух наук, а вы в ходе урока попытайтесь найти эту взаимосвязь и ответить, что является главной характеристикой атома?
Проблемная ситуация. Составляя свою периодическую систему, Д.И. Менделеев расположил все элементы по возрастанию массового числа, но есть противоречия, которые он объяснить не мог. Например: Ar и K, Te и I. Почему? Нужна была новая теория, которая бы объяснила эти противоречия. На помощь пришла физика. Ученые физики предложили теорию строения атома.
Итак, тема урока: "Строение атома, Физика атомного ядра".
Учитель физики. Историческая хронология экспериментов в области физики, свидетельствующие о делимости атома.
-
Гипотеза о том, что вещества состоят из большого числа атомов, зародилась свыше 2,5-тысячелетий назад в лице древнегреческого ученого Демокрита. Позиция Демокрита: «Существует предел деления - атом». Он говорил: «Ничего не существует, кроме атомов и пустоты…». «Атом» в переводе с греческого обозначает «неделимый» и до конца XIX века это считалось верным. Но открытия конца XIX - начала XX вв. показали, что атом устроен сложно.
Вспомним, какие это открытия?
-
1897 г. Дж. Дж. Томсон открыл электрон при исследовании «катодных лучей». Исследуя отклонения катодных лучей в магнитном и электрическом полях, Томсон показал, что катодные лучи представляют собой поток отрицательно заряженных частиц - электронов. Он измерил удельный заряд этих частиц и нашел, что их масса приблизительно в 1837 раз меньше массы атома водорода. Это было прямым и надежным открытием электрона.
1906 - 1914 г.г. Роберт Милликен и Абрам Иоффе провели эксперименты по точному определению массы и заряда электрона (приводим современные данные). me=9,1∙10-31кг; qе=1,610- 19 Кл.
-
1896 г. Анри Беккерель открыл явление радиоактивности.
Радиоактивность - способность атомов к самопроизвольному (спонтанному) излучению.
4. 1899 г. Эрнест Резерфорд обнаружил, что это излучение неоднородно;
Цель опыта: обнаружить состав радиоактивного излучения.
Оборудование. Свинцовый цилиндр. Радиоактивное вещество. Электрическое поле (или магнитное поле). Люминесцентный экран.
Результат опыта: излучение имеет три составляющих: α-лучи, βлучи, γ-лучи.
Вывод: атом имеет сложное строение.
Резерфорд установил, что α-лучи состоят из частиц с зарядом в 2раза большим, чем у водорода, а масса - в 4раза. Из этого следует, что это ядро атома гелия.
5. 1903 г. Модель строения атома Томсона - «Кекс с изюмом».
Атом представлял собой шар. Он состоит из положительного заряда, равномерно распространенного по всему объему атома, и электронов, колеблющихся внутри этого заряда около своего положения равновесия. Положительный заряд шара равен по модулю суммарному отрицательному заряду электрона, поэтому электрический заряд атома в целом равен нулю. Модель «Кекс с изюмом», не нашла экспериментального подтверждения.
6. 1911-13 г.г. Опыт Резерфорда «Планетарная модель атома».
Модель строения атома Томсона нуждалась в экспериментальной проверке. Поэтому в 1911 г. Резерфорд совместно со своими сотрудниками провел ряд опытов по исследованию состава и строения атомов.
Опыт Резерфорда. Наибольшее количество вспышек расположено в центре экрана. Значит, основная часть всех α-частиц прошла сквозь фольгу, почти не изменив начального направления (рассеялось на малые углы). При удалении от центра экрана количество вспышек становится все меньше и меньше. Следовательно, с увеличением угла рассеяния количество рассеянных на эти углы частиц резко уменьшается. Также некоторое число частиц рассеялось на углы, близкие к 90°, а некоторые - на углы порядка 180°.
Выводы из опыта Резерфорда. Именно случаи рассеяния α-частиц на большие углы привели Резерфорда к выводу:
-
Направление полета α-частиц зависит от того, на каком расстоянии от ядра они пролетают. Оно сильно меняется только в том случае, если частица проходит очень близко к ядру.
-
Столь сильное отклонение α-частиц возможно только в том случае, если весь положительный заряд занимающее ничтожную часть объема атома, и почти вся масса атома сосредоточены в центре.
-
Внутри атома находится положительно заряженное ядро,
-
Электроны вращаются вокруг ядра, они нейтрализуют заряд ядра.
Таким образом, в результате опытов по рассеянию α-частиц была доказана несостоятельность модели атома Томсона. Резерфорд предложил ядерную (планетарную) модель атома.
7. 1919 г. Э. Резерфорд открыл протон. α-частицы, испускаемые ядрами радия взаимодействовали с ядрами азота. В результате получились ядра кислорода и протоны.
8. 1932 г. Джеймс Чедвик открыл нейтрон.
Конец 20-х - начало 30-х годов XX века по праву можно считать золотым веком атомной физики.
Строение ядра. Нуклоны ядра.
Электрон имеет массу 9,1·10-31 кг и заряд -1,6·10-19 Кл.
Ядро состоит из нуклонов - протонов и нейтронов.
Сумма чисел протонов и нейтронов равна массовому числу атома.
Масса протона 1,6726∙10-27 кг, масса нейтрона 1,6749∙10-27 кг.
Физкультминутка для глаз.
Учитель химии. Рассмотрим планетарную модель атома.
АТОМ - электронейтральная система взаимодействующих элементарных частиц, состоящая из ядра (образованного протонами и нейтронами) и электронов.
Распределение электронов по электронным уровням. Осталось неясным, где расположены электроны в атоме?
Электрон движется хаотично и с большой скоростью. Электрон может находиться в любой части околоядерного пространства, занимая определенную орбиталь.
Заполнение электронами четвертого энергетического уровня.
ЭНЕРГЕТИЧЕСКИЙ УРОВЕНЬ - составляет орбитали и электроны с одинаковым значением энергии. Электроны внешнего энергетического уровня обладают максимальным запасом энергии наименее прочной связью с ядром.
Максимальное количество электронов на уровне.
1 энергетический уровень - 2 электрона
2 энергетический уровень - 8 электронов
3 энергетический уровень - 18 электронов
4 энергетический уровень - 32 электрона
Проблемные вопросы. На основе поставленных проблемных вопросов, дается определение понятия «ионы», «изотопы» и утверждается, что главной характеристикой является заряд ядра.
Что следует ожидать, если в атомном ядре изменить число электронов?
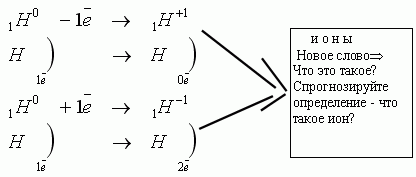 Ионы - заряженные частицы.
Ионы - заряженные частицы.
Что следует ожидать, если в атомном ядре изменить число нейтронов?
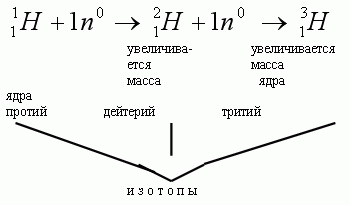
ИЗОТОПЫ - разновидности атомов одного и того же химического
элемента, имеющие одинаковый заряд ядра, но разные массовые числа.
Что следует ожидать, если в атомном ядре изменить число протонов?
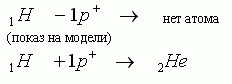 получим
новый вид атома.
получим
новый вид атома.
ХИМИЧЕСКИЙ ЭЛЕМЕНТ - это вид атомов, характеризующихся одинаковым зарядом ядра, то есть содержащих одинаковое число протонов.
ЗАРЯД ЯДРА - главная характеристика атома.
Электронное облако и формы электронных орбиталей.
ЭЛЕКТРОННОЕ ОБЛАКО определяет состояние электрона в атоме.
ОРБИТАЛЬ - это пространство вокруг ядра атома, в котором наиболее вероятно пребывание электрона. Формы электронного облака (орбитали):
-
s - сферическая форма (форма шара)
-
р - форма объемной восьмерки (форма гантели)
-
d - сложная пространственная конфигурация
-
f - сложная пространственная конфигурация
II этап. Обобщение урока.
Для закрепления и углубления знаний работа в группах. (Приложение)
III Подведение итога. Теперь мы можем ответить на вопрос: «Почему в периодической системе химических элементов есть элементы, которые Д.И. Менделеев расположил не в порядке возрастания атомных масс?»
Ожидаемый ответ ученика: Главная характеристика атома является заряд ядра. Изменяя количество электронов и нейтронов, вид атома сохраняется, но меняется соответственно заряд атома и атомная масса. Изменяя число протонов, получается новый химический элемент.
IV. Домашнее задание.
Система понятий . Записать определения. (Составляется учениками дома)Приложение.
</ Задания для групп
1. Запишите "домашний адрес", т.е. положение в периодической системе химического элемента Д.И.Менделеева.
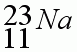
2. Определите заряд ядра, общее количество электронов.
3. Каков состав ядра атома?
4. Изобразите схему распределения электронов по слоям (уровням).
5. Сравните изотопы ![]() .
.![]()
6. Запишите схему образования иона Na +1 .
7. Изобразите схему распределения электронов по слоям (уровням) в ионе.
8. Каков электронный заряд ядра атома, если ![]() Кл?
Кл?
1. Запишите "домашний адрес", т.е. положение в периодической системе химического элемента Д.И.Менделеева.
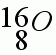
2. Определите заряд ядра, общее количество электронов.
3. Каков состав ядра атома?
4. Изобразите схему распределения электронов по слоям (уровням).
5.Сравните изотопы ![]() .
.
6. Запишите схему образования иона O -2 .
7. Изобразите схему распределения электронов по слоям (уровням) в ионе.
8. Каков электронный заряд ядра атома (если ![]() Кл).
Кл).
1. Запишите "домашний адрес", т.е. положение в периодической системе химического элемента Д.И.Менделеева.
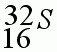
2. Определите заряд ядра, общее количество электронов.
3. Каков состав ядра атома?
4. Изобразите схему распределения электронов по слоям (уровням).
5. Сравните изотопы ![]()
![]() .
.
6. Запишите схему образования иона S -2
7. Изобразите схему распределения электронов по слоям (уровням) в ионе.
8. Каков электронный заряд ядра атома, если ![]() Кл?
Кл?
1. Запишите "домашний адрес", т.е. положение в периодической системе химического элемента Д.И.Менделеева.
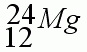
2. Определите заряд ядра, общее количество электронов.
3. Каков состав ядра атома?
4. Изобразите схему распределения электронов по слоям (уровням).
5. Сравните изотопы ![]()
![]() .
.
6. Запишите схему образования иона Mg +2 .
7. Изобразите схему распределения электронов по слоям (уровням) в ионе.
8. Каков электронный заряд ядра атома, если ![]() Кл?
Кл?
1. Запишите "домашний адрес", т.е. положение в периодической системе химического элемента Д.И.Менделеева.
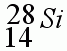
2. Определите заряд ядра, общее количество электронов.
3. Каков состав ядра атома?
4. Изобразите схему распределения электронов по слоям (уровням).
5. Сравните изотопы ![]()
![]() .
.
6. Запишите схему образования иона Si +4 .
7. Изобразите схему распределения электронов по слоям (уровням) в ионе.
8. Каков электронный заряд ядра атома, если ![]() Кл?
Кл?
1. Запишите "домашний адрес", т.е. положение в периодической системе химического элемента Д.И.Менделеева.
1531Р
2. Определите заряд ядра, общее количество электронов.
3. Каков состав ядра атома?
4. Изобразите схему распределения электронов по слоям (уровням).
5. Сравните изотопы 1531Р и 1530Р
6. Запишите схему образования иона Р +5 .
7. Изобразите схему распределения электронов по слоям (уровням) в ионе.
8. Каков электронный заряд ядра атома, если ![]() Кл?
Кл?