- Учителю
- Строение молекул предельных и непредельных углеводородов
Строение молекул предельных и непредельных углеводородов
Практическое занятие ***
***слайд Тема: Строение молекул предельных и непредельных углеводородов
***Девиз: Непрекращающиеся процессы изменения, перестройки молекул химических веществ - признаки движения материи
Хронометраж урока.
1. Сообщение темы и целей занятия, актуализация опорных знаний по ТХС (10 мин.)
2. Компьютерное моделирование гибридных орбиталей и их взаимного расположения при различных видах гибридизации - практические задания 1 - 2 (5 мин).
3. Виды химических связей в органических веществах и их моделирование - практическое задание 3 (5 мин)
4. Пространственное строение УВ. Выполнение практического задания 4 (7 мин)
5. Понятие о конформации. Практическое задание 5 (5 мин)
6. Структурная изомерия. Составление формул изомеров - практическое задание 6
( 5 мин)
7 Выполнение контрольного теста ( 6мин)
8. Подведение итогов урока. Домашнее задание. (3 мин)
Оборудование урока.
Обучающие компьютерные программы: «CS Chem 3D Ultra», «CHEM DRAW STD 6.0 »
Набор шаростержневых моделей атомов.
Таблицы: «Электронное строение метана, этилена, ацетилена»
Ход урока.
В 1861 г нашим соотечественником А.М.Бутлеровым*** были сформулированы основные положения теории химического строения. Ее основная идея заключается в том, что свойства веществ обусловлены не только качественным и количественным составом молекул, но и их строением. Говоря о «химическом строении», Бутлеров понимал последовательность соединения атомов в молекулы химическими связями определенной кратности в соответствии с валентностью этих атомов.
Молекулы каждого вещества имеют вполне определенное строение, которое может быть установлено экспериментально и передано единственной структурной формулой.
Теория строения дала в руки химиков мощный инструмент познания, который обеспечил возможность понимания свойств известных веществ и прогнозирования свойств еще не известных соединений. Ее создание явилось одним из величайших научных открытий и на многие годы определило прогресс химической науки.
Однако для дальнейшего продвижения вперед требовалось более глубокое проникновение в закономерности строения молекул. Это хорошо понимал и А.М.Бутлеров.Он предвидел, что развитие теории пойдет по двум основным направлениям: 1) изучение реального пространственного строения молекул;
2) выяснение природы химической связи.
Время подтвердило правильность этих прогнозов. Оказалось, что носителями химической связи являются электроны, появились и методы изучения и описания пространственной структуры молекул. Поэтому сейчас, говоря о строении молекул, мы имеем в виду три его стороны: ***
химическое, электронное и пространственное строение.
Цель практического занятия:
-
Закрепить и углубить знания об основных положениях ТХС
-
Повторить особенности электронного и пространственного строения основных классов углеводородов;
-
Научиться находить черты сходства и различия в строении УВ
-
Научиться работать с обучающими компьютерными программами для закрепления знаний о строении органических веществ;
-
Выявить черты общности и различия в их строении и объяснить их на основе электронной теории
-
Убедиться в материальности мира
1.Химическое строение молекул.
Когда мы задумываемся над значением органических соединений, поражает не столько широта их распространения, сколько неисчислимое богатство видов органических молекул.
Вопрос: Что же лежит в основе их многообразия?
Ответ: Способность атома углерода образовывать цепи различной длины, кратные связи и циклы.***
Другим источником необычайного многообразия органических соединений является существование изомеров ***-веществ, молекулы которых имеют одинаковый качественный и количественный состав, но разное химическое строение
Изомеры можно сравнить с аллотропными модификациями*** в неорганической химии- состав так же одинаковый, а строение и свойства разные, например, алмаз и графит
Вопрос: Сформулируйте положение ТХС, касающееся изомерии.
Ответ: «Свойства веществ зависят не только от количественного и качественного состав молекул, но и от последовательности соединения атомов, их влияния друг на друга» ;
«Одинаковый состав при разном строении обуславливает явление изомерии»
-Явление изомерии было известно давно, но объяснение оно получило только после работ А.М.Бутлерова. Он же синтезировал и некоторые изомеры ***доказав, что различие в строении определяет различие в свойствах (в частности, в температурах кипения изомеров)
Вопрос: Линейные или разветвленные изомеры будут иметь более высокую температуру кипения? Ответ обосновать.
Ответ: У неразветвленных УВ силы сцепления между молекулами больше, поэтому Ткип. у них будет выше, чем у разветвленных изомеров.
2.Электронное строение и пространственное строение.
Для объяснения реальной геометрии молекул бала создана теория гибридизации ***
(Лайнус Полинг, 1931 г.)
Вопрос: Дать определение гибридизации
Ответ: Выравнивание электронных облаков по форме и энергии.
Практическое задание 1: Используя программу «Chem Draw Std» изобразить форму гибридных электронных орбиталей.
![]()
Форма гибридных облаков определяется тенденцией к максимальному «лобовому» перекрыванию, что обеспечивает больший выигрыш в энергии при образовании σ-связей, т.е. более высокую их прочность.
Вопрос: Какие виды гибридизации вы знаете?
Ответ: sp3, sp2, sp
Практическое задание 2: Используя компьютерное моделирование, показать взаимное расположение гибридных облаков при разных видах гибридизации.
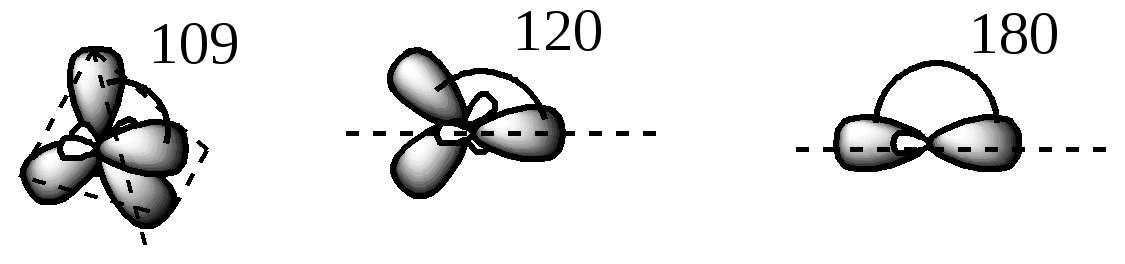
sp3 sp2 sp
Отталкивание электронов служит причиной такого взаимного расположения гибридных облаков в пространстве, при котором они максимально удалены друг от друга. Именно при таком расположении энергия молекул минимальна.
Используя представления о гибридизации атомных орбиталей, необходимо помнить, что это не реальный физический процесс, а удобный в силу своей наглядности метод описания формы молекул.
Вопрос: Какие виды химических связей существуют в молекулах УВ? Дать определение
σ -и π-связи. ?
Ответ: Слабополярные и неполярные сигма и пи-связи.
Вопрос: Какие электронные облака образуют тот или иной вид связи?
Ответ: В алканах: σ-связи между sp3-sp3 -гибридными орбиталями атома углерода (С-С) и sp3-s-электронами атома водорода (С-H):
В алкенах: σ-связи между sp2-sp2 (С-С), sp2-s (C-H), π-связь (С-С) между негибридными p-электронами атома углерода;
В алкинах:sp-sp (C-C), sp-s (C-H), π-связь (С-С)
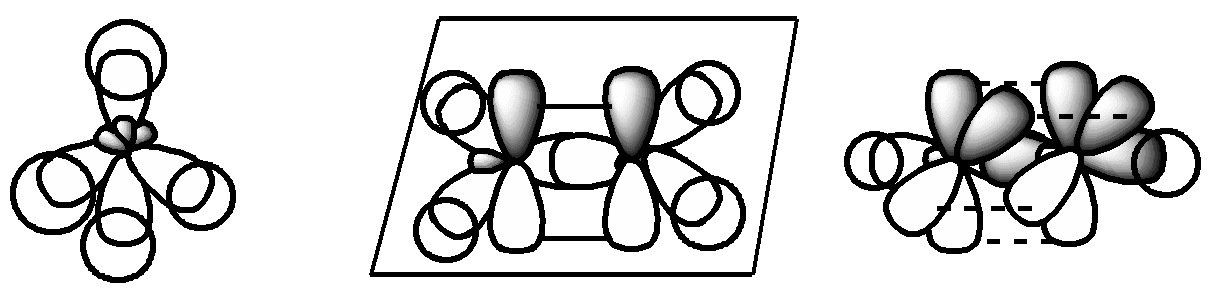
Практическое задание 3: Используя компьютерное моделирование изобразить образование π-связей, а также различных видов σ-связей в молекулах УВ.
![]()

sp3-sp3sp3-s
C-C C-H С-С /π-cвязь/
Проверьте правильность выполненной работы по слайду.***
Гибридизация обуславливает пространственное строение молекул.
Вопрос о пространственном строении молекул во времена А.М.Бутлерова не обсуждался. Наука не располагала еще физическими методами доказательства реального существования атомов и тем более их пространственного расположения. Однако уже с
70-х годов 19 века стала развиваться стереохимия*** (от греч. «стереос» - пространственный).
Появление пространственных представлений в органической химии было связано с тем, что теория строения в ее первоначальном виде не могла объяснить некоторых случаев изомерии. Речь идет об оптических изомерах ***- соединениях, которые отличались лишь способностью вращать плоскость поляризованного света в ту или иную сторону (так называемые L и D формы). Оптические изомеры оказывают различное действие на организм. Например, L-адреналин интенсивно повышает кровяное давление, а его D-изомер лишен такой способности.
Таким образом, изучение оптических изомеров физическими методами /рентгеноструктурный анализ/ обогатило теорию химического строения новым содержанием и привело к появлению стереохимии. Основы ее были заложены работами голландского химика Я. Вант-Гоффа.***
Вопрос: Каково же пространственное строение изучаемых классов соединений?
Ответ: Алканы - молекула метана имеет форму тетраэдра, валентный угол 109028/, гомологи метана имеют цепи зигзагообразной формы, так как валентный угол сохраняется;
Алкены - форма плоского треугольника, угол 1200;
Алкины - молекула линейная, угол 1800.
Практическое задание 4: Смоделировать молекулы метана, этилена и ацетилена (программа Chem Draw Std) и рассмотреть их пространственную конфигурацию (программа Chem 3D Ultra)
метан этилен ацетилен
Таким образом, наряду с понятием структурной изомерии, открытой еще А.М.Бутлеровым, появилось понятие пространственной изомерии, в состав которой входят геометрическая изомерия и оптическая. Особой формой пространственного расположения атомов в молекуле являются конформации.***
Конформеры- неустойчивые динамические формы одной и той же молекулы, которые возникают в результате внутреннего вращения атомов вокруг сигма-связей. В отличие от изомеров они не могут быть выделены в свободном виде даже при абсолютном нуле.***
-Демонстрация заслоненной и заторможенной конформации этана на шаростержневой модели.
Практическое задание 5: Рассмотреть заслоненную и заторможенную конформацию этана при помощи компьютерного моделирования (программа Chem Draw STD 6.0)
Практическое задание 6: Составить формулы изомеров бутана и цис-транс- изомеров бутена-2.
Вопрос: Какие виды структурной изомерии вы будете рассматривать?
Ответ: Углеродной цепи (бутан) и геометрической (бутен-2).
Говоря о строении молекул нельзя не сказать о гомологах.
Вопрос: Что такое гомологи? Может ли гомолог быть одновременно изомером?***
Ответ: Гомологи - вещества, имеющие сходное строение, но отличающиеся на группу СН2- гомологическую разность.
Выводы по уроку: ***
-
Строение молекул с современной точки зрения можно рассматривать как единство химического, электронного и пространственного строения.
-
Различное строение при одинаковом составе обуславливает явление изомерии.
-
Различают структурную и пространственную изомерии.
-
Превращение одного вещества в другое в результате перестановки атомов свидетельствует о том, что материя не исчезает, а изменяются только материальные объекты, построенные из нее, т.е материя находится в постоянном движении.
-
Строение молекул веществ определяет их химические свойства.
Домашнее задание***. Составить формулы всех изомеров состава С5Н8 и назвать их. Определить, к какому виду изомерии они относятся.
Человек уже многое понял в мире молекул, но еще больше осталось непознанного и тем более интересного.
А.М.Бутлеров писал:*** «Факты, не объясняемые существующими теориями, наиболее дороги для науки, от их разработки следует ожидать ее развития в ближайшем будущем».
***…Все, что известно и изучено до сих пор - бесценно, но как же это мало по сравнению с тем, что еще предстоит узнать…
</ 
5