- Учителю
- Опорный конспект для подготовки к ЕГЭ Арены
Опорный конспект для подготовки к ЕГЭ Арены
Арены (ароматические у/в)
СnH2n-6 c>6 C6H5-фенил
1. Строение: sp2 гибридизация, единая П-система
<
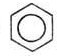 120 C, l |C-C| = 0,14
нм, короче одинарных |C-C| = 0,154 нм, но длиннее двойных |C-C|
=0,132нм
120 C, l |C-C| = 0,14
нм, короче одинарных |C-C| = 0,154 нм, но длиннее двойных |C-C|
=0,132нм
Или не обеспечивает р-р KMnO4, Br2, воду
2 . Изомерия -положение
нескольких заместителей
. Изомерия -положение
нескольких заместителей



 С-СН3
С-СН3 С-СН3
С-СН3
С-СН3 С-СН3
С-СН3 С-СН2-СН3 С-СН3
С-СН3
С-СН3
Метилбензол этилбензол 1,2-диметилбензол 1,3- диметилбензол 1,4-диме-
Толуол орто-ксилол мета-ксилол тилбензол
пара-ксилол
Атомы в ароматическом кольце номеруют,начиная от старшего заместителя к младшему (1-метил-2-этилбензол, номерация по короткому пути.
3. Физические свойства - Ж, с 3 плохо р в Н2О,но хорошо в органических р-лях
4. Способы получения:
-в промышленности из нефти и каменноугольной смолы


 -
синтетический - 2 группы : получение ароматического кольца и
введение в кольцо у/заместителя Pt,300
-
синтетический - 2 группы : получение ароматического кольца и
введение в кольцо у/заместителя Pt,300
 1. дегидрирование
циклогексана +3H2
1. дегидрирование
циклогексана +3H2
2. ароматизация (дегидроцклоризация) алканов

СН3-СН2-СН2-СН2-СН2-СН3 t,Pt +4Н2
 Бензол
С-СН3
Бензол
С-СН3
СН3-СН2-СН2-СН2-СН2-СН2-СН3 t, Pt +4Н2
Толуол
3. тримеризация ацетилена

 3С2Н2
t, C
3С2Н2
t, C
4. Синтез Вюрца - введение у/заместителя в ароматическое кольцо
![]()
![]() -Br
-CH2-CH3
-Br
-CH2-CH3
+ Br-CH2-CH3+2Na +2NaBr
5. Алкилирование

 H3PO4
H3PO4
+СН2= СН2 С-СН2-СН3

 АlCl3
АlCl3
+ СН3Сl -CH3 +HCl


 H3PO4
CH3
H3PO4
CH3
 +СН3-CH=
СН2 C-CH
+СН3-CH=
СН2 C-CH
CH3
5. Химические свойства аренов.
1. Реакции замещения (электрофильный механизм)
 1) галогенирование
Br2(кат. FeBr3), Cl2(кат
FeCl3)
1) галогенирование
Br2(кат. FeBr3), Cl2(кат
FeCl3)

 -CH3
FeBr3 C-CH3 C-CH3
-CH3
FeBr3 C-CH3 C-CH3
+Br2 -Br +

 Орто-бромтолуол Br
Пара-бромтолуол
Орто-бромтолуол Br
Пара-бромтолуол
 C-Cl
C-Cl
+Сl2 +HCl хлорбензол
2). Нитрование


H2SO4 C-NO2
+ HNO3 + H2O нитробензол


С-NO2 NH2
+ HNO3 анилин
 C-CH3
C-CH3

 С-СН3
C-CH3 Пара-нитротолуол
С-СН3
C-CH3 Пара-нитротолуол
+ HNO3 -NO2 +
С-NO2
Орто-нитротолуол
3) Ацилирование

 C-C-CH3
C-C-CH3
+CH3 -C =O || + HCl
| O
Cl
Место вступления нового заместителя определяется природой уже имеющегося в ароматическом ядре заместителя
-заместители 1 рода - группы атомов, способных отдавать электроны -R (-CH3, -C2H5 и т.д) -OH,-NH2, ориентируют новый заместитель в орто- и пара- положение (2,4,6),повышают скорость реакции, облегчают реакции замещения.
 - заместители 2 рода
- оттягивают электроны от бензольного кольца -CF3
(трифторометилбензол) -С=О (бензойная к-та)
-NO2(нитробензол) -С=О (бензальдегид)
- заместители 2 рода
- оттягивают электроны от бензольного кольца -CF3
(трифторометилбензол) -С=О (бензойная к-та)
-NO2(нитробензол) -С=О (бензальдегид)
 R ОН Н
R ОН Н
-SO3H, -C=O , ориентируют новый заместитель в мета- положение.
C-CH3 H2SO4 
 C-СН3
C-СН3
+ 3HNO3 О2N -NO2 + 3H2O
С-NO2
тринитротолуол
2. Реакции присоединения
1) присоединение к бензольному кольцу, образуется циклогексан или его производные

 А. гидрирование
А. гидрирование



 +3H2
циклогексан
+3H2
циклогексан
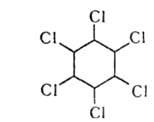
Б. хлорирование

3Cl2 = гексахлоргексан
2) Реакции по алкильному заместителю

 C-CH2-CH3
C-CHCl -CH3
C-CH2-CH3
C-CHCl -CH3
 +Cl2
свет +HCl
+Cl2
свет +HCl

 C-CH3
C-COOH
C-CH3
C-COOH
5 +6KMnO4 + 9H2SO4 5 + 3K2SO4 + 6KMnSO4 + 14H2O
Бензойная кислота
6.Применение
1. анилин (красители)
2. полимеры (стирол -C6H5-CH=CH2)
3.фенол (C6H5OH)
4. взрывчатые вещества (2,4,6-тринитротолуол, тол, тротил)
5. бензойная кислота (C6H5-COOH)
Входит в состав брусники, клюквы
6. терефталевая кислота для получения полиэфирного волокна-лавсана
7.Окисление
5C6H5-CH3+KMnO4+9H2SO4 6MnSO4+3K2SO4+ 5C6H5-C-OH +H2O
||
+5e OH
5 Mn+7 Mn+2
Окислитель -6e
6 С-3 C+3
Восстановитель