- Учителю
- Сборник инструкций по общей химии для проведения лабораторных работ студентов(профессиональное образование. базовый уровень)
Сборник инструкций по общей химии для проведения лабораторных работ студентов(профессиональное образование. базовый уровень)
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ
ДОНЕЦКОЙ НАРОДНОЙ РЕСПУБЛИКИ
Государственное профессиональное образовательное учреждение
«Донецкий техникум промышленной автоматики»
Инструкции для проведения лабораторных работ
По дисциплине БД 09 " химия "
Для студентов I курса образовательно-квалификационного уровня
«младший специалист»
(общий объём -68 ч., из них 16 ч. -лабораторные работы)
 zanyattya
zanyattya
Язык оригинала: белорусский
Составила
преподаватель химии,
специалист
высшей
категории
Поплавская Е.Ф.
2015 г.
Лабораторная работа № 1
Тема: Гидролиз солей.
Цель работы: ознакомление с явлением гидролиза солей и практическими следствиями этого явления, изучение гидролиза солей разных типов, исследование процесса гидролиза солей и установление факторов, влияющих на гидролиз, научиться писать уравнения гидролиза солей.
Оборудование: реактивы: NH4Cl, CH3COONa, NaCl, Na2CO3, ZnSO4, КОН, FeCl3, Na2CO3, универсальный индикатор, штатив с пробирками, предметные стёкла, пипетка, стеклянная палочка.
Ход работы:
Опыт 1. Испытание растворов солей индикатором. Гидролиз солей.
Взять пять пробирок. В пробирки влить последовательно по 1 мл. раствора каждой соли: NH4Cl(1), CH3COONa(2), NaCl(3), Na2CO3(4). и воды(5). Чем образована каждая соль?
Затем в каждую пробирку добавить 1 - 2 капли раствора универсального индикатора. Отметить окраску растворов в пробирках. Определить значение рН раствора, пользуясь данными таблицы 1.
Окраска универсального индикатора в зависимости от значения рН раствора:
Таблица 1.
-
рН
Окраска индикатора
2
3
4
5
6
7
8
9
розовая
красно-оранжевая
оранжевая
желто-оранжевая
желтая
желто-зеленая
зеленая
сине-зеленая
Записать наблюдения. Сделать выводы. Составить уравнения реакций гидролиза в молекулярной и ионной форме
Опыт 2. Влияние концентрации раствора на степень гидролиза соли.
Налить в пробирку 1-2 мл раствора сульфата цинка (ZnSO4), добавить по каплям раствор гидроксида калия (КОН) до появления осадка, а затем до его растворения. К полученному раствору добавить воду до появления осадка. Записать наблюдения.
Сделать выводы. Составить уравнения реакций гидролиза в молекулярной и ионной формах.
Опыт 3. Влияние температуры на степень гидролиза соли.
Налить в пробирку 1-2 мл раствора ацетата натрия CH3COONa и прибавить 1-2 капли фенолфталеина. Нагреть раствор в пробирке и наблюдать изменение окраски индикатора. Записать наблюдения. Сделать вывод о влиянии температуры на степень гидролиза солей и дать объяснение.
Опыт 4. Смещение равновесия гидролиза.
Налить в пробирку 2-3 капли раствора хлорида железа (III) FeCl3, а затем прибавить по каплям раствор карбоната натрия Na2CO3 до появления осадка и выделения газа. Записать наблюдения. Сделать вывод. Составить уравнения реакций.
Контрольные вопросы и задания.
-
Что такое гидролиз солей? Дайте определение.
-
Какие соли подвергаются гидролизу? Приведите примеры.
-
Какие факторы влияют на гидролиз солей и почему?
Составьте молекулярные и ионные уравнения гидролиза следующих солей NiCl2, NaNO2.
Домашнее задание: повторить тему «Гидролиз солей». Написать уравнения реакций гидролиза солей: сульфата натрия, сульфата меди, сульфата калия.
Лабораторная работа № 2
Тема: Химические свойства серной кислоты.
Цель: Закрепить знания о свойствах серной
кислоты, понятие «реактив на ион». Научиться использовать знания
при проведении лабораторной работы.
Оборудование: растворы: серной кислоты, сульфата натрия, хлорида
бария; цинк; лакмусовая бумажка; пробирки. инструкции к
лабораторной работе.
Ход работы:
Опыт №1: Взаимодействие серной кислоты с металлами.
Налейте в пробирку 1 мл разбавленной серной
кислоты, опустите кусочек цинка. Что наблюдаете? Напишите уравнение
реакции, сделайте вывод.
Опыт №2: Определение сульфат - ионов в растворе.
Налейте в пробирку немного раствора сульфата натрия и добавьте несколько капель раствора хлорида бария. Белый осадок свидетельствует о том, что в пробирке находятся ионы SO4. Напишите уравнения реакций в молекулярной, полной и сокращенной ионных формах.
Контрольные вопросы:
Как осуществить такие преобразования:
S →SO2 →H2SO4 →Fe2(SO4)3
↓ ⌡ ↓
PbS Na2SO4→ NaHSO4
Домашнее задание:
1.Задача, Какая масса сожженной серы, если в результате получено -диоксид серы объемом 89,6 м (н.у.), что составляет 80% от теоретически возможного выхода.
2.Составьте уравнения ОВР:
Na + H2SO4
Лабораторная работа № 3 Тема: Химические свойства металлов.
Цель: закрепить знания о свойствах металлов и их солей. Научиться использовать знания при проведении лабораторной работы.
Оборудование: Растворы: медного купороса, хлорид цинка; кристаллы солей: хлорид натрия, хлорид калия, хлорид бария, нитрат стронция; металлический натрий; железные гвозди; горелка; шпатель; пробирки; инструкции к лабораторной работе.
Ход работы:
Опыт № 1. Окраска пламя солями: натрия, калия, бария, стронция.
В пламя горелки внести на металлической ложке кристаллы солей NaCl, KCl, ВаСІ2, Sr(NО3)2 CuSO4 . Обратите внимание на цвет пламени. Какое практическое значение имеет это явление?
Опыт № 2. Взаимодействие солей с металлами.
Налить в пробирку 1-2 мл раствора медного купороса и опустить в нее железную скрепку. Через 1-2 мин. обратите внимание на изменение цвета железного гвоздя. Написать уравнение реакции, протекающей между медным купоросом и железным. Тоже проделать с раствором хлористого цинка. Объяснить это явление, пользуясь электрохимическим рядом напряжений металлов.
Опыт № 3. Взаимодействие натрия с водой.
В пробирку с водой опускаем кусочек
металлического натрия. Какой выделяется газ? К полученному раствору
добавляем 1-2 капли фенолфталеина. Записать уравнение реакции и
объяснить применение индикатора.
Контрольные вопросы:
1. Написать уравнения реакций следующих превращений: Са(НСО3)2> СаСО3 >СаО>Са(ОН)2>Са(NO)2
2. Задача. Сколько граммов СаСО3
образуется при пропускании через известковое молоко Са
(ОН)2 10 м3 воздуха, содержащего 0,03%
С02
Домашнее задание:
1. Задача. Какой объем аммиака требуется для полной нейтрализации 19,6 г серной кислоты.
2. Составьте схему электронного баланса указать процессы окисления и восстановления:
H2S + K2Cr2O7 + H2SO4 -> S + Cr2(SO4)3 + K2SO4 + H2O
Лабораторная работа № 4
Тема: Выявление ионов железа (II), (III) и алюминия.
Цель: Закрепить знания о свойствах соединений металлов, определить с помощью качественных реакций образцы солей. Научиться использовать знания при проведении лабораторной работы.
Оборудование: раствор солей железа ІІ (FеS04), хлорид железа ІІІ (Fе Сl3), хлорид алюминия (АlСl3), щелочи, желтая кровяная соль K4[Fe(CN)6], красная кровяная соль K3[Fe(CN)6], инструкции к лабораторной работе.
Ход работы:
Опыт №1 Изучение свойств соединений железа и алюминия.
В три пробирки налить по 1 мл растворов солей FеS04, FеСl3 и АlСl3. В каждую из них долить 0,5 мл щелочи. Что вы наблюдаете? Запишите свои наблюдения, составьте уравнение реакции для каждой пробирки в молекулярной, ионной полной и сокращенной форме. Напишите вывод.
К каждому из вновь образованных осадков долейте остаток щелочи. Обратите внимание на поведение осадков. Запишите свои наблюдения, составьте уравнение реакции в молекулярной, ионной полной и сокращенной форме. Запишите вывод.
Опыт №2 Качественные реакции на двух и трехвалентное железо.
Для выявления солей двух и трехвалентного железа воспользуйтесь реактивами на эти вещества - желтой и красной кровяной солью. Для этого в две пробирки с растворами соли FеS04 и FеСl3 долейте по 1 мл качественных реактивов. Запишите свои наблюдения, составьте уравнение реакции в молекулярной, ионной полной и сокращенной форме. Запишите вывод. Напишите общий вывод к лабораторной работе.
Контрольные вопросы:
3. Выполните преобразования: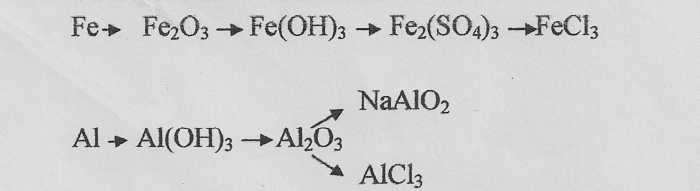
V. Домашнее задание:
1. Задача. 6г. смеси Аl и Сu обработали соляной
кислотой и собрали 3,7 л водорода. Определите процентный состав
смеси.
2. Составьте молекулярные и ионные уравнения реакций: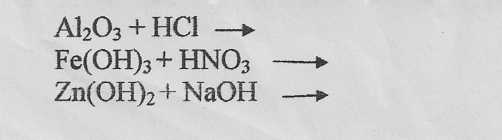
Лабораторная работа № 5
Тема: «Химические свойства углеводородов».
Цель: Получить в лабораторных условиях и изучить химические свойства углеводородов на примере этилена, ацетилена, способствовать приобретению умений и навыков при проведении химических экспериментов.
Оборудование: пробирка с газоотводной трубкой, горелка, растворы серной кислоты, бромная вода, этиловый спирт, карбид кальция.
Внимание! Работая в химической лаборатории, выполняй все правила техники безопасности. Будь внимательный, наблюдательный, аккуратный. Аккуратно работай с кислотами и щелочами.
Ход работы:
Опыт №1. Получение этилена и его изучение.
а) в пробирку налить по 1мл этилового спирта и серной кислоты. Закройте пробирку пробкой с газоотводной трубкой и нагрейте до кипения. Какой газ выделяется?
б) подожгите газ, который выделяется в конце газоотводной трубки. Каким пламенем горит этилен?
в) полученный этилен пропустите в растворы бромной воды и перманганата калия. Что произошло? Объясните, почему происходит обесцвечивание растворов? Запишите наблюдения и уравнения реакции.
Опыт №2. Получение ацетилена и его изучение.
а) в пробирку насыпать немного карбида кальция и долить воды. Закрыть пробирку пробкой с газоотводной трубкой.
б) подпалите газ, который выделяется в конце газоотводной трубы. Каким пламенем горит ацетилен?
в) полученный ацетилен пропустите в раствор бромной воды и пергамента калия. Объясните, почему происходит обесцвечивание растворов? Запишите наблюдения и уравнение реакций.
Сделать вывод в конце работы.
Контрольные вопросы:
1.Напишите уравнения реакций, с помощью которых можно совершить
схему преобразований:
С2Н6 -> С2Н5Вг -> С4Н10 -> С02
2. Напишите структурные формулы веществ:
а) 2-метил-2-бутен;
б) 2,3-диметил-1-бутен;
в) 3-этил-2,3-диметил-1-гептен;
г) 3,3,4,4-тетраметил-1-гексен;
д) 3-бром-2-метил-2-бутен;
Домашнее задание:
Задача: Определите объем этилена, который можно получить при дегидратации 92 г этилового спирта, если выход продукта составляет 50 %.
</ Лабораторная работа № 6
Тема: Химические свойства оксигеносодержащих соединений.
Цель: Научиться использовать знания о свойствах
органических оксигеносодержащих веществ при выполнении лабораторной
работы.
Оборудование: штатив с пробирками, медный провод, горелка,
держатель, спирт этанол, глицерин, оксид серебра, формалин.
инструкции к лабораторной работе.
Ход работы:
Опыт №1. Изучение качеств глицерина.
В пробирку с 1 мл воды капните немного глицерина. Обратите внимание на его физическое состояние. Как он ведет себя в воде? Опишите его физические качества. Напишите молекулярную и структурную формулу глицерина.
В пробирку налейте 1 мл едкого натра NaOH и долейте 1-2 капли медного купороса. Составьте уравнение реакции.
Долейте до осадка раствор глицерина с первой пробирки, хорошо встряхните. Запишите свои наблюдения, напишите уравнение реакции, сделайте вывод.
Опыт №2 Окисление спирта в альдегид.
Налейте в пробирку 1 мл спирта этанола.
Прожарьте медный провод над пламенем спиртовки и обратите внимание
на цвет проволоки. Осторожно опустите его в пробирку со спиртом.
Понюхайте жидкость в пробирке, обратите внимание на цвет
проволоки.
Опишите свои наблюдения, составьте уравнение реакции. Сделает
вывод.
Опыт №3. Окисление альдегида (реакция «серебряного зеркала»)
В пробирку с раствором оксида серебра добавили
несколько капель формалина. Медленно и равномерно нагрейте пробирку
до кипения
Контрольные вопросы:
1. Напишите уравнения последующего преобразования, назовите все вещества
1 2 3 4
C -> CH4 -> CH3Cl -> CH3OH -> CH2O
V. Домашнее задание:
1. Задача. Определите, какой объем водорода можно получить при
взаимодействии 5 моль спирта этанола с необходимым количеством
металлического натрия.
2. Какие соединения можно получить дегидратацией изобутилового
спирта?
Лабораторная работа № 7
Тема: Изучение свойств карбоновых кислот и эфиров.
Цель: Закрепить знания о строении и свойствах карбоновых кислот, способы получения сложных эфиров. Научиться использовать знания при выполнении лабораторной работы.
Оборудование: растворы: ацетата натрия, серной кислоты; сухие соли: гидрокарбоната натрия, карбоната кальция; цинк; уксусная кислота (концентрированная), изоамиловый спирт, серная кислота (концентрированная), NaCl, штатив с пробирками, сухой спирт, спички, вода; инструкции к лабораторной работе.
Ход работы:
ОПЫТ № 1. Получение уксусной кислоты, изучение ее свойств.
Налить в пробирку 1-2 мл раствора ацетата натрия СН3СООNa, понюхать. К этому раствору долить 1 мл раствора серной кислоты и снова понюхать. Записать наблюдения; уравнение реакции. Сделать вывод о силе полученной уксусной кислоты и ее физических свойств.
ОПЫТ № 2. Изучение химических свойств уксусной кислоты.
а) Полученную в первом опыте уксусную кислоту разлить на три части. В одну пробирку добавить щепотку гидрокарбоната натрия NаНС03, в другую щепотку карбоната кальция СаС03. Записать наблюдения, уравнения реакции, сделать вывод
б) в третью пробирку с уксусной кислотой опустить кусочек цинка закрыть пробирку (на 10-15 '), полученный водород поджечь. Записать наблюдения, уравнения реакции, сделать вывод.
ОПЫТ № 3. Получение эфира.
Налить в пробирку 1 мл концентрированной уксусной кислоты и столько же изомилового спирта. Осторожно добавить 1 мл концентрированной серной кислоты и слегка нагреть до появления запаха. Эту смесь вылить в стакан с насыщенным раствором поваренной соли. На поверхности раствора появляются капли эфира. Понюхать с соблюдением правил техники безопасности.
Записать наблюдения, уравнения реакции, указать роль серной кислоты в этой реакции.
Контрольные вопросы:
1.Написать молекулярные и ионные уравнения реакций
между:
а) стеаратом натрия и серной кислотой
б) муравьиной кислотой и гидроксидом натрия.
2.Етиловий эфир муравьиной кислоты используют как ароматизаторы при
производстве мыла. Составьте уравнение реакции образования этого
эфира.
V. Домашнее задание:
1. Какая масса раствора калий гидроксида с массовой частью щелочи 30% потратится для нейтрализования 50 г раствора уксусной кислоты с массовой частью кислоты 10%?
2. Как осуществить преобразования:
Метан -> Бромметан -> метанол -> формальдегид?
Лабораторная работа № 8
Тема: Изучение свойств углеводов и белков.
Цель: Закрепить знания о качественных реакциях, продолжить формировать навыки проведения качественных реакций. Научиться использовать знания при выполнении лабораторной работы.
Оборудование: штатив с пробирками, горелка, спички, пробирки, держатель, раствор глюкозы, гидроксида натрия, сульфата меди (II), водный раствор яичного белка, концентрированная азотная кислота, концентрированный раствор аммиака.
Ход работы:
Опыт № 1. Взаимодействие глюкозы с гидроксидом меди (II).
В пробирку налейте 1 мл раствора гидроксида натрия и добавьте несколько капель раствора сульфата меди (II). Составьте уравнение реакции, опишите цвет осадка. К осадку добавьте раствор глюкозы и взболтайте смесь. Почему исчез осадок? Составьте уравнение реакции. О наличии какой функциональной группы свидетельствует этот опыт? Продолжаем опыт - нагреваем синий раствор, не доводя до кипения. Наблюдаем образование желтого, а затем красного осадка. Составьте уравнение реакции. О наличии какой функциональной группы свидетельствует этот опыт?
Опыт № 2. Цветные реакции белков.
1. В 2мл раствора белка в пробирку добавьте
несколько капель
концентрированной азотной кислоты. Что наблюдаете, что происходит
со структурой белка? Нагрейте содержимое пробирки. Как изменился
цвет осадка? Охладите пробирку и добавьте осторожно, по каплям,
концентрированный раствор аммиака (в избытке). Что наблюдаете? Как
называется эта реакция?
2. В 2мл раствора белка долейте равный объем
раствора щелочи
и затем несколько капель слабого раствора медного купороса. Что
наблюдаете? Как называется эта цветная реакция белка?
Контрольные вопросы:
1) Чем обусловлено появления вкусной корочки на
хлеба?
2) Какая связь называется амидной? Какие вещества имеют амидные
связи?
3) Задача: Рассчитайте массовую долю сахара в стакане чая (250
мл.), в который положили две чайные ложки сахара (по 8 г в каждой)?
Домашнее задание: повторить тему, оформить отчет.