- Учителю
- Конспект урока по химии на тему Фосфор ( 9 класс)
Конспект урока по химии на тему Фосфор ( 9 класс)
Учебно - методическая разработка к уроку химии для 9-го класса по теме «Фосфор и его свойства» (УМК Г.У. Рудзитис, Ф.Г. Фельдман. Химия-9 класс)

Тема урока: «Фосфор и его свойства»
Цели урока:
Обучающие - рассмотреть положение элемента фосфора в ПСХЭ Д.И.Менделеева, строение атома; аллотропные видоизменения фосфора; физические и химические свойства; применение фосфора и его соединений человеком.
Развивающие - развивать критическое мышление через работу с учебным материалом, развивать информационную компетентность учащихся, развивать умение работать в группе;
развивать интеллектуальные и познавательные умения учащихся добывать самостоятельно знания, обобщать и делать выводы, фиксировать главное в свернутом виде. Продолжить формирование навыков самостоятельной работы с учебником, дополнительной литературой, сайтами Интернета.
Воспитательные - содействовать воспитанию организованности учащихся при решении проблемных вопросов, поддерживать дух толерантности, воспитывать умение уважать другое мнение, поддерживать других и быть к ним благожелательным.
Учащиеся должны знать: строение атома фосфора,
физические и химические свойства аллотропных видоизменений фосфора,
области применения.
Оборудование: периодическая система химических элементов
Д.И.Менделеева, карточки с названиями станций, презентация,
компьютер, медиапроектор, экран.
-
Лабораторное оборудование: фосфор( красный), куриные кости ( предварительно заготовленные и выдержанные в соляной кислоте), сосуд, заполненный кислородом, нитрат серебра, пробирки, спиртовка.
Тип учебного занятия: урок изучения нового материала и первичного закрепления полученных знаний
Форма урока: урок- презентация
Структура урока:
Стадия I. Вызов.
Изучение нового материала.
Мотивация. Учитель зачитывает отрывок из произведения К.Дойля «
Собака Баскервилей» и показывает фрагмент из видеоролика. (Слайд 1)
-
«...Да! Это была собака, огромная, черная, как смоль. Но такой собаки еще никто из нас, смертных, не видывал. Из ее отверстой пасти вырывалось пламя, глаза метали искры, по морде и загривку переливался мерцающий огонь. Ни в чьем воспаленном мозгу не могло возникнуть видение более страшное, более омерзительное, чем это адское существо, выскочившее на нас из тумана... Страшный пес, величиной с молодую львицу. Его огромная пасть все еще светилась голубоватым пламенем, глубоко сидящие дикие глаза были обведены огненными кругами.
Я дотронулся до этой светящейся головы и, отняв руку, увидел, что мои пальцы тоже засветились в темноте. Фосфор,- сказал я».
Узнали? Артур Конан-Дойл. «Собака Баскервилей».
Вот в какой скверной истории оказался замешан элемент № 15.
Автор произведения допустил серьезные ошибки и чтобы их найти
давайте сначала изучим этот элемент.
Учитель. Тема нашего урока «Фосфор и его свойства». (Слайд 2)
Цель нашего урока: получить знания о химическом элементе, простом веществе фосфоре, его соединениях и изучить физические и химические свойства. (Слайд 3).
Девиз нашего урока «Фосфор-элемент жизни и мысли»
(академик А.Е.Ферсман) (Слайд 4)
-
Давайте посмотрим на фосфор глазами историка, геолога, физика, химика, биолога, медика; приятно удивиться: оказывается, вы знаете уже так много.
-
Для погружения в урок используем приём «Верите ли вы»? (Слайд 5)
Вопросы:
1) что химический знак фосфора Р (да)
2) что фосфор самый распространённый неметалл в земной коре (нет)
3) что фосфор имеет 5 валентных электронов (да)
4) что название «фосфор» переводится как «светоносный» (да)
5) что фосфор - необходимый элемент в питании растений (да).
Стадия II. Осмысление
-
В процессе работы на уроке вам нужно заполнить табличку «Знаю- хочу узнать - узнал» (работа над таблицей 5 минут).
-
Станция «Историческая» (Слайд 5)
Ученик 1. Открытие фосфора приписывается гамбургскому алхимику Х.Брандту. В поисках «филосовского камня», якобы способного превратить неблагородные металлы в золото, Брандт занимался перегонкой сухого остатка от выпаривания мочи. В приёмнике оказалось вещество, испускавшее голубоватый свет. Так, совершенно случайно, в 1669 году был открыт белый фосфор (Слайд 5) - вещество, вызывавшее свечение. Поначалу у Брандта не было сомнения, что свечение без огня мог дать лишь искомый «филосовский камень». Однако вскоре он понял, что никакими другими чудесными свойствами его находка не обладает, и продал секрет другому алхимику. Тот, в свою очередь, перепродал его третьему и т. д. Конец «филосовскому бизнесу» положил английский химик Р.Бойль (Слайд 6), который в 1680 году опубликовал в научном журнале более простую и доступную методику получения фосфора. В 1771 году шведский химик К.Шееле (Слайд 6) дал способ получения фосфора из костяной золы, применявшейся в промышленности вплоть до начала 20 века. Наименование элемента происходит от греческих слов «фос» - свет и «форос»,- несущий. Название «фосфоры» приписывают всем веществам, светящимся в темноте после предварительного облучения, а само явление холодного свечения называют фосфоресценция.
Станция «Общая и неорганическая химия» (Слайд 8).
Учитель. Охарактеризуйте фосфор как химический элемент по плану:
1. Порядковый номер, номер периода, группа, подгруппа;
2. Заряд ядра, электронная формула электронно-графическая формула;
3. Валентность, степень окисления.
4.Формулы соединений фосфора.
(Когда учащиеся ответят, с помощью медиапроектора на экран
выводится правильный ответ) (Слайд 8-9).
Элемент VA группы имеет электронную формулу
1s22s22p63s23p3.
-
Фосфор - неметалл.
-
Наиболее характерные степени окисления: +5, +3, 0, -3.
-
Оксиды Р2О5 и Р2О3 имеют кислотные свойства.
-
Летучее водородное соединение - фосфин PH3
-
Учитель. Итак, мы передвигаемся к следующей станции геологической.
Станция «Геологическая» (Слайд 10). -
Учитель. В каком виде химический элемент может находиться в природе? Запишите в тетрадь не менее 4 формул соединений фосфора.
-
Выступление учащегося- представителя геологической станции.
Ученик 2. Фосфор принадлежит к весьма распространённым в природе элементам. Он занимает 13 место среди всех элементов. Вследствие высокой химической активности фосфор в свободном состоянии в природе не встречается. Он содержится не менее чем в 190 минералах, из которых главнейшими являются апатиты и фосфориты. В 1926 году А.Е.Ферсманом и его сотрудниками были открыты огромные запасы апатитов на Кольском полуострове в Хибинах, где их залежы не имеют равных нигде в мире. Незадолго до войны было открыто очень крупное месторождение фосфоритов Кара-Тау в Казахстане. -
Учитель. Следующая станция «Биологическая». Поднявшись на неё, вы узнаете о роли фосфора в жизни живых организмов.
Станция «Биологическая» (Слайд 11-16) -
Вопрос : какие свойства придает фосфор костной ткани?
Ответ учащихся: твердость и прочность.
Лабораторный опыт: демонстрация куриных костей (куриная кость стала мягкой).
Обнаружение фосфатов в растворе (взаимодействие с нитратом серебра).
Вопрос: как вы думаете, почему кость стала мягкой и гибкой?
Ответ: неорганические вещества, в том числе и фосфор, перешли в раствор, а органические -придают гибкость.
Давайте проведем опыт по обнаружению фосфатов в растворе.
Обнаружить фосфаты в растворе можно с помощью качественной реакции- взаимодействие с раствором нитрата серебра, при этом образуется светло-желтый осадок.( Запишите реакцию)
Вывод: в состав костной ткани входит химический элемент фосфор в виде
иона PO4 3-
-
Ученик 3.( слайд 11-15)
Фосфор и здоровье человека(таблица «Содержание фосфора»)
Содержание фосфора в организме человека (масса тела 70 кг) составляет 780 г. Суточная доза для взрослых 1 г.
Биологическая роль
• Входит в состав скелета в виде ортофосфата Са3(Р04)2 и гидроксиапатита ЗСа3(Р04)2 • Са(ОН)2
• Входит в состав зубов в виде гидроксиапатита и фторапатита 3Са3(Р04)2 • CaF2.
• Соединения фосфора принимают участие в обмене энергии.
• Необходим для нормальной мышечной и умственной деятельности. Академик А.Е.Ферсман назвал его «Элементом мысли».
Фосфор поступает в организм с пищей: рыбой, хлебом, молоком, сырами, мясом, бобовыми (горох, фасоль), овсяной, перловой, ячневой крупой. Обычно всасывается 50-90% фосфора, меньше - при употреблении растительных продуктов, т. к. в них он содержится в виде трудноусвояемой фитиновой кислоты. Для правильного питания очень важно его соотношение с кальцием. Оптимальным считается соотношение кальция и фосфора, равное 1:1,5.
Реакция организма на недостаток фосфора ( слайд16)
Развивается рахит, снижается умственная и мышечная деятельность.
Реакция организма на избыток фосфора.
Развивается мочекаменная болезнь. Р4 и многие соединения фосфора высокотоксичны. Летальная доза Р4 равна 60 мг. Большую опасность представляют ожоги, возникающие при горении фосфора, из-за выделения большого количества тепла при взаимодействии образующегося при горении P2Os с влагой кожи. Получившаяся фосфорная кислота Н3Р04 проникает в глубь соединительной ткани, что приводит к отеку из-за прилива внеклеточной жидкости.
Динамическая пауза или физкультминутка.
Учитель. И мы передвигаемся на следующую станцию нашей лестницы
познания.
Станция «Литературная».
Ученик 4. «СВЕТЯЩИЙСЯ МОНАХ»
Из воспоминаний академика С. И. Вольфковича: «Фосфор получался в
электрической печи, установленной в Московском университете на
Моховой улице. Так как эти опыты проводились тогда в нашей стране
впервые, я не предпринял тех предосторожностей, которые необходимы
при работе с газообразным фосфором - ядовитым, самовоспламеняющимся
и светящимся голубоватым цветом элементом. В течение многих часов
работы у электропечи часть выделяющегося газообразного фосфора
настолько пропитала мою одежду и даже ботинки, что, когда ночью я
шел из университета по тёмным, не освещённым тогда улицам Москвы,
моя одежда излучала голубоватое сияние, а из-под ботинок (при
трении их о тротуар) высекались искры.
За мной каждый раз собиралась толпа, среди которой, несмотря на мои
объяснения, немало было лиц, видевших во мне «новоявленного»
представителя потустороннего мира. Вскоре среди жителей района
Моховой и по всей Москве из уст в уста стали передаваться
фантастические рассказы о «светящемся монахе»...
Учитель. А нас ждёт следующая станция.
Станция «Физическая» (Слайд 17-23).
Учитель. Фосфор - один из элементов, самых богатых аллотропными
модификациями: белый, красный, чёрный, розовый, фиолетовый и
другие.
Белый фосфор - кристаллическое вещество белого цвета. Его молекула
состоит из 4 атомов, располагающихся по вершинам правильной
пирамиды. Плотность 1, 83 г/см3 , 44,1º С, 280,5º С.
Обладает высокой реакционной способностью, поэтому его обычно
хранят под водой - он не растворяется в воде и не реагирует с ней.
На воздухе самопроизвольно воспламеняется. Медленное окисление его
паров сопровождается свечением. Чрезвычайно ядовит. Без доступа
воздуха при 280-300º С переходит в красный фосфор.
Красный фосфор представляет собой аморфный порошок. Его плотность
1,3 г/см3 , 5,90º С. Он менее реакционноспособен, чем
белый фосфор, его удобнее хранить, не ядовит.
При высоком давлении (12000 атм.) и 220º С из белого фосфора
получают чёрный. Его плотность самая большая 2,7 г/см3 и
наименее реакционноспособен. По внешнему виду и по внутреннему
строению он похож на графит: кристалл построен из бесконечных слоёв
атомов, его слои «гофрированы». При нормальных условиях чёрный
фосфор ведёт себя как полупроводник, а при повышенном давлении
проводит ток как металл (белый и красный фосфор - изоляторы).
Учитель. Мы продолжаем передвигаться.
Станция «Химическая» (Слайд 24)
Фосфор соединяется со многими простыми веществами - кислородом,
галогенами, серой и некоторыми металлами, проявляя окислительные и
восстановительные свойства.
1. С кислородом.
При горении фосфора образуется белый густой дым. Белый фосфор самовоспламеняется на воздухе, а красный горит при поджигании.
Фосфор сгорает в кислороде ослепительно ярким пламенем.
4P + 5O2(избыток) → 2P2O5 (P4O10)
Р- восстановитель
Лабораторный опыт. ( Слайд 27)
2. С галогенами.
С элементами, обладающими большей, чем у фосфора, электроотрицатель-ностью, фосфор реагирует очень энергично.
Если в сосуд с хлором внести красный фосфор, то через несколько секунд он самовоспламеняется в хлоре. При этом обычно получается хлорид фосфора (III).
4P + 6Cl2(недостат) → 4PCl3 Р- восстановитель
4P + 10Cl2(избыток) → 4PCl5
3. Фосфор окисляет при нагревании почти все металлы, образуя фосфиды:
2P + 3Ca → Ca3P2 Р- окислитель
4. С водородом, при этом образуется фосфин:
2P + 3H2 → 2PH3 Р- окислитель
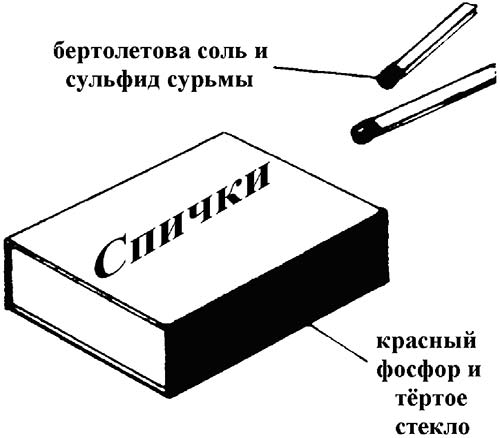
5. Взаимодействие фосфора с бертолетовой солью KClO3.
Данная смесь воспламеняется со взрывом даже при слабом трении или нажими. Эту химическую реакцию мы воспроизводим всякий раз, когда зажигаем спички. KClO3 в смеси с серой, в качестве горючего находится в головке спички, а красный фосфор- на боковой стенке коробка, об которую спичку чиркают.
6P + 5 KClO3 → 3P2O5 + 5KCl
P- восстановитель.
Учитель. А где находит применение фосфор? (выслушать ответы
учащихся)
Поэтому следующая станция «Практическая», где мы узнаем о
применении фосфора.
Станция «Практическая» (Слайд 31)
Ученик 5. Ежегодное производство фосфора велико. Большая часть его
расходуется на получение термической фосфорной кислоты, из которой
производят фосфорные удобрения. Довольно много фосфора
перерабатывается в полифосфаты, применяемые в синтетических моющих
средствах в качестве умягчителей воды. Ещё один важный потребитель
фосфора - спичечное производство. Первые безопасные спички
появились в конце 19 века в Швеции, поэтому их часто называли
шведскими спичками.

Во время первой и второй мировых войн белым фосфором снаряжали
зажигательные бомбы и артиллерийские снаряды; кроме того, он
использовался в специальных бомбах для образования дымовых
завес.
В металлургии фосфор применяется как компонент некоторых сплавов
(оловянные бронзы).
Фосфорорганические производные применяются как инсектициды
(вещества, применяемые для борьбы с насекомыми) - хлорофос, тиофос,
карбофос.
Стадия III. Рефлексия
Учитель. Вот и завершилось наше путешествие по лестнице познания.
Давайте теперь мы ответим, где автор К.Дойль допустил ошибку при
написании своего произведения « Собака Баскервилей»?
Людям свойственно ошибаться. Так, Конан Дойль ошибочно с точки зрения химии применил описание свойств фосфора в этом отрывке. На воздухе белый фосфор действительно светится в темноте и является ядом! Но уже при слабом нагревании, для чего достаточно простого трения, фосфор воспламеняется и сгорает, выделяя большое количество теплоты. Значит, если бы он покрывал шерсть собаки, то она получила бы ожоги от его воспламенения.
Поделитесь своими впечатлениями по уроку.
(работа с таблицей ЗХУ)
- я знал…
-я хотел узнать…
-я узнал…
Творческое задание. Составьте синквейн по нашей теме.
Фосфор
Белый, красный, черный.
Светится, воспламеняется, взаимодействует.
Содержится в костной ткани и других важнейших органических веществах.
Элемент жизни и мысли.
Оценки за работу на уроке.
Домашнее задание: §21, творческое задание: составить рекламный
плакат по теме или создать буклет про фосфор по плану (см.
приложение 3)
Приложение 1.
Таблица « Содержание фосфора в организме человека»Костная ткань
1,4 кг
Мышечная ткань
130 г
Нервная ткань
12 г
Кровь
345 мг/л
Ежедневный прием с пищей
900-1900 мг
Приложение 2.
Аллотропные видоизменения фосфора
Белый. Имеет молекулярную кристаллическую решётку, состоящую из
молекул P4 в форме тетраэдра. Это легкоплавкое t(пл)=44,1ºС,
t(кип)=275ºС, мягкое, бесцветное с желтоватым оттенком
воскообразное с чесночным запахом вещество. Хорошо растворяется в
сероуглероде и ряде других органических растворителей. Ядовит. В
измельченном состоянии воспламеняется при обычной температуре,
светится в темноте. Хранят его под слоем воды.
Красный. Имеет формулу Рn и представляет собой полимер со сложной
структурой: тетраэдры Р4 связаны в бесконечные цепи. Имеет оттенки
от пурпурно-красного до фиолетового. Нерастворим в воде, а также в
бензоле, сероуглероде. Температура плавления 585-600º С. Не ядовит.
Не светится в темноте.
Черный. Имеет несколько модификаций: ромбическая модификация
построена из гексагональных колец Р6, упакованных в слои и
кубическая модификация Р4. Представляет собой чёрное вещество с
металлическим блеском, жирное на ощупь и весьма похожее на графит,
и с полностью отсутствующей растворимостью в воде или органических
растворителях. Чёрный фосфор проводит электрический ток и имеет
свойства полупроводника. Температура плавления чёрного фосфора 1000
°С под давлением 18×105 Па.
Приложение 3.
Как создать буклет:
1) Титульный лист должен не только отражать название темы, но и заинтересовать.
2) Последняя страница должна содержать фамилии авторов.
3) На четырех страницах буклета отразить биологическое значение фосфора и его соединений, проблемы, связанные с данным элементом, применение фосфора и его соединений в промышленности, сельском хозяйстве, медицине, быту.
4) Можно отразить в буклете историю открытия элемента.
5) Буклет может содержать также картинки, рисунки, схемы по вашему усмотрению.
СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ И ИСТОЧНИКОВ
Список использованной литературы:
-
Учебник Г.Е. Рудзитис, Ф.Г. Фельдман « Химия- 9», изд Москва, « Просвещение», 2011.
-
Виртуальная лаборатория. Открытая химия. 8-11 класс. [Электронный носитель]. - М.:
-
Уроки химии Кирилла и Мефодия. 8-9 класс. [Электронный носитель]. - М.: «Кирилл и Мефодий», 2002.
-
www.alhimik.ru
-
him.1september.ru.