- Учителю
- Контрольная работа по теме Подгруппа кислорода 9 класс
Контрольная работа по теме Подгруппа кислорода 9 класс
Контрольная работа №2 по теме «Подгруппа кислорода»
Вариант 1При выполнении заданий 1-4 укажите только одну цифру, которая соответствует номеру правильного ответа.
1. (1б) Во 2-м периоде VIA группе Периодической системы находится химический элемент, схема строения атома которого
1) 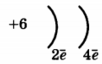 2)
2)
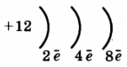 3)
3)
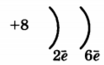 4)
4)
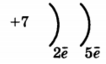
2. (1б) Степень окисления -2 атом серы проявляет в каждом из соединений:
1) CaSO3 и H2S 2) H2SO4 и FeS 3) SO2 и H2S 4) CaS и H2S
3. (1б) Сульфит-ионы образуются при электролитической диссоциации
1) MgSO4 2) K2SO3 3) SrSO3 4) Li2S
4. (1б) Верны ли следующие суждения о правилах безопасной работы в химической лаборатории?
А. В лаборатории нельзя знакомиться с запахом веществ.
Б. Серную кислоту следует растворять в горячей воде.
1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны
5. (3б) Оксид серы(VI) взаимодействует с каждым из двух веществ:
1) вода и хлорид натрия 2) оксид кальция и раствор гидроксида натрия
3) кислород и оксид магния 4) вода и серебро
6. (2б) Сульфат натрия реагирует с
1) КОН 2) Ва(ОН)2 3) NaCl 4) Н2СO3
7. (2б) Вычислите массовую долю серы в сульфате алюминия
При выполнении заданий 8, 9 к каждому элементу первого столбца
подберите соответствующий элемент из второго столбца. Запишите
выбранные цифры под соответствующими буквами. Цифры в ответе могут
повторяться.
8. (2б) Установите соответствие между двумя веществами и реактивом, с помощью которого можно различить эти вещества. К каждому элементу первого столбца подберите соответствующий элемент из второго столбца.
ВЕЩЕСТВА РЕАКТИВ
А) CuSO4(p-p) и СuСl2(р-р) 1) Н2O
Б) Na2SO4(тв.) и BaSO4(тв.) 2) фенолфталеин
3) Ba(NO3)2(p-p)
(1б) Дайте объяснение выбранным ответам, подтвердите, по возможности, уравнениями реакций в ионном виде.
9. (4б) Установите соответствие между названием вещества и классом, к которому оно принадлежит:
НАЗВАНИЕ ВЕЩЕСТВА КЛАСС СОЕДИНЕНИЙ
А) оксид серы (VI) 1) бескислородная кислота
Б) сернистая кислота 2) амфотерный оксид
В) сероводородная кислота 3) кислородсодержащая кислота
Г) сульфат натрия 4) кислотный оксид
5) кислая соль
6) средняя соль
(1б) Запишите химические формулы соединений (столбик НАЗВАНИЕ ВЕЩЕСТВ)
10. (1б) Назовите вещество по его физическим свойствам: бесцветный газ, с запахом тухлых яиц, тяжелее воздуха, ядовит - это……
На задание 11 дайте развернутый ответ
11. (3б) Используя метод электронного баланса, составьте уравнение реакции по схеме:
H2SO4 + Cu2O → CuSO4 + SO2 + H2O
Определите окислитель и восстановитель
Оценивание: «5» - 20-23 балла
«4» - 19-16 баллов
«3» - 15-11 баллов
«2» - 10 и менее
Контрольная работа №2 по теме «Подгруппа кислорода»
Вариант 2При выполнении заданий 1-4 укажите только одну цифру, которая соответствует номеру правильного ответа.
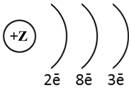
1. (1б) Химическому элементу 3-го периода VIA-группы
соответствует схема распределения электронов
2)
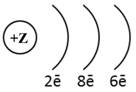
3)
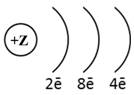
4)
2. (1б) В какой молекуле валентность серы равна IV?
H2SO4
3. (1б) Гидросульфат- ион образуется при электролитической диссоциации
1) Na2SO4 2) H2SO3 3) KHSO4 4) MgS
4. (1б) Верны ли следующие утверждения о правилах работы в школьной лаборатории?
А. На любой посуде, в которой хранятся вещества, должны быть этикетки с названиями или формулами веществ.
Б. Опыты с горючими и едкими веществами необходимо проводить в защитных очках.верно только А
2)
верно только Б
3)
верны оба утверждения
4)
оба утверждения неверны
При выполнении заданий 5,6 выберите правильный ответ и
запишите уравнения реакций.
5. (3б) С раствором серной кислоты реагирует каждое из двух
веществ: Zn и Zn(OH)2 2) Cu и CuCO3 3)
CO2 и NaOH 4) P и NaCl
6. (2б) Сульфат бария можно получить в результате реакции
нитрата бария с 1) oксидом серы(IV) 2) сернистой кислотой 3)
сероводородом 4) сульфатом калия
Решите задачу
7. (2б) Вычислите массовую долю серы в сернистой кислоте.
При выполнении заданий 8, 9 к каждому элементу первого столбца
подберите соответствующий элемент из второго столбца. Запишите
выбранные цифры под соответствующими буквами. Цифры в ответе могут
повторяться.
8. (2б) Установите соответствие между двумя веществами и реактивом, с помощью которого можно различить эти вещества. К каждому элементу первого столбца подберите соответствующий элемент из второго столбца
ВЕЩЕСТВА РЕАКТИВ
А) Na2S (р-р) и Na2SO3 (р-р) 1) H2O
Б) H2SO4 (р-р) и HCl(р-р) 2) Ba(NO3)2 (р-р)
3) HCl
(1б) Дайте объяснение выбранным ответам, подтвердите, по возможности, уравнениями реакций в ионном виде.
9.(4б) Установите соответствие между формулой вещества и классом, к которому оно принадлежит:
ФОРМУЛА ВЕЩЕСТВА КЛАСС СОЕДИНЕНИЙ
А) H2SO4 1) средняя соль
Б) CuS 2) основный оксид
В) NaHSO3 3) кислотный оксид
Г) SO2 4) кислородсодержащая кислота
5) кислая соль
(1б) Запишите названия веществ из первого столбика.
10. (1б) Назовите вещество по его физическим свойствам: бесцветный газ с резким запахом, при -100С сгущается в бесцветную жидкость, хорошо растворяется в воде, образуя слабую кислоту, ядовит.
11.(3б) Используя метод электронного баланса, составьте уравнение реакции по схеме:
H2SO4 + Fe → Fe2(SO4)3 + SO2 + H2O
Определите окислитель и восстановитель
Оценивание: «5» - 20-23 балла «4» - 19-16 баллов «3» - 15-11 баллов
«2» - 10 и менее
Контрольная работа №2 по теме «Подгруппа кислорода»
Вариант 3При выполнении заданий 1-4 укажите только одну цифру, которая соответствует номеру правильного ответа.
1. (1б) Химическому элементу, степень окисления которого в высшем оксиде +6, соответствует схема распределения электронов в атоме:
1) 2, 8, 6 2) 2, 8, 8, 2 3) 2, 8, 3 4) 2, 6
2. (1б) Максимально возможную степень окисления атом серы проявляет в соединении
1) H2S 2) K2SO3 3) FeS2 4) Li2S
3. (1б) Сульфид - ион образуется при электролитической диссоциации
1) MgSO4 2) PbS 3) NaHSO3 4) K2S4. (1б) Верны ли следующие суждения о правилах безопасной работы в химической лаборатории?
А. При нагревании жидкости необходимо закрыть пробирку пробкой.
Б. При приготовлении раствора серной кислоты концентрированную кислоту необходимо добавлять в воду.1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны
При выполнении заданий 5,6 выберите правильный ответ и
запишите уравнения реакций.
5. (3б) Сероводородная кислота реагирует с каждым из веществ:
1) HCl и O2 2) NaOH и NaCl 3) Н3РО4 и КОН 4) NaOH и Аl(ОН)36. (2б) Оксид серы(VI) реагирует с оксидом кремния 2) оксидом алюминия 3) нитратом натрия 4) хлором
7. (2б) Вычислите массовую долю серы в серной кислоте.
8. (2б) Установите соответствие между двумя веществами и реактивом, с помощью которого можно различить эти вещества. К каждому элементу первого столбца подберите соответствующий элемент из второго столбца
ВЕЩЕСТВА РЕАКТИВ
А) H2SO4 и HNO3 1) CuCl2
Б) Na2SO4 и NaOH 2) MgO
3) BaCl2
(1б) Дайте объяснение выбранным ответам, подтвердите, по возможности, уравнениями реакций в ионном виде.
9.(4б) Установите соответствие между формулой вещества и классом, к которому оно принадлежит:
ФОРМУЛА ВЕЩЕСТВА КЛАСС СОЕДИНЕНИЙ
А) H2SO3 1) средняя соль
Б) CuSO4 2) основный оксид
В) SO3 3) кислотный оксид
Г) SO2 4) кислородсодержащая кислота
5) кислая соль
(1б) Запишите название веществ из первого столбика.
10. (1б) Назовите вещество по его физическим свойствам: неустойчивое соединение, легко распадающееся при обычных условиях на газ с резким запахом и воду, поэтому существует только в водных растворах.
11.(3б)
Используя метод электронного баланса, составьте уравнение реакции
HBrO3 + H2S → S + Br2 + H2O
Определите окислитель и восстановитель.
Оценивание: «5» - 20-23 балла «4» - 19-16 баллов «3» - 15-11 баллов
«2» - 10 и менее
Контрольная работа №2 по теме «Подгруппа кислорода»
Вариант 4
1. (1б) Химический элемент, в атомах которого
распределение электронов по слоям:
2, 8, 6, образует высший оксид
-
SeO3 2) SO3 3) N2O3 4) P2O3
2. (1б) Такую же степень окисления, как и в CuS, сера имеет в соединении
1) (NH4)2S 2) H2SO4 3) Li2SO3 4) SO3
3. (1б) Вещество, при диссоциации которого образуются сульфит- ионы, имеет формулу
1) Na2S 2) S 3) K2SO3 4) CuSO4
4. (1б) Начало формы4. (1б) Верны ли следующие утверждения о правилах безопасной работы в школьной лаборатории?
А. При проведении опытов с концентрированными растворами кислот и щелочей необходимо всегда надевать резиновые перчатки.
Б. Опыты с летучими, ядовитыми веществами проводят только в вытяжном шкафу.
Конец формы
5. (3б) Среди веществ: Cu, N2O3, Сu(ОН)2, ВаСl2 - в реакцию с раствором серной кислоты вступает(-ют)... вещество(-а).
1) два 2) одно 3) три 4) четыре
6. (2б) Какие вещества образуются при взаимодействии железа с разбавленной серной кислотой?
1) сульфат железа(III), вода и оксид серы(IV) 2) сульфат железа(II) и водород
3) сульфат железа(III) и водород 4) сульфид железа(II) и водород
7. (2б) Вычислите массовую долю серы в сульфиде калия.
8. (2б) Установите соответствие между двумя веществами и реактивом, с помощью которого можно различить эти вещества. К каждому элементу первого столбца подберите соответствующий элемент из второго столбца
ВЕЩЕСТВА РЕАКТИВ
А) Вa(NO3)2 и KNO3 1) гидроксид натрия
Б) Na2S и Na2SO3 2) соляная кислота
3) сульфат натрия
(1б) Дайте объяснение выбранным ответам, подтвердите, по возможности, уравнениями реакций в ионном виде.
9. (4б) Установите соответствие между названием вещества и классом, к которому оно принадлежит:
НАЗВАНИЕ ВЕЩЕСТВА КЛАСС СОЕДИНЕНИЙ
А) гидросульфат калия 1) средняя соль
Б) сульфид меди (II) 2) основный оксид
В) оксид серы (VI) 3) кислотный оксид
Г) оксид серы (IV) 4) кислородсодержащая кислота
5) кислая соль
(1б) Запишите формулы веществ из первого столбика.
10. (1б) Назовите вещество по его физическим свойствам: бесцветная маслянистая жидкость, при хранении, особенно в присутствии влаги, полимеризуется и превращается в твердое прозрачное вещество, напоминающее лед, малораствримо в воде, но хорошо растворяется в серной кислоте.
11. (3б) Используя метод электронного баланса, составьте уравнение реакции
S + F2 + NaOH → Na2SO4 + NaF + H2O
Определите окислитель и восстановитель.
Оценивание: «5» - 20-23 балла «4» - 19-16 баллов «3» - 15-11 баллов
«2» - 10 и менее
Контрольная работа №2 по теме «Подгруппа кислорода»
Вариант 5
1. (1б) 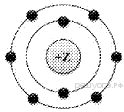 На
приведённом рисунке изображена модель атома химического элемента
На
приведённом рисунке изображена модель атома химического элемента
1) 2-го периода VIIIA группы 2) 2-го периода VIA группы
3) 3-го периода VIA группы 4) 3-го периода VIIIA группы
2. (1б) Правая часть уравнения электролитической диссоциации сульфита калия:
1)→ 2К+ + SO32- 2) →2К+ + SO42- 3) → 2К+ + S2- 4) → К+ +2SO32-
3. (1б) Сульфид-ионы образуются при электролитической диссоциации
-
MgSO4 2) Na2SO4 3) H2SO3 4) Cs2S
4(1б) Начало формы
-
4. (1б) Верны ли следующие утверждения о правилах работы в
школьной лаборатории?
А. Вещества нельзя брать руками, для этого используют ложечки, шпатели или пинцеты.
Б. При попадании кислоты на кожу пораженное место надо промыть большим количеством воды и обработать раствором питьевой соды.
Конец формы
5. (3б) Оксид серы(IV) взаимодействует с каждым из веществ:
1) оксидом калия и сульфатом меди 2) водой и хлоридом натрия
3) кислородом и гидроксидом кальция 4) азотом и хлороводородом6. (2б) И концентрированная, и разбавленная серная кислота взаимодействует с S
2)
Cu
3)
Al(OH)3
4)
FeSO4
Решите задачу
7. (2б) Вычислите массовую долю кислорода в сульфите магния.
8. (2б) Установите соответствие между двумя веществами и реактивом, с помощью которого можно различить эти вещества. К каждому элементу первого столбца подберите соответствующий элемент из второго столбца
ВЕЩЕСТВА РЕАКТИВ
А) сульфит калия и сульфат калия 1) вода
Б) сульфид калия и сульфид свинца 2) соляная кислота
3) гидроксид натрия
(1б) Дайте объяснение выбранным ответам, подтвердите, по возможности, уравнениями реакций в ионном виде.
9. (4б) Установите соответствие между названием вещества и классом, к которому оно принадлежит:
НАЗВАНИЕ ВЕЩЕСТВА КЛАСС СОЕДИНЕНИЙ
А) сульфат калия 1) средняя соль
Б) сульфид свинца (II) 2) основный оксид
В) сернистая кислота 3) кислотный оксид
Г) оксид серы (IV) 4) кислородсодержащая кислота
5) кислая соль
6) бескислородная кислота
(1б) Запишите формулы веществ из первого столбика.
10. (1б) Назовите вещество по его физическим свойствам: тяжелая бесцветная маслянистая жидкость, растворяющаяся в воде в любых соотношениях, при растворении в воде выделяется большое количество теплоты, в концентрированном виде - гигроскопично, нелетучее, без запаха, не проводит электрический ток, раствор - электролит.
11. ( 3б) Используя метод электронного баланса, составьте уравнение реакции
Mg + H2SO4 → MgSO4 + H2S + H2O
Определите окислитель и восстановитель
Оценивание: «5» - 20-23 балла «4» - 19-16 баллов «3» - 15-11 баллов
«2» - 10 и менее