- Учителю
- Урок по химии для 11 класса по теме «Свойства аренов»
Урок по химии для 11 класса по теме «Свойства аренов»
План - конспект урока по химии в 11 «в» классе по теме «Свойства аренов»
Предыбайло Е. А. учитель химии
Цель: изучить физические и химические свойства аренов на примере бензола.
Задачи:
Образовательная: изучить химические свойства и способы получения бензола; формировать умения в обращении с химическим оборудованием, проведении опытов, характеризующих химические свойства бензола, выстраивать логическую цепочку получения бензола.
Воспитательная: расширять познавательную деятельность и исследовательские компетенции при изучении свойств ароматических углеводородов.
Развивающая: развивать способность к построению логических цепочек; совершенствовать способность характеризовать химические свойства веществ, опираясь на знание их химического строения.
Методы ведения урока:
-
Словесные (беседа, объяснение, рассказ).
-
Наглядные (компьютерная презентация, плакат по строению ароматических углеводородов).
-
Практические (демонстрация видео опытов).
Тип урока: Комбинированный.
Оборудование: модель молекулы бензола, мультимедийная презентация « Свойства аренов».
I.Организационный момент
II. Проверка пройденного материала
1.
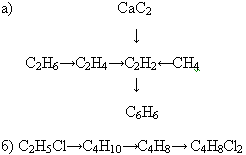
2. а) общая формула ароматических углеводородов...
б) формула бензола (молекулярная, структурная)...
в) расстояние между ядрами атомов углерода в бензоле...
г) состояние гибридизации атомов углерода в молекуле бензола...
д) химическую связь в бензоле называют…
е) учёный, предложивший в 1865 г. структурную формулу бензола…
3. Составьте молекулярные формулы аренов, имеющих в своем составе:
а) 7 атомов углерода;
б) 12 атомов водорода.
III. Изучение новой темы.
Из истории…
Впервые бензол описал немецкий химик Иоганн Глаубер, который получил это соединение в 1649 году в результате перегонки каменноугольной смолы. Но ни названия вещество не получило, ни состав его не был известен.
Поэтому своё второе рождение бензол получил благодаря работам Фарадея. Бензол был открыт в 1825 году английским физиком Майклом Фарадеем, который выделил его из жидкого конденсата светильного газа.
В 1833 году немецкий физико-химик Эйльгард Митчерлих получил бензол при сухой перегонке кальциевой соли бензойной кислоты (именно от этого и произошло название бензол).
Физические свойства
Агрегатное состояние
Жидкость
Температура плавления
5.5◦ с ( повышается с увеличением относительных молекулярных масс )
Температура
кипения
80.1◦ с (повышается с увеличением относительных молекулярных масс )
Демонстрация видео опыта
Химические свойства
Общая характеристика реакционной способности аренов
Для разрыва ароматической системы аренов необходимо затратить большую энергию, поэтому арены вступают в реакции присоединения только в жестких условиях: при значительном повышении температуры или в присутствии очень активных реагентов. В связи с этим, наиболее характерными для них будут реакции замещения атомов водорода, протекающие с сохранением ароматической системы.
Реакции замещения
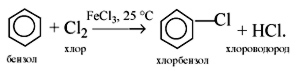
1. Галогенирование -
a) бензола
C6H6 + Cl2 AlCl3→ C6H5-Cl + HCl (хлорбензол)
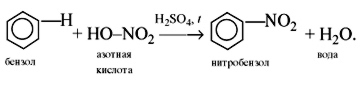
б) нитрование бензола
C6H6 + HO-NO2 t, H2SO4→ C6H5-NO2 + H2O
нитробензол - запах миндаля!
(Демонстрация видео опыта)
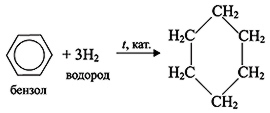
РЕАКЦИИ ПРИСОЕДИНЕНИЯ (труднее, чем у алкенов)
Гидрирование
C6H6 + 3H2 t,Pt или Ni → C6H12 (циклогексан)
Галогенирование
C6H6 +3Cl2 hν → C6H6Cl6 (гексахлорциклогексан - гексахлоран)
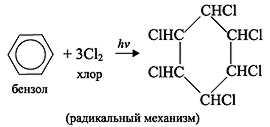
(Демонстрация видео опыта)
РЕАКЦИИ ОКИСЛЕНИЯ
1. Горение (коптящее пламя): 2C6H6 + 15O2 t → 12CO2 + 6H2O + Q (Демонстрация видео опыта)
2. Бензол при обычных условиях не обесцвечивает бромную воду и водный раствор марганцовки
3. Гомологи бензола окисляются перманганатом калия (обесцвечивают марганцовку):
А) в кислой среде до бензойной кислоты
При действии на гомологи бензола перманганата калия и других сильных окислителей боковые цепи окисляются. Какой бы сложной ни была цепь заместителя, она разрушается, за исключением a -атома углерода, который окисляется в карбоксильную группу.
Гомологи бензола с одной боковой цепью дают бензойную кислоту:

Гомологи, содержащие две боковые цепи, дают двухосновные кислоты:
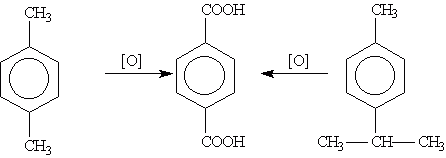
5C6H5-C2H5 + 12KMnO4 + 18H2SO4 → 5C6H5COOH + 5CO2 + 6K2SO4 + 12MnSO4 + 28H2O
5C6H5-CH3 + 6KMnO4 + 9H2SO4 → 5C6H5COOH + 3K2SO4 + 6MnSO4 +14H2O
Упрощённо:
C6H5-CH3 + 3O KMnO4 → C6H5COOH + H2O
Б) в нейтральной и слабощелочной до солей бензойной кислоты
C6H5-CH3 + 2KMnO4 → C6H5COOК + KОН + 2MnO2 + H2O
Выводы:
-
Арены - химически устойчивые соединения, наиболее склонны к реакциям замещения.
-
Вследствии нарушения равномерного распределения электронной плотности в кольце производные бензола легче вступают в химические реакции.
IV.Закрепление
1.Объясните, почему бензол, являющийся непредельным соединением, с большим трудом вступает в реакции присоединения.
2.Составьте уравнения реакций горения бензола и этилбензола.
Почему бензол и его гомологи часто коптят при горении на воздухе?
3.Напишите уравнение реакций, с помощью которых можно осуществить следующие превращения:
C CH₄ X C₆H₆ C₆H₅CL
V.Задание на дом:
§5.3; упр.8 стр.129.
VI.Итоги урока.