- Учителю
- Открытый урок по теме аммиак
Открытый урок по теме аммиак
«Мало знать, надо и применять.
Мало хотеть, надо и делать»
(ГЁТЕ)
Цель урока:
-
Вызвать устойчивый интерес к изучаемой теме, мотивировать учебную деятельность обучающихся; изучить строение молекулы аммиака;
-
Историю происхождения химического названия, физические свойства, химические свойства;
-
Рассмотреть способы получения аммиака и практическое применение;
-
Сформировать умения правильного и безопасного обращения с аммиаком.
Задачи урока:
-
Рассмотреть строение молекулы аммиака и на его основе предположить свойства вещества
-
Закрепить умения и навыки химического эксперимента
-
Показать значение аммиака в жизни человека, действие его на организм
-
Активизировать познавательную деятельность учащихся с помощью исследовательской деятельности
-
Развить умения работать самостоятельно и в парах.
Тип урока: изучение нового материала
Методы:
- Проблемный (вопросы, ситуации);
- Объяснительно-иллюстративный (рассказ, опыт, видеоролик, беседа, работа по схемам, показ слайдов, разгадывание кроссвордов, работа с учебником и тетрадями);
- Репродуктивный (уравнения химических реакций и электронно-графические формулы);
- Исследовательский (история англичан и опыт).
Оборудование: Таблица растворимости, ПСХЭ Д.И.Менделеева, ПК, проектор, экран, использование мультимедиа презентаций Power Point; конверт с заданием (схема 1), иллюстрация атомов химических элементов, смайлики, ватман с кроссвордом, тесты (2 варианта)
Набор реактивов: раствор аммиака, 25% раствор соляной кислоты, лабораторная посуда.
ХОД УРОКА:
-
Организационный момент
-
Проверка домашнего задания
По горизонтали: 5. Латинское название азота, означает рождающий селитру. 6. Для лечения этого заболевания используют чистый азот. 7. Без азота нет его, а без его нет жизни. 9. Соль азотистой кислоты.
По вертикали: 1.Удобрение. 2. Ученый, который ввел название азот. 3. Самый распространенный элемент в атмосфере. 4. Что в переводе означает слово азот. 8. Соль азотной кислоты.
-
Актуализация знаний
Начиная изучение новой темы, обратимся к истории. …Во время 1 Мировой войны английский крейсер вел преследование поврежденного в бою немецкого эсминца. Цель была почти достигнута, как вдруг между кораблями появилось белое удушливое облако дыма. Экипаж крейсера почувствовал резкий запах, раздражающий горло и легкие. Крейсер должен был вынужден дать задний ход и выйти из дымового облака. Уже после обнаружили, что пострадали не только люди, но и металлические части корабля. Что же это было за едкое облако и какой газ почувствовали люди? Попробуем частично воспроизвести картину давних лет. (ОПЫТ)
Среди соединений азота есть удивительное вещество - летучее водородное соединение АММИАК.
Тема сегодняшнего урока «Аммиак» (записать в тетрадь)
-
Изучение нового материала (Слайд)
-
Состав
-
Строение
-
Свойства (физические и химические)
-
Применение
-
Получение. (записать в тетрадь)
-
Состав
Строение




(Зарисовать в тетрадь)
Составьте электронно-графическое строение атомов азота и водорода.
Чему равно число неспаренных электронов?
Сделайте вывод о валентностях.
Водородная связь (определение, условное обозначение).
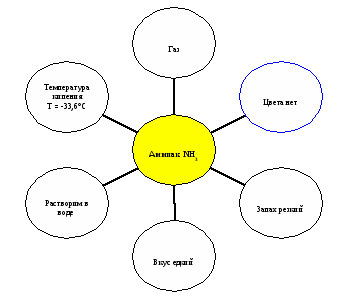
Свойства
Физкультминутка
Реснички опускаются,
Глазки закрываются,
Мы спокойно отдыхаем,
Сном волшебным засыпаем.
Дышится легко, ровно, глубоко.
Наши руки отдыхают,
Ноги тоже отдыхают,
Отдыхают, засыпают.
Шея не напряжена
И расслаблена.
Губы чуть приоткрываются,
Всё чудесно расслабляется.
Дышится легко, ровно, глубоко.
Химические свойства: (записать в тетрадь)
При растворении аммиака в воде образуется гидрат аммиака, который диссоциирует:
NH3 + H2O = NH4 OH (нашатырный спирт) ВИДЕОРОЛИК
С кислотами образует соли аммония (занимательный опыт с соляной кислотой и аммиачной водой)
NH3 + HCl = NH4Cl хлорид аммония (нашатырь)
NH3 - низшая степень окисления азота
Реакция горения аммиака 4NH3 + 3O2 = 2N2 + 6H2O (Слайд)
ИНСТРУКТАЖ по ТБ (Слайд)
Применение
Работа с учебником стр. (Слайд)
Получение ВИДЕОРОЛИК
-
Домашнее задание
П.25, упр.1,2 (придумать и нарисовать сказочный образ аммиака) (Слайд)
-
Закрепление
Проверочный тест
I вариант
1. Азот входит в главную подгруппу:
-
IV группы;
-
V группы;
-
VI группы;
-
VII группы.
2. Раствор аммиака в воде окрашивает лакмус в:
-
Красный цвет;
-
Синий цвет;
-
Фиолетовый цвет;
-
Не окрашивает совсем.
3. Аммиак горит в кислороде без катализатора с образованием:
-
Азота;
-
Оксида азота (II);
-
Оксида азота (III);
-
Азотной кислоты.
4. Валентность азота может быть равна:
-
1,3;
-
2,3;
-
3,4;
-
3,5.
5. Нашатырный спирт - это:
-
Раствор аммиака в воде;
-
Раствор аммиака в спирте;
-
Хлорид аммония;
-
Медицинский спирт.
Проверочный тест
II вариант
-
Азот при обычных условиях - …
-
Тяжелый металл;
-
Бесцветная маслянистая жидкость;
-
Одноатомный инертный газ;
-
Газ без цвета и запаха, состоящий из двухатомных молекул.
-
-
Реакция между хлоридом аммония и гидроксидом кальция идет потому что:
-
Выпадает осадок;
-
Выделяется газ - аммиак;
-
Образуется соль;
-
Реакция не идет.
-
-
Аммиак горит в кислороде в присутствии катализатора с образованием:
-
Азота;
-
Оксида азота (II);
-
Оксида азота (III);
-
Азотной кислоты
-
-
Степень окисления азота в молекуле аммиака:
-
0;
-
+3;
-
-3;
-
+5;
-
-
Нашатырь - это:
-
Раствор аммиака в воде;
-
Раствор аммиака в спирте;
-
Хлорид аммония;
-
Поваренная соль.
-
-
Вывод по уроку
Что нового вы узнали на уроке?
Оценки за урок
-
Рефлексия
Смайлики (Слайд)