- Учителю
- Опорный конспект для подготовки к ЕГЭ Спирты
Опорный конспект для подготовки к ЕГЭ Спирты
Спирты - одна или несколько групп ОН, соединенных с у/в радикалом
1) по числу групп ОН:
-одноатомные -СН3ОН- метанол, метиловый спирт

 -двухатомные
-СН2-СН2 этандиол 1,2, этиленгликоль
-двухатомные
-СН2-СН2 этандиол 1,2, этиленгликоль
ОН ОН


 -трехатомные
-СН2-СН-СН2 пропантриол-1,2,3 глицерин
-трехатомные
-СН2-СН-СН2 пропантриол-1,2,3 глицерин
ОН ОН ОН
2) по характеру радикала:
-предельные СН3-СН2- ОН этанол
- непредельные СН2=СН-СН2-ОН пропен-2-ол-1
-ароматические
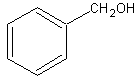
Фенилметанол (бензиловый сирт)

С-СН2-СН2-ОН
2-фенилэтанол

ОН
Фенол, группа OH cвязана с с атомом С бензольного кольца





 -многоатомные
СН2-СН-СН-СН-СН-СН2 гексанол
-многоатомные
СН2-СН-СН-СН-СН-СН2 гексанол
ОН ОН ОН ОН ОН ОН
С пирты,
содержащие 2гидроксильные группы при одном атоме углерода,
неустойчивы и самопроизвольно разлагаются с образованием альдегидов
ОН
пирты,
содержащие 2гидроксильные группы при одном атоме углерода,
неустойчивы и самопроизвольно разлагаются с образованием альдегидов
ОН
 СН3-
СН СН3-С= О +Н2О
СН3-
СН СН3-С= О +Н2О

 ОН Н
ОН Н

 Или кетонов
СН3 ОН
Или кетонов
СН3 ОН

 С
СН3-С-СН3+Н2О
С
СН3-С-СН3+Н2О
СН3 ОН ||
неустойчивы O
C
 H2=CH-OH
СН3-С =О превращаются в альдегид
H2=CH-OH
СН3-С =О превращаются в альдегид
Непредельные спирты группы ОН Н
Связанная С 2-й связью кето-енольная таутомерия
3. по характеру атомов С, с которыми связана группа ОН
-первичные СН3-СН2-СН2-ОН пропанол-1
 - вторичные
СН3-СН-СН3 пропанол-2
- вторичные
СН3-СН-СН3 пропанол-2
 ОН
СН3
ОН
СН3
 -третичные
СН3-С-СН3 2-метилпропанол-2
-третичные
СН3-С-СН3 2-метилпропанол-2
ОН
НОМЕНКЛАТУРА: суффикс -ОЛ Изомерия
-диол -1,2 1) положение группы ОН (с трёхатомного спирта)




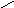
 С-СН2-СН2-ОН
2) изомерия у/в цепи (с четырёхатомного спирта)
С-СН2-СН2-ОН
2) изомерия у/в цепи (с четырёхатомного спирта)
2-фенилэтанол 3) межклассовая - простые эфиры
СН3-О-СН3
Диметиловый эфир
 СН=С-СН-СН3
СН=С-СН-СН3
ОН бутин-3-ол-2
Сначала в названии указывается положение кратных связей, а после положение группы OH
ФИЗИЧЕСКИЕ СВОЙСТВА СnH2n +OH
C1-C11- Ж, С12Н25ОН - Тв СnH2n + 2O
Алкогольный 3, р в Н2О, при увеличении R, растворимость уменьшается
Октанол не смешивается с Н2О
…
 Н-О….Н-О…
водородные связи аномальные
Н-О….Н-О…
водородные связи аномальные
R R высокие для М t кип
ХИМИЧЕСКИЕ СВОЙСТВА :
1. с щелочными и щелочноземельными Ме
2Na+2C2H5OH 2C2H5ONa +H2 этилат Na
2. с галогеноводородами
C2H5OH+HBr C2H5Br +H2O
3. межмолекулярная дегидратация - вода отщепляется от 2х молекул спирта
С2H5OH +OH -C2H5 ----- C2H5 -O-C2H5 +H2O диэтиловый эфир
4. внутримолекулярная дегидратация спиртов
СН3-СН2- ОН----- СН2=СН2+Н2О этен
По правилу Зайцева: Н отщепляется от наименее гидрированного атома С
 СН3-
СН- СН2-СН3
CH3-CH=CH-CH3+H2O бутен-2
СН3-
СН- СН2-СН3
CH3-CH=CH-CH3+H2O бутен-2
ОН бутанол-2
5. с карбоновыми кислотами (реакция этерификации)
С
 2Н5ОН+
СН3- С=О CH3-C =O
-C2H5 +H2O
2Н5ОН+
СН3- С=О CH3-C =O
-C2H5 +H2O
Этанол ОН О этилацетат (этиловый эфир уксусной кислоты)
Уксусная кислота
6. Окисление спиртов [KMnO4, K2Cr2O7, в кисл. Среде]

 Первичные
СН3-СН2ОН СН3-С=О
СН3-С=О
Первичные
СН3-СН2ОН СН3-С=О
СН3-С=О
-Н2О Н ОН
Альдегид уксусная к-та
 Вторичные
СН3-СН-СН3 CH3-C-CH3
Вторичные
СН3-СН-СН3 CH3-C-CH3
ОН -H2O || ацетон
О
Третичные устойчивы
7. Дегидрирование спиртов
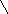 Первичные R-
CH2- OH
Cu(Ag,Pt)
200, 300 R-C=O +H2
Первичные R-
CH2- OH
Cu(Ag,Pt)
200, 300 R-C=O +H2
 H альдегид
H альдегид

 Вторичные R- CH- R
Cu, 200-300 R-C-R +H2
Вторичные R- CH- R
Cu, 200-300 R-C-R +H2
OH || кетон
О
8. Специфические
-Качественная реакция на многоатомные спирты + Cu(OH)2 ярко-синее окрашивание
- горение СnH2n+1 OH + 3n O2 nCO2+ (n+1)H2O
 2
2
- непредельные с С=С - вступает в реакцию присоединения с галогенами и т.д
СПОСОБЫ ПОЛУЧЕНИЯ
1. гидролиз галогеноалканов - нуклеофильный механизм
СН3- СН2- Br +NaOH CH3- CH2 -OH +NaBr
C


 H2-CH2+2NaOH
CH2-CH2+2NaCl +2H2O
H2-CH2+2NaOH
CH2-CH2+2NaCl +2H2O
Cl Cl 1,2- дихлорэтан ОН ОН этиленгликоль
2. гидратация алкенов СН2= СН+Н2О C2H5OH
3. гидрирование альдегидов и кетонов
 H
H
 R-C=O +
H2 R-C-OH спирт
R-C=O +
H2 R-C-OH спирт
Н Н
4. Окисление алкенов

 СН2=CH2+[O]
+H2O ------- CH2-CH2+ KOH +
MnO2
СН2=CH2+[O]
+H2O ------- CH2-CH2+ KOH +
MnO2
OH OH
5. Специфические способы
СН3ОН СО+2H2- CH3OH
C+H2O CO+ H2
Брожение глюкозы С6Н12О6 2С2Н5ОН + 2CO2
ОТДЕЛЬНЫЕ ПРЕДСТАВИТЕЛИ
1) СН3ОН -яд

 2)
СН2-СН2 этандиол -1,2 (этиленгликоль)
2)
СН2-СН2 этандиол -1,2 (этиленгликоль)
ОН ОН яд-компонент незамерзающих жидкостей -антифризов


 3)
СН2-СН2-СН2 пропантиол -1,2,3
(глицерин)
3)
СН2-СН2-СН2 пропантиол -1,2,3
(глицерин)
ОН ОН ОН в состав жиров и масел
Используется в косметике ( зубная паста - предотвращает высыхание)
В пищевой (для превращения кристаллизации), в фармацевтической промышленности.