- Учителю
- Открытый урок по химии на тему: Электронные конфигурации атомов ( 11 класс)
Открытый урок по химии на тему: Электронные конфигурации атомов ( 11 класс)
Князева Ирина Викторовна, учитель химии МБОУ «Мечетинская СОШ»
Разработка урока для 11 класса (2 часа)
Тема: Электронные конфигурации атомов хим. элементов.
Цели:
1. организовать деятельность учащихся по изучению основных закономерностей заполнения энергетических подуровней электронами. Научить учащихся составлять электронные формулы атомов через использование информационно-коммуникационных технологий, актуализировать личностный смысл к изучению темы. Представить электронную конфигурацию атомов хим. эл-тов. Электронно-графические формулы атомов хим. эл-тов. Провал ē.
2. Развивать внимание, память, речь, аналитическое мышление, способность делать выводы.
3. Воспитывать любовь к предмету.
Образовательные задачи: создать условия для изучения электронных конфигураций атомов хим. эл-тов. Электронно-графических формул атомов хим. эл-тов. Понятия провал ē , используя различные источники информации; расширить знания
Развивающие задачи: продолжить формирование умений поиска взаимосвязи между новым и изученным материалом, развитие логического мышления через организацию работы с текстами учебника, демонстрационными таблицами, дополнительной литературы, с инструкциями, умений сравнивать, обобщать, делать вывод.
Воспитательные задачи: формировать личностный смысл к изучению темы, коммуникативные качества учащихся через организацию групповой работы на уроке, интерес к знаниям.
Тип урока: комбинированный
Метод: рассказ с элементами беседы
Технология: ИКТ
Этапы урока:
I. Организационный момент.
II. Опрос:
-
Что такое электронное облако?
-
Чем отличается 1s-орбиталь от 2s-орбитали?
-
Что такое главное квантовое число? Как оно соотносится с номером периода?
-
Что такое подуровень и как это понятие соотносится с номером периода?
III. Изучение нового материала:
Швейцарский физик В. Паули в 1925 г. установил, что в атоме на
одной орбитали может находиться не более двух электронов, имеющих
противоположные (антипараллельные) спины (в переводе с английского
«веретено»), то есть обладающих такими свойствами, которые условно
можно представить себе как вращение электрона вокруг своей
воображаемой оси: по часовой или против часовой стрелки. Этот
принцип носит название принципа Паули.
Если на орбитали находится один электрон, то он называется
неспаренным, если два, то это спаренные электроны, то есть
электроны с противоположными спинами.
Давайте попробуем представить себе, что такое движущийся со скоростью света электрон. Обладая ничтожной массой и вращаясь так быстро, что говорить о конкретном месторасположении некорректно, фактически выглядит как туман с большей плотностью в срединной части и меньшей на большем удалении от предполагаемой орбиты.
Расположение атомной орбитали относительно ядра, её форма и размеры определяются запасом энергии, которым обладают находящиеся на ней ē. Чем меньше запас энергии ē, тем сильнее притягивается он к ядру и тем меньше по размерам его орбиталь.
Давайте вспомним, какой формы бывают электронные облака:
Различают четыре вида форм электронных облаков:
1) ē, который при движении образует облако шаровой (сферической) формы, называют s-электронами, а орбиталь - s-орбиталь. Для каждого значения n существует одна s-орбиталь, но с соответствующим запасом энергии электронов на нем и, следовательно, с соответствующим диаметром, растущим по мере уеличения значения n.
2) электронное облако может иметь форму гантели. Гантелевидные облака с одинаковым запасом энергии расположены в пространстве по взаимоперпендикулярным осям координат x, y, z, проведённых через ядро атома. Это р-облака. Каждое из них вмещает р-электроны. С ростом значения n электроны занимают р-орбитали, расположенные на больших расстояниях от ядра и направленные по осям x, y, z.
Помимо s- и р-облаков, существуют d- и f-облака. Они более сложные по строению, а главное, для электронов требуют огромных энергетических усилий заселение этих форм орбиталей.
Для определения количества общего количества электронов, которое возможно разместить на каждом уровне, существует формула N = 2n2 , которая позволяет рассчитать , что вакансии для размещения по периодам для электронов выглядят так 2e , 8e , 18e, 32e, 50e, 72e , что показывает нам, что начиная с третьего периода в Периодической таблице уже должно быть 18 элементов. Фактически там 8e.
Начало четвертого периода подтверждается типичным щелочным металлом по порядку ,т.е. открытием нового , четвертого периода. Давайте разбираться, почему порядок заполнения не совпадает с вакантными возможностями.
Пока с классом проговариваем известные учащимся моменты о строении атомов, о заполнении электронами уровней у первых элементов, трое сильных учащихся выполняют на доске задание : один столбиком записывает электронные формулы щелочных металлов, второй - также столбиком галогены, третий - инертных газов, при этом им необходимо подчеркнуть внешние , являющиеся валентными, электроны.
Анализируя по таблице Д.И.Менделеева заполнение электронами соответствующих орбиталей, можно определить, что оно происходит в таком порядке:
1s < 2s < 2p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < 5d1 =4f14 < 5d10 <6p < 7s < 6d1= 5f14 < 6d10 < 7p.
Тогда выводится на экран таблица вакантных возможностей для каждого периода, предлагается сравнить порядок заполнения с вакантными возможностями, подводя рассуждения к возникновению вопроса, а почему так происходит.
На рисунке 5 учебника показана схема подразделения энергетических уровней на подуровни. Разные формы подачи одной и той же информации помогает развить гибкость восприятия.
.
Для атома гелия Не, имеющего два спаренных электрона на одной
s-орбитали, эта формула: 1s2.
Электронная оболочка атома гелия ,как и других инертных газов
(приводим примеры, показывая на выписанные для сравнения в таблицу)
завершена и очень устойчива. Гелий - это благородный газ.
На втором энергетическом уровне (n = 2) имеется четыре орбитали:
одна s и три р. Электроны s-орбитали второго уровня (2s-орбитали)
обладают более высокой энергией, так как находятся на большем
расстоянии от ядра, чем электроны 1s-орбитали (n = 2).
Вообще, для каждого значения n существует одна s-орбиталь, но с
соответствующим запасом энергии электронов на нем и, следовательно,
с соответствующим диаметром, растущим по мере увеличения значения
n.
р-Орбиталь имеет форму гантели или объемной восьмерки. Все три
р-орбитали расположены в атоме взаимно перпендикулярно вдоль
пространственных координат, проведенных через ядро атома. Следует
подчеркнуть еще раз, что каждый энергетический уровень (электронный
слой), начиная с n = 2, имеет три р-орбитали. С увеличением
значения n электроны занимают р-орбитали, расположенные на больших
расстояниях от ядра и направленные по осям х, у, г.
У элементов третьего периода заполняются соответственно З s - и
Зр-орбитали. Пять d-орбиталей третьего уровня при этом остаются
свободными: по учебнику работаем с таблицей №3.
У элементов больших периодов (четвертого и пятого) первые два
электрона занимают соответственно 4я- и 5я-орбитали: 19К
2, 8, 8, 1; 38Sr 2, 8, 18, 8, 2 . Начиная с третьего
элемента каждого большого периода, последующие десять электронов
поступят на предыдущие 3d- и 4d- орбитали соответственно (у
элементов побочных подгрупп): 23V 2, 8, 11,
2;26Tr 2, 8, 14, 2; 40Zr 2, 8, 18, 10, 2;
43Тг 2, 8, 18, 13, 2. Как правило, тогда, когда будет
заполнен предыдущий d-подуровень, начнет заполняться внешний
(соответственно 4р- и 5р ) р-подуровень.
86Rn 2, 8, 18, 32, 18, 8.
Учащиеся, выполнявшие работу у доски, анализируют, что общего у
каждой группы элементов, и делают вывод, как можно предположить
свойства атома, зная, какой он обладает внешней оболочкой
электронов.
Очень часто строение электронных оболочек атомов изображают с
помощью энергетических или квантовых ячеек - записывают так
называемые графические электронные формулы. Для этой записи
используют следующие обозначения: каждая квантовая ячейка
обозначается клеткой, которая соответствует одной орбитали; каждый
электрон обозначается стрелкой, соответствующей направлению спина.
При записи графической электронной формулы следует помнить два
правила: принцип Паули, согласно которому в ячейке (орбитали) может
быть не более двух электронов, но с антипараллельными спинами, и
правило Ф. Хунда, согласно которому электроны занимают свободные
ячейки (орбитали), располагаются в них сначала по одному и имеют
при этом одинаковое значение спина, а лишь затем спариваются, но
спины при этом по принципу Паули будут уже противоположно
направленными.
В заключение еще раз рассмотрим отображение электронных
конфигураций атомов элементов по периодам системы Д. И. Менделеева.
Схемы электронного строения атомов показывают распределение
электронов по электронным слоям (энергетическим уровням).
На экран выводится соответствующая таблица: Таблица 2 Строение
электронных оболочек атомов элементов второго периода

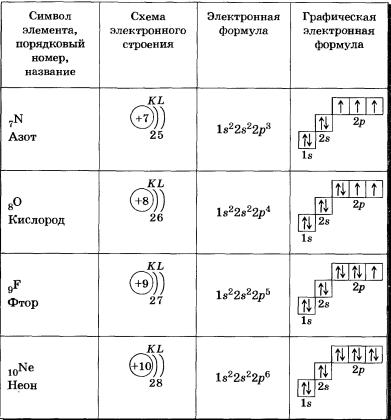
Чтобы еще раз проследить порядок заполнения электронами уровней,
а также сравнить разные способы записи.
У атомов калия и кальция появляется четвертый электронный слой, заполняется 4s-подуровень (табл. 4 в учебнике), так как он имеет меньшую энергию, чем З d-подуровень.
И на данном этапе у учащихся возникнет вопрос, как мы узнаем, что начинается заполнение 4s-подуровня?
Сначала это обсудить, ссылаясь на Периодическую систему элементов и порядок ее заполнения, а затем познакомить с правилом Клечковского В.М. .Предложить произвести расчеты , чтобы обоснованно утверждать, какой порядок заполнения уровней электронами предпочтительнее в энергетическом плане.
Двое учащихся у доски производят вычисления, суммируя главное квантовое число и орбитальное, сравнивая каждый случай, когда фактическое заполнение не совпадает с вакантными возможностями.
Предлагается разделиться на группы.
Осознанно выполняется задание по расписыванию электронных оболочек
ряда химических элементов таких , как медь, хром, палладий,
платина, вольфрам, золото.
Обратите внимание на строение электронных оболочек атомов хрома
и меди. В них происходит «провал» одного электрона с 4я- на
Зй-подуровень, что объясняется большей энергетической устойчивостью
образующихся при этом электронных конфигураций Зd5 и
Зd10:
Экспериментально доказано, что состояния атомов, при которых p-,
d-, f-орбитали заполнены наполовину (p3,d5,
f7), целиком (p6, d10,
f14) или свободны, обладают повышенной устойчивостью.
Этим объясняются переходы - «провалы» - электронов между
близкорасположенными орбиталями. Те же отклонения наблюдаются у
аналога хрома - молибдена, а также у элементов подгруппы меди -
серебра и золота. Уникален в этом отношении палладий, у атома
которого 5s-электроны вообще отсутствуют и который имеет следующую
конфигурацию: 46Pd
1s22s22p63s23p64s23d104р65s04d10.

Экспериментально доказано, что состояния атомов, при которых p-, d-, f-орбитали заполнены наполовину (p3,d5, f7), целиком (p6, d10, f14) или свободны, обладают повышенной устойчивостью. Этим объясняются переходы - «провалы» - электронов между близкорасположенными орбиталями. Те же отклонения наблюдаются у аналога хрома - молибдена, а также у элементов подгруппы меди - серебра и золота. Уникален в этом отношении палладий, у атома которого 5s-электроны вообще отсутствуют и который имеет следующую конфигурацию: 46Pd 1s22s22p63s23p64s23d104р65s04d10.
У элементов пятого периода идет заполнение подуровней в
следующем порядке: 5s-> 4d -> 5р. И также встречаются
исключения, связанные с «провалом» электронов, у 41Nb,
42Mо и т.д.
В шестом и седьмом периодах появляются элементы, то есть элементы,
у которых идет заполнение соответственно 4f- и 5f-подуровней
третьего снаружи электронного слоя.
4f-Элементы называют лантаноидами.
5f-Элементы называют актиноидами.
Порядок заполнения электронных подуровней в атомах элементов
шестого периода: 55Сs и 56Ва -
6s-элементы;
И здесь встречаются элементы, у которых «нарушается» порядок
заполнения электронных орбиталей, что, например, связано с большей
энергетической устойчивостью наполовину и полностью заполненных f
подуровней, то есть nf7 и nf14.
Итак, мы с вами уже можем сделать ряд выводов:
В зависимости от того, какой подуровень атома заполняется
электронами последним, все элементы, как вы уже поняли, делят на
четыре электронных семейства или блока (рис. 7).
1) s-Элементы; заполняется электронами s-подуровень внешнего
уровня атома; к s-элементам относятся водород, гелий и элементы
главных подгрупп I и II групп;
2) р-элементы; заполняется электронами р-подуровень внешнего
уровня атома; к р элементам относятся элементы главных подгрупп
III-VIII групп;
3) d-элементы; заполняется электронами d-подуровень предвнешнего
уровня атома; к d-элементам относятся элементы побочных подгрупп
I-VIII групп, то есть элементы вставных декад больших периодов,
расположенные между s- и р-элементами. Их также называют
переходными элементами;
4) f-элементы, заполняется электронами f-подуровень третьего
снаружи уровня атома; к ним относятся лантаноиды и актиноиды.
IV Закрепление нового материала
1. О чем гласит принцип Паули ? Что было бы, если бы он не
соблюдался?
2. Что было бы, если бы правило Хунда не соблюдалось?
3. Что такое «провал» электрона? Приведите примеры элементов, у
которых это явление наблюдается, запишите их электронные
формулы.
4. Как определяется принадлежность химического элемента к тому
или иному электронному семейству?
5. Сравните электронную и графическую электронную формулы атома
серы. Как последняя помогает рассчитать все возможные валентности ?
</<font color="#373737">V Информирование о домашнем задании:
1. Напишите электронную формулу элемента № 114, используя
приобретенные знания, предположите, какими свойствами должно
обладать вещество, образованное атомами из этого элемента.
2. Сравните электронную и графическую электронную формулы атома серы. Как последняя помогает рассчитать все возможные валентности?
Параграфы & 2.3
VI Подведение итогов:
Проанализировать, дать оценку достижения цели урока, обозначить перспективу. Выставление оценок, ответить на возникшие вопросы.
Выпускник получит возможность научиться:
• прогнозировать химические свойства веществ на основе их состава и строения атомов.
• и развить абстрактно-логическое мышление
Постановка проблемы:
Изучая данную тему, расписывая электронные формулы элементов, мы с учащимися постоянно делали акцент на внешний слой атомов, который непосредственно обуславливает химические свойства (валентные возможности в том числе) , проговаривали, как внешний слой помогает определить, к какой группе веществ будут относиться образованные с определенным заполнением внешних орбиталей атомы. Например, с np5 - это обязательно галоген.
Поэтому опирались в своих рассуждениях и на такой тезис:
Экспериментально доказано, что состояния атомов, при которых p-, d-, f-орбитали заполнены наполовину (p3,d5, f7), целиком (p6, d10, f14) или свободны, обладают повышенной устойчивостью. Этим объясняются переходы - «провалы» - электронов между близкорасположенными орбиталями. Те же отклонения наблюдаются у аналога хрома - молибдена, а также у элементов подгруппы меди - серебра и золота. Уникален в этом отношении палладий, у атома которого 5s-электроны вообще отсутствуют и который имеет следующую конфигурацию: 46Pd 1s22s22p63s23p64s23d104р65s04d10.
Захотелось, чтобы учащиеся высказали свои предположения про аномалию подгруппы меди, элементы которой имеют внешнее строение подобное щелочным металлам (по одному s-электрону), но при этом
проявляют химическую пассивность. На момент возникновения проблемной ситуации учащиеся обладали уже достаточным уровнем первоначальных знаний по теме. Возникшая ситуация вызвала дискуссию, которая была прервана звонком. Поэтому получили задание на дом - найти из любых источников ответ на проблемный вопрос.
На следующем уроке была возможность выделить на обсуждение максимум 10 минут.
Дети были разочарованы тем, что интернет предложил им ответы в стиле «ПОТОМУ ЧТО -ПОТОМУ». Предложено было сравнить, что общего (по одному s-электрону),и в чем отличие с щелочными металлами ,а у золота это полностью заполненные f и d -орбитали ,по энергетическим характеристикам как мини ядерные реакторы, которые как несущиеся с огромной скоростью эшелоны видимо затягивают и прочно удерживают по одному внешнему s электрону. Обсудили гипотезу, критически оценили. Мною было предложено продолжить поиск информации по данной проблеме.