- Учителю
- Экзаменационный материал по неорганической химии за курс 8 класса на 2015-2016 учебный год
Экзаменационный материал по неорганической химии за курс 8 класса на 2015-2016 учебный год
Экзаменационный материал
по химии
за курс 8 класса
на 2015-2016 учебный год
Учитель химии
Х.Н.Хаджимурадова
Билет № 1
-
Химия наука о веществах, их свойствах и превращения.
-
Из перечня выпишите названия веществ: гвоздь, стакан, графит, линейка, алюминий, железо, воронка, крахмал, уксусная кислота, глюкоза.
Билет № 2
-
Превращение веществ, роль химии в жизни человека, краткий очерк истории химии.
-
Составьте химические формулы веществ, молекулы которых имеют состав: два атома азота и три атома кислорода; атом фосфора и пять атома хлора. Прочитайте формулу.
Билет № 3
-
Периодическая система. Знаки химических элементов П.С.Х.Э. Д.И.Менделеева.
-
Из перечня выпишите названия тел: карандаш, бензин, льдина, сахар, медь, пробирка, вода, колба, проволока, алюминий.
Билет № 4
-
Химические формулы, относительная атомная и молекулярная масса.
-
Из приведенных названий: вода, водород, перекись водорода, озон- выпишите формулы сложных веществ. Рассчитайте, в каком из них наибольшая массовая доля водорода.
Билет № 5
-
Степень окисления. Бинарные соединения металлов и неметаллов.
-
Определите массовую долю кислорода в следующих соединениях: а) вода; б) гидроксид бария; в) серная кислота; г) нитрат алюминия.
Билет № 6
-
Электроны. Строение электронных оболочек атомов.
-
Даны вещества: мел, спирт, сахар, азот, кислород, поваренная соль, нафталин, уксусная кислота, углекислый газ, ртуть, магний. Сгруппируйте их последующим сходным при обычных условиях свойствам: а) вещества твердые; б) вещества жидкие; в) вещества, обладающие запахом.
Билет № 7
-
Периодическая система химических элементов.
-
Найти массу 0,75 моль молекулы азота.
Билет № 8
-
Ионная связь.
-
Найти массу и число молекул при н.у. для 11,2л кислорода.
Билет № 9
-
Ковалентная не полярная химическая связь.
-
Дайте названия бинарных соединений, формулы которых: а) Сl2O7, FeCl3, MnS, Na3N, Mg2Si, MnF4. Укажите степени окисления.
Билет № 10
-
Ковалентная полярная химическая связь.
-
Из перечисленных формул: H2S, K2SO3, KOH, SO3, Fe(OH)3, FeO, N2O3, Cu3(PO4)2, Cu2O, P2O5, H3PO4 - выпишите формулы: а) оксидов; б) оснований; в) солей; г) кислот, дайте им названия, укажите степени окисления.
Билет № 11
-
Металлическая химическая связь.
-
Определите число протонов, нейтронов и электронов в атомах элементов главной подгруппы 6 группы ПСХЭ Д.И. Менделеева.
Билет № 12
-
Простые вещества металлы, общие физические свойства металлов.
-
Определите число протонов, нейтронов и электронов в атомах элементов побочной подгруппы 6 группы ПСХЭ Д.И. Менделеева.
Билет № 13
-
Простые вещества - неметаллы. Физические свойства.
-
Написать строение атома элемента, под номером 11 и 16.
Билет № 14
-
Количество вещества Молярная масса вещества.
-
Изобразите схему строения электронной оболочки атомов: алюминия, фосфора, кислорода.
Билет № 15
-
Важнейшие классы бинарных соединений - оксиды, их классификация и свойства, летучие водородные соединения.
-
Определите положение химического элемента в ПСХЭ Д.И. Менделеева по его электронной формуле: 1s2 2s2 2p6 3s1; 1s2 2s2 2p6 3s2 3p6 4s2; 1s2 2s2 2p6 3s2 3p64s23d104p6 5s1
Билет № 16
-
Основания, их классификация и номенклатура. Основания в свете ТЭД, их свойства.
-
Укажите тип связи: CaCl2, MgCl2, Cl2, HCl, KCl.
Билет № 17
-
Кислоты, их классификация и номенклатура. Кислоты в свете ТЭД, их свойства.
-
Определите тип связи: А) Li2O, б)HBr, в)KBr ,г) Br2O, д)Br2.
Билет № 18
-
Соли, их классификация и номенклатура. Соли в свете ТЭД, их свойства.
-
Определите валентности: SiH4, CrO3, H2S, CO2, CO, SO3, SO2, Fe2O3, FeO, HBr, Cl2O5, Cl2O7, РН3, , N2O3,HCl, Cu(OH)2, HNO3, Ba(OH)2, NaCl, NaOH, H2SiO3, Fe(OH)2
Билет № 19
-
Чистые вещества и смеси. Способы разделения смеси.
-
Определите валентность: K2O, Al2O3, P2O5, NO2, N2O5, Cr2O3, Cu(OH)2, HNO3, Ba(OH)2, NaCl, NaOH, H2SiO3, Fe(OH)2SiO2, B2O3, SiH4, Mn2O7, MnO, CuO.
Билет № 20
-
Типы химических реакций. Реакция разложения.
-
Выпишите в 2 столбика оксиды металлов и оксиды неметаллов: SO3, NO2, MgO, P2O5, Al2O3, SO2, ZnO. Укажите валентность и степени окисления.
Билет № 21
-
Типы химических реакций. Реакция соединения.
-
Осуществить генетическую цепь превращений: Ca
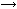 Ca(OH)2
Ca(OH)2 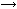 CaCO3
CaCO3 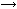 CaO
CaO 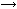 CaSO4
CaSO4 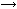 CaCl2.
CaCl2.
Билет № 22
-
Типы химических реакций. Реакция замещения.
-
Осуществить генетическую цепь превращений: Br2
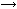 HBr
HBr 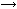 NaBr
NaBr 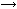 NaNO3
NaNO3
Билет № 23
-
Типы химических реакций. Реакция обмена.
-
Осуществить генетическую цепь превращений: Сера -> оксид серы( IV ) -> -> оксид серы( VI ) -> серная кислота -> сульфат бария
Билет № 24
-
Типы химических реакций на примере свойств воды.
-
Составить формулы солей (Приложение 1).
Билет № 25
-
Электролиты и неэлектролиты. Основные положения теории электролитической диссоциации. Ионные уравнения реакции.
-
Дать названия солям (Приложение 2).