- Учителю
- Урок на тему 'Кальций' (9 класс)
Урок на тему 'Кальций' (9 класс)
Тема: Кальций. Положение в ПСХЭ. Строение атома, физические и химические свойства кальция: взаимодействие с неметаллами, водой. важнейшие соединения кальция: оксид, гидроксид, соли (хлориды, сульфаты, карбонаты, фосфаты), их распространение в природе и применение. Свойства оксида и гидроксида кальция.
Цель: Познакомить с элементом кальцием и его характеристикой.
Задачи:
1. Рассмотреть положение кальция в ПС, строение его атома, свойства, важнейшие соединения, их распространение и применение;
2. Развивать умение давать характеристику элементу; составлять уравнения реакций; давать названия соединениям и различать их;
3. Воспитывать коллективизм, внимание, аккуратность.
Тип урока: изучение нового материала
Методы: словесный, наглядный
Формы работы: индивидуальные, коллективные
Ход урока
Организационный момент
Приветствие, проверка готовности класса к уроку, психологический настрой.
Опрос домашнего задания
1. Фронтальный опрос
1. Каково распространение металлов в природе?
2. Где находятся важнейшие месторождения металлов РК?
3. Что такое металлургия? Ее отрасли?
4. Назовите основные направления использования металлов в современной технике.
Изложение нового материала
Са - IIA группа, 4 период, 4 ряд
№ - 20 Ar(Ca) = 40; 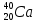 (20p, 20n)20ℯ
(20p, 20n)20ℯ
Валентность - II степень окисления - 0, +2
Природные соединения: гипс CaSO4 • 2H2O; карбонаты - мрамор, мел, известняк - CaCO3; доломит - CaCO3 • MgCO3; фосфаты - фосфориты и аппатиты Ca3(PO4)2; флюрит - CaF2.
В организме человека содержится до 1 кг кальция - в зубной эмали, в костях, крови.
Получение. 1. Электролиз расплава CaCl2:
CaCl2 → Ca + Cl2↑
Физические свойства: Са- М, Ц(с-б), З, В, Л, 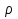 = 1, 55г/см3, tпл = 8510С, легко окисляется, хранят под слоем керосина.
= 1, 55г/см3, tпл = 8510С, легко окисляется, хранят под слоем керосина.
Химические свойства.
1. Взаимодействие с простыми веществами:
2Ca + O2 = 2CaO Ca + H2 = CaH2
Ca + Br = CaBr2 Ca + S = CaS
2. Взаимодействие со сложными веществами:
Ca + 2HCl = CaCl2 + H2↑ Ca + 2H2O = Ca(OH)2 + H2↑
На территории Казахстана соединения кальция распространены повсеместно. Крупнейшие месторождения фосфоритов - горы Каратау и Аклюбинская область (Шилисай), ценный розовый ракушечник добывают в Мангышлаке, цементные глины - около Шымкента, Семипалатинска, гипс - в Жамбылской области.
Применение: сильные восстановительные свойства кальция используются для выделения хрома, урана, циркония, рубидия и др. металлов из солей; для очистки чугуна от кислорода и серы. Из кальция получают широко ценные сплавы. Сплав кальция с магнием применяется в самолетостроении, сплав кальция со свинцом - в машиностроении, сплав кальция с литием, натрием, бором, алюминием, кремнием - в металлургии
Соединения. I. СаО - оксид кальция - негашеная известь - Р, Ц(б), тугоплавкий.
CaCO3 → CaO = CO2↑
Химические свойства.
CaO + H2O = Ca(OH)2 + 65 кДж
3CaO + P2O5 = Ca3(PO4)2
CaO + H2SO4 = CaSO4 + H2O
Применение: получение гашенной извести, карбида кальция - в строительстве.
II. Са(ОН)2 - гидроксид кальция - гашеная известь.
Химические свойства.
Ca(OH)2 + CO2 = CaCO3↓ + H2O
Ca(OH)2 + 2HCl = CaCl2 + 2H2O
Ca(OH)2 + CuCl2 = CaCl2 + Cu(OH)2↓
Применение: известковое молоко - в лаборатории, известь для побелки, а смесь извести с песком и водой - связывающее средство для кирпичной кладки и штукатурки, а также в производстве стекла; в с/х ее применяют для понижения кислотности почвы; для побелки стволов деревьев для защиты их от вредителей.
III. Соли - CaCO3 - основа круговорота кальция - Р в чистой воде, но если вода содержит угольную кислоту, он растворяется, обращаясь в бикарбонат.
Получение: CO2 +СO2 = СаCO3
Химические свойства:
CaCO3 + H2O + CO2 = Ca(HCO3)2
Одесса вся расположена на известняках, состоящих из крупных ракушек. Ракушечник - очень дешевый и красивый строительный камень золотисто-желтого цвета. Из ракушечника построены санатории и курорты на одесских лиманах, заводские корпуса и предместья города.
Карбонат кальция встречается также в виде мела, представляющего под микроскопом как бы поле доисторической битвы, от бойцов которой - доисторических микроорганизмов остались лишь одни панцири.
На железной магистрали Москва - Харьков расположен город Белгород. Нет нужды справляться, откуда произошло его название; достаточно, проезжая мимо Белгорода, выглянуть в окно вагона. В самом деле, здесь все белое. Белые тропинки извиваются между зелеными холмами, белая пыль покрывает крыши домов.
Большой известностью среди туристов пользуются сталактитовые пещеры в горах Кавказа и Крыма, среди которых есть не пройденные до конца. Известняковые пещеры-лабиринты Крыма служили советским партизанам убежищем в период их героической борьбы с фашистскими оккупантами.
Вследствие обратимости реакции превращения карбоната кальция в бикарбонат, когда капли воды, насыщенной бикарбонатом кальция, проступают из щелей на потолке известняковой пещеры, двуокись углерода выделяется и часть содержащегося в капле бикарбоната, прежде чем капля успеет упасть вниз, обращается в карбонат, выделяющийся в твердом виде. Одна за другой новые капли следуют по проложенному пути, и каждая из них, прежде чем оторваться, тоже оставляют часть осадка. Так зарождаются подобные свисающим ледяным сосулькам сталактиты - характерное украшение известняковых пещер. Капли, падающие со сталактита, на полу пещеры в свою очередь тоже отлагают карбонат кальция, и с течением времени навстречу висящей сосульке поднимается такой же столб снизу - сталагмит. В конце концов они сходятся и сливаются в колонны, которыми как бы подпираются своды наиболее древних и обширных известняковых пещер.
Тот же самый процесс осаждения из бикарбонатных вод карбоната кальция в виде накипи в миниатюре происходит в самоварах, кастрюлях и паровых котлах.
Природные соединения кальция: кораллы, скорлупа яиц, ракушки.
Нитраты, хлориды, гидро- и дигидрофосфаты - хорошо растворимы, карбонаты, силикаты, сульфаты и фосфаты - нерастворимы.
Работа в рабочей тетради упр. 206, 208, 209-212, 214, стр. 62-63
Д/з. §32-33, стр. 147-153, упр. 7, 10, стр. 154