- Учителю
- Урок по теме Алканы(10 класс)
Урок по теме Алканы(10 класс)
Тема «Алканы»
Цели:- сформировать умение составлять структурные формулы органических соединений, используя алгоритм построения, устанавливать причинно-следственные связи между составом, строением и применением веществ;
- отработать навыки пользования номенклатурой IUPAC применительно к алканам;
- ознакомить учащихся с изомерией предельных УВ, их физическими и химическими свойствами, основными способами получения.
Оборудование и реактивы: шаростержневые и объёмные модели молекул алканов, образцы парафина, жидкие алканы (пентан, гексан) бензин.
План:
-
Алканы: общая формула, состав, гомологический ряд.
-
Правила составления номенклатуры алканов.
-
Строение молекулы метана.
-
Изомерия алканов.
-
Физические свойства.
-
Получение.
-
Химические свойства.
-
Циклоалканы: состав, строние, свойства.
-
Применение алканов и их производных.
-
Алканы: общая формула, состав, гомологический ряд.
</ Предельными (насыщенными) называются углеводороды, в молекулах которых атомы углерода связаны между собой простой связью. Предельные углеводороды еще называются алканами или парафинами.
Общая формула алканов CnH2n+2, где n - число атомов углерода в молекуле.
Ряд углеводородов, сходных по свойствам и различающихся на одну или несколько групп CH2, называется гомологическим рядом, а группа CH2 называется гомологической разницей.
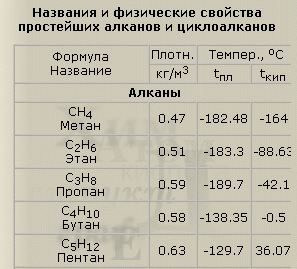
Названия элементов гомологического ряда алканов нужно уверенно знать, так как на этом основана систематическая номенклатура. Начиная с n = 1: метан СН4, этан C2H6, пропан C3H8, бутан C4H10, пентан C5H12, гексан C6H14, гептан C7H16, октан C8H18, нонан C9H20 и декан C10H22.
Если от молекулы углеводорода отнять атом водорода, то остаток молекулы -со свободной связью называется углеводородным радикалом (он обозначается буквой R). Названия алканов имеют окончание «ан», а радикалы «ил». Например, метан CH4 - метил CH3, этан C2H6 - этил C2H5 и т. д.
Соединения с одной и той же эмпирической формулой могут иметь несколько вариантов расположения атомов в молекуле, эти вещества называются изомерами. Различное расположение атомов приводит к изменению физических и химических свойств у изомеров. Начиная с бутана порядок расположения атомов в молекуле углеводорода может быть различным: в виде прямой или разветвленной цепочки:
Названия высших членов этого ряда состоят из корня - греческого числительного и суффикса -ан. Названия алканов положены в основу номенклатуры IUPAC.
-
Правила составления номенклатуры алканов.
-
Правило главной цепи.
Главную цепь выбирают, руководствуясь последовательно следующими критериями:
-
-
Максимальное число функциональных заместителей.
-
Максимальное число кратных связей.
-
Максимальная протяженность.
-
Максимальное число боковых углеводородных групп.
-
-
Правило наименьших номеров (локантов).
Главную цепь нумеруют от одного конца до другого арабскими цифрами. Каждый заместитель получает номер того атома углерода главной цепи, к которому он присоединен. Последовательность нумерации выбирают таким образом, чтобы сумма номеров заместителей (локантов) была наименьшей. Это правило применяется и при нумерации моноциклических соединений.
-
Правило радикалов.
Все углеводородные боковые группы рассматривают как одновалентные (односвязные) радикалы. Если боковой радикал сам содержит боковые цепи, то в нем по приведенным выше правилам выбирается дополнительная главная цепь, которая нумеруется, начиная с атома углерода, присоединенного к главной цепи.
-
Правило алфавитного порядка.
Название соединения начинают с перечисления заместителей, указывая их названия в алфавитном порядке. Названию каждого заместителя предшествует его номер в главной цепи. Наличие нескольких заместителей обозначают префиксами-числителями: ди-, три-, тетра- и т. д. После этого называют углеводород, соответствующий главной цепи.
-
Строение молекулы метана.
Простейший представитель алканов - метан
Его структурная и электронная формулы:
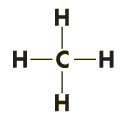
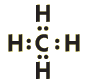
Однако эти формулы не отражают пространственного строения молекулы.
А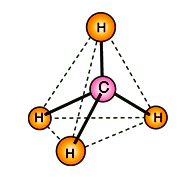
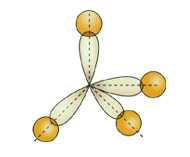 томы углерода в алканах находятся в
состоянии sp3 - гибридизации. Это означает, что все 4
гибридные орбитали атома углерода одинаковые по форме и энергии
направлены в углы равносторонней треугольной пирамиды -
тэтраэдра.
томы углерода в алканах находятся в
состоянии sp3 - гибридизации. Это означает, что все 4
гибридные орбитали атома углерода одинаковые по форме и энергии
направлены в углы равносторонней треугольной пирамиды -
тэтраэдра.
4.Изомерия алканов.
Изомерия алканов.
Изомерия - явление существования соединений, которые имеют одинаковый состав (одинаковую молекулярную формулу), но разное строение. Такие соединения называются изомерами.
Характерна структурная изомерия.
1) В формуле молекулы алкана выбирают главную цепь - самую длинную. H3C-CH-CH2-CH-CH2-CH3
-------- | ----------- |
CH3 ¦ CH2-CH2-CH3
---------------------
2) Затем эту цепь нумеруют с того конца, к которому ближе расположен заместитель (радикал). Если заместителей несколько, то поступают так, чтобы цифры, указывающие их положение, были наименьшими. Заместители перечисляют по алфавиту. 1 2 3 4
H3C-CH-CH2-CH-CH2-CH3
| 5 | 6 7
CH3 CH2-CH2-CH3
3) Углеводород называют в таком порядке: вначале указывают (цифрой) место расположения заместителя, затем называют этот заместитель (радикал), а в конце добавляют название главной (самой длинной) цепи. Таким образом, углеводород может быть назван: 2-метил-4-этилгептан (но не 6-метил-4-этилгептан).
5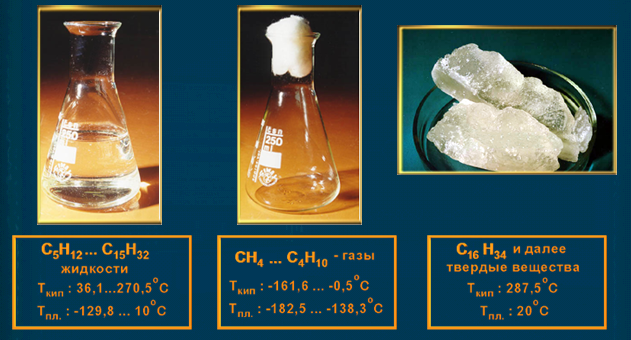 .Физические свойства
.Физические свойства
В се углеводороды плохо
растворяются в воде, легче воды.
се углеводороды плохо
растворяются в воде, легче воды.
Температура кипения и плавления постепенно увеличивается с возрастанием длины углеродной цепи.
-
Получение
В промышленности углеводороды можно получать перегонкой нефти. При этом получают обычно нефтяные фракции, кипящие в определенном интервале температур (бензин - температура кипения от 40 до 200o C, керосин - температура кипения от 200 до 275o C, дизельное топливо - температура кипения от 200 до 400o C, смазочные масла - температура кипения выше 300o C, в остатке мазут).
В лабораторной практике насыщенные углеводороды можно получать:
1) Гидрированием ненасыщенных и циклических углеводородов с никелевым катализатором:
R-CH=CH2 + H2 → R-CH2-CH3
2) Синтезом Вюрца из галогенпроизводных углеводородов:
2R-Br + 2Na → 2NaBr + R-R,
3) При сплавлении солей карбоновых кислот с щелочами (декарбоксилирование, реакция Дюма):
R-COONa + NaOH → R-H + Na2CO3.
4) Метан получается при гидролизе карбида алюминия:
Al4C3 + 12H2O = 4Al(OH)3 + 3CH4
5)Изомеризация:
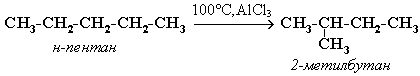
-
Химические свойства
Углеводороды ряда метана (алканы) при обычных условиях не взаимодействуют ни с кислотами, в том числе с концентрированной серной и азотной, ни с щелочами, в том числе при нагревании с расплавленными щелочами, не окисляются даже такими окислителями, как перманганаты и бихроматы в кислой среде и др. Это говорит о том, что связи C-C и C-H достаточно прочные.
Для алканов наиболее характерны реакции замещения, идущие с разрывом связи С-Н.
1) Хлорирование.
Наиболее исследован механизм реакции взаимодействия метана с хлором при высокой температуре и при интенсивном освещении.
Реакция хлорирования протекает по цепному радикальному механизму. Теорию цепных реакций разработал академик Н.Н.Семенов (1896 - 1986) и был удостоен Нобелевской премии.
Механизм реакции:
Вначале молекулы хлора под действием квантов света диссоциируют на атомы.
При взаимодействии атомарного хлора с молекулой метана образуются HCl и
радикал CH3-, который сталкиваясь с молекулой хлора дает CH3Cl и Cl-.
Ч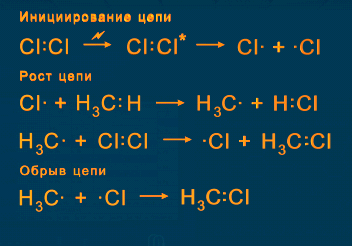 ерез несколько тысяч циклов
радикальных реакций происходит обрыв цепи -
ерез несколько тысяч циклов
радикальных реакций происходит обрыв цепи -
радикалы реагируют друг с другом.
К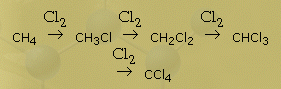 онечным продуктом взаимодействия
хлора с метаном может быть четыреххлористый углерод:
онечным продуктом взаимодействия
хлора с метаном может быть четыреххлористый углерод:
2) Горение.
При поджигании (t = 600ºС) алканы вступают в реакцию с кислородом, при этом происходит их окисление до углекислого газа и воды. СnН2n+2 + O2 -->CO2 + H2O + Q
например: СН4 + 2O2 -->CO2 + 2H2O + Q
Смесь метана с кислородом или воздухом при поджигании может взрываться.
Наиболее сильный взрыв получается при объёмных отношениях 1 : 2 (с кислородом) или 1 : 10 (с воздухом), т.к. метан и кислород вступают в реакцию полностью.
Подобные смеси опасны в каменноугольных шахтах. Чтобы обеспечить безопасность работы в шахтах, там устанавливают анализаторы, сигнализирующие о появлении газа, и мощные вентиляционные устройства.
С3Н8 + 5O2 -->3CO2 + 4H2O + Q
Горение пропан - бутановой смеси можно продемонстрировать на примере газовой зажигалки.
При горении алканов выделяется много теплоты, что позволяет использовать их в качестве источника энергии. Но большая часть их используется в качестве сырья для получения других продуктов.
3) Нитрование.
При действии разбавленной (10%) азотной кислоты на алканы под давлением при температуре 140o C идет реакция нитрования (реакция Коновалова).
CH3-CH2-CH3 + HO-NO2 → CH3-CH2-CH2-NO2 + H2O
1-нитропропан
4) При температурах 1400 - 1500o C происходит дегидрирование метана и
образуются этилен и ацетилен:
2CH4 → C2H2 + 3H2
5) Большое практическое значение в химии алканов играют реакции крекинга. При нагревании алканов до температуры более 4500 происходит разрыв С-С и С-Н связей и последующие превращения образующихся частиц.
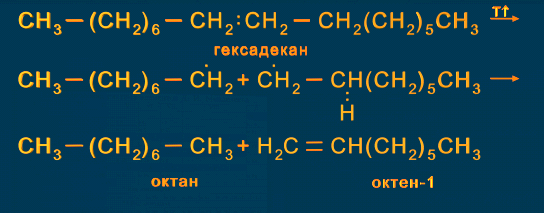
6) При каталитическом окислении низших алканов получается смесь
разнообразных кислородосодержащих веществ: спиртов, альдегидов, кислот.
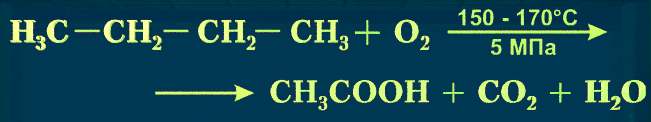
2CH4 +O2=2CH3OH
7) Реакции изомеризации характерны не для всех алканов. Обращается внимание на возможность превращения одних изомеров в другие, наличие катализаторов.
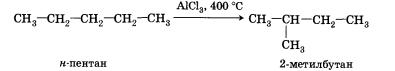
8)Ароматизация:
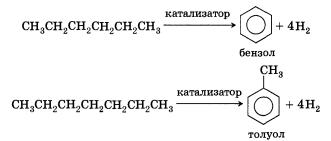
Следует указать, что метан и его гомологи не взаимодействуют в обычных условиях с кислотами и щелочами, окислителями и восстановителями.
6)Циклоалканы: состав, строение, свойства.
Общая формула молекул циклоалканов CnH2n - в молекуле на два атома
меньше, чем у соответствующих алканов, так как именно их удаление
позволило замкнуть углеродный цикл в молекуле алкана. Циклизация начинается с C3, названия образуются от Cn с префиксом цикло.
Перечислим несколько представителей циклоалканов:
Углеродные атомы в молекулах циклоалканов находятся в состоянии sp3-гибридизации. В молекулах алифатических углеводородов (с открытой углеродной цепью) все углы между связями (в том числе и связями C-C-C) тетраэдрические (109.50). В молекулах циклических углеводородов тетраэдрический угол в наибольшей степени искажен в молекулах циклопропана и циклобутана - это связано с большими энергетическими затратами и обуславливает их неустойчивость и повышенную химическую активность по сравнению с простыми алканами.
Наряду с изомерией подсоединенных к кольцу радикалов, возможна изомерия
положения заместителей в самом кольце (например, 1,1-диметилциклопропан и
1,2-диметилциклопропан) и пространственная изомерия (цис-, транс-изомерия), вызванная положением заместителей относительно плоскости кольца.
Названия циклоалканов и их физические свойства
Межмолекулярное взаимодействие между молекулами циклоалканов
несколько больше, чем у молекул алканов, поэтому первые имеют
несколько большие температуры плавления и кипения, чем последние.
Свойства
У циклопропана и циклобутана достаточно отчетливо выражена способность вступать в реакции присоединения:
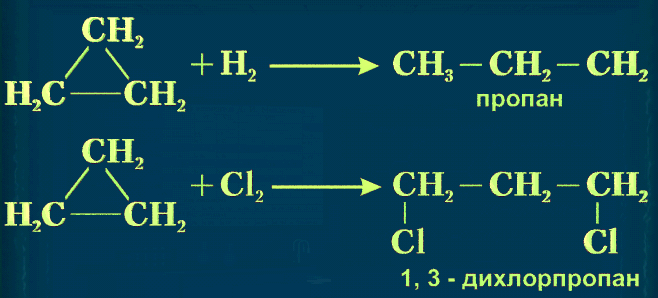
Для циклогексана реакции присоединения не характерны, а, как и для алканов, наблюдаются реакции замещения, окисления и дегидрирования.
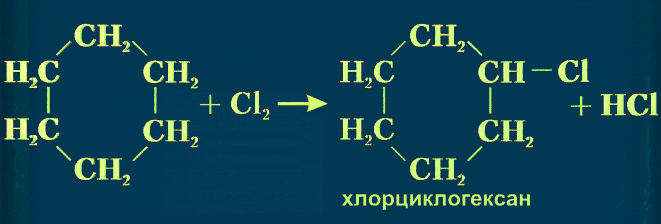
-
Применение алканов и их производных.
Некоторые алканы и циклоалканы, а также их простейшие производные находят применение в медицине.
Вазелин - состоит из углеводородов, содержащих более 20 атомов углерода в молекуле. Широко используется в фармацевтической практике как основа при приготовлении медицинских мазей.
Ц иклопропан - бесцветный газ
со сладковатым запахом. Используется в хирургии в качестве
средства для ингаляционного наркоза.
иклопропан - бесцветный газ
со сладковатым запахом. Используется в хирургии в качестве
средства для ингаляционного наркоза.
Хлороформ СНСl3 (трихлорметан) - бесцветная жидкость с характерным запахом. Используется в медицине для наркоза.
Йодоформ СНI3 (трийодметан) - твердое вещество, применяется как антисептическое перевязочное средство.
Перфторалканы - углеводороды, в которых все атомы водорода замещены на атомы фтора - эффективные газопереносящие среды, что позволяет использовать их в качестве искусственной крови.
Контрольные вопросы для закрепления:
-
Какой тип реакции характерен для алканов? Почему?
-
Что такое «галогенирование»? Приведите пример реакции хлорирования метана.
-
Что такое крекинг? Приведите примеры.
Рекомендуемая литература
- обязательная;
1. Габриелян О.С. Химия. 10 класс: Учебн для общеобразоват.учреждений/ О.С. Габриелян, Ф.Н. Маскаев, С.Ю. Пономарев, В.И. Теренин. - 5 изд., стереотип. - М.: Дрофа, 2004 гл.3,§ 11, с. 67-81
- дополнительная;
-
Ю.М. Ерохин. Химия. Учеб. для средн. проф. учеб. заведений. - 5-е изд., стер. - М.: Издательский дом «Академия», 2005. -384 с.
- электронные ресурсы.
1. Электронное приложение к учебнику. Химия. Органическая химия: учеб для 10 класса общеобразовательных учреждений/Г.Е. Рудзитис, Ф.Г. Фельдман. М.: Просвещение, 2008 г., диск
2. Мультимедиа учебный курс «1С: Образовательная коллекция. Органическая химия» для изучения химии в 10-11 классах: 1С и Лаборатории систем мультимедиа, МарГТУ, 2003