- Учителю
- Технологическая карта урока химии на тему Гидролиз солей (9 класс)
Технологическая карта урока химии на тему Гидролиз солей (9 класс)
Корчагина Ольга Николаевна, учитель химии и биологии
МБОУ ООШ с. Поддубровка Усманского района Липецкой области
Технологическая карта урока
Предмет: химия
Уровень образования: основное общее
Тема: «Гидролиз солей»
Тип урока: комбинированный.
Форма проведения урока: урок постановки и решения учебных проблем
Время проведения: 45 мин.
Участники: учащиеся 9 класса
Цель: развитие знаний учащихся о химических свойствах солей при знакомстве с гидролизом как процессом взаимодействия ионов соли с диполями воды.
Планируемый результат обучения, в том числе и формирование УУД:
Познавательные УУД: структурирование знаний о химических свойствах кислот, щелочей, солей с точки зрения ТЭД, типах гидролиза солей, постановка и формулирование проблемы, выдвижение гипотезы и её обоснование, построение логической цепочки рассуждений, анализ экспериментального определения реакции среды раствора соли индикаторами, умение делать выводы, классификация солей по составу образующих ионов, рефлексия способов и условий действия, контроль и оценка умений составлять уравнения гидролиза соли в молекулярном и ионном виде.
Коммуникативные УУД: планирование учебного сотрудничества с учителем и сверстниками, разрешение конфликтов - выявление, идентификация проблемы, поиск и оценка альтернативных способов разрешения конфликта, управление поведением партнёра в группе - контроль, коррекция, оценка его действий.
Регулятивные УУД: целеполагание, планирование, прогнозирование реакции раствора в зависимости от состава соли, подвергающейся гидролизу, контроль в форме сличения результата с эталоном, оценка - выделение и осознание учащимися того, что усвоено и что ещё нужно усвоить, осознание качества и уровня усвоения, оценка результатов работы.
Личностные УУД: личностное самоопределение, установление связи между целью учебной деятельности и её мотивом, оценивание усваиваемого содержания.
Основные понятия: гидролиз соли. Типы гидролиза солей. Универсальный индикатор. рН.
Межпредметные связи: география, биология
Ресурсы:
1. Аликберова Л.Ю. Полезная химия: задачи и истории / Л.Ю. Аликберова, Н.С. Рукк. - 2-е изд., стереотип. - М. : Дрофа, 2006. - 187, (5) с. : ил. - (Познавательно! Занимательно!)
-
Евстифеева А.Г. Пособие по подготовке к централизованному тестированию по химии. - Ростов н/Д/Д: Феникс, 2002. - 320 с.
-
Каверина А.А. Химия: 8-9 классы: тематические и итоговые контрольные работы: дидактические материалы / А.А. Каверина, А.С. Корощенко, А.В. Яшукова. - М. : Вентана-Граф, 2010. - 224 с. - (Аттестация: школа, учитель, ученик).
-
Кузнецова Н.Е., Титова И.М., Гара Н.Н., Жегин А.Ю. Химия: 9 класс: Учебник для учащихся общеобразовательных учреждений /Под ред. Н.Е. Кузнецовой. М.: Вентана-Граф, 2008.
5. Кузнецова Н.Е., Левкин А.Н. Задачник по химии для учащихся 9 класса общеобразовательных учреждений. М.: Вентана-Граф, 2010.
6. www.fcior.edu.ru Федеральный центр информационно-образовательных ресурсов
Оборудование: компьютер, мультимедийный проектор, презентация Power Point, таблица растворимости кислот, солей и оснований в воде, оборудование и реактивы для лабораторных опытов ( растворы NaOH, K2CO3, HCl, NaCl, AlCl3 , Na2CO3, Al2S3, индикаторы: универсальный, лакмус).
Технологическая карта урока
Содержание учебного материала.
Деятельность
учителя
Деятельность
обучающихся
ФОУД
Формирование УУД
I.
Определение потребностей и мотивов.
Приветствие учащихся.
Выполнение задания с целью выявления трёх консультантов. (Слайд 2)
Задание. Установите соответствие.
А. При растворении в воде 1. распадаются на ионы
вещества ___
Б. Диссоциация - это __ 2. направленное движение В.Под действием электри- 3. распад электролита на ионы
ческого тока ионы
приобретают ____ 4. ассоциация Г. Химические свойства 5. обладают ионной
веществ обусловлены___ проводимостью
Д.Антоним диссоциации___ 6 химической природой ионов Е. Электролиты ___
Каждой группе учащихся даётся одно из ключевых слов: «кислоты», «основания», «соли». Учащимся в группах необходимо кратко и лаконично отвечать на вопросы учителя и выполнять задания, относящиеся к ключевому слову.
Блиц-опрос. (Слайд 3)
1.Дайте определение кислот, щелочей, солей с точки зрения ТЭД.
2. Из предложенного списка веществ выбрать вещество в соответствии с ключевым словом и записать уравнение диссоциации данного вещества: NaOH, K2CO3, HCl .
3. С какими веществами реагирует выбранное вами вещество: CaO, H2SO4, CuCl2, SO3, KOH? Запишите уравнения реакций в молекулярном и ионном виде.
4. Проанализируйте краткие ионные уравнения реакций и ответьте на вопрос: присутствием каких ионов обусловлены химические свойства выбранного вещества? (Слайд 4)
- С помощью каких веществ можно определить реакцию среды растворов кислот и щелочей?
- Как изменяется окраска лакмуса в нейтральной, щелочной или кислой среде?
Проведение лабораторных опытов № 1:
Учащимся предлагается определить с помощью индикатора лакмуса, растворы каких из предложенных веществ - NaOH, K2CO3, HCl - находятся в пронумерованных пробирках №1-3.
Учитель объясняет, какие вещества находились в пробирках: №1 - HCl; №2 -NaOH; №3 - K2CO3. Возникает проблемная ситуация.
Предлагает сформулировать проблемный вопрос.
Слайд 5.
Учитель объясняет, что при растворении соли в воде происходит не только диссоциация, но и химическая реакция. Растворение в воде - физико-химический процесс.
Предлагает сформулировать тему урока.
Корректирует тему урока: «Гидролиз солей». (Слайд 6)
Настраиваются на восприятие материала.
Выполняют задание (письменно).
Разбиваются на 3 группы, за каждой из групп закрепляется консультант.
Систематизируют знания, записывают уравнения диссоциации веществ и уравнения реакций на доске, делают выводы. Консультанты корректируют ответы
Отвечают на вопросы.
Анализируют, делают выводы. После выполнения работы, один из участников группы озвучивает результаты и демонстрирует результат эксперимента классу: в пробирке №1 находится кислота, так как индикатор изменил окраску на красный цвет, а в пробирках №2 и №3 предполагает наличие щёлочи, так как цвет индикатора поменялся на синий. Раствор соли не обнаружен.
Формулируют проблемный вопрос: почему цвет индикатора изменяется не только в растворе кислоты и щелочи, но и в растворе соли? (Из уравнения диссоциации соли не видно, что образуется свободные ионы Н+ и ОН- которые изменяют окраску индикатора).
Затрудняются ответить.
Формулируют тему урока: «Взаимодействие солей с водой».
Фронтальная
Групповая
Групповая
Регулятивные:
-целеполагание;
- прогнозирование результата.
Познавательные:
- постановка и
формулирование проблемы;
- осознанное и произвольное построение речевого высказывания в устной и письменной форме;
- структурирование знаний;
-анализ объектов с целью выделения признаков.
Коммуникативные:
- сотрудничество с учителем и сверстниками;
- управление поведением партнёра - контроль, коррекция его действий;
- умение с достаточной полнотой и точностью выражать свои мысли;
- владение монологической и диалогической формами речи.
II.
Принятие учебных целей и условий их достижения.
Разъясняет: гидролиз (от греч. Hydro - вода, lysis - разложение) означает разложение веществ водой.
Все ли соли вступают в реакцию гидролиза?
Каким путём это можно определить?
Предлагает сформулировать гипотезу.
Объясняет: Для определения кислотности или щёлочности среды пользуются водородным показателем - рН. (слайд 8). Знакомит с универсальным индикатором и шкалой, где указан водородный показатель.
Если среда нейтральная, рН=7;
если рН > 7, то среда щелочная и при этом: [OH-] > [H+]; если рН < 7, то среда кислая и при этом : [H+] > [OH-].
Планируют: опытным путём с помощью индикаторов.
Формулируют гипотезу: если соль взаимодействует с водой, то раствор имеет определённую среду. (слайд 7)
Групповая
Личностные:
- установление связи между целью учебной деятельности
и её мотивом.
Регулятивные:
- целеполагание;
- планирование путей
достижения целей;
- предвосхищение результата
и уровня усвоения знаний.
Познавательные:
- выдвижение гипотезы.
III.
Проверка принятиой гипотезы, сбор данных, их анализ, формулирование выводов.
Проведение лабораторных опытов №2. Учащимся предлагается определить универсальным индикатором среду раствора следующих солей: NaCl, AlCl3 , Na2CO3, Al2S3.
Почему в растворах карбоната натрия и хлорида алюминия индикатор изменяет свою окраску, а в растворах хлорида натрия и сульфида алюминия -нет?
Отличаются ли соли по составу?
Объясняет: соль можно рассматривать как продукт взаимодействия кислоты и основания. В зависимости от вида кислоты и вида основания выделяют четыре типа солей:
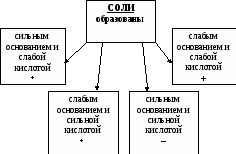
(слайд 9).
Задание .Дополните кластер формулами солей, использованных в лабораторном опыте.
Проверьте правильность ответов, пользуясь таблицей «Гидролиз солей» на стр. 48 учебника.
Формулирует задачи: научиться записывать уравнения гидролиза солей; по формулам прогнозировать результаты испытаний.
Гидролиз соли - это обратимое взаимодействие соли с водой, приводящее к образованию слабого электролита.
Предлагает составить алгоритм написания ионного и молекулярного уравнений гидролиза соли. (слайд 10)
1.Определите, к какой группе относится каждая из предложенных солей.
2.Запишите уравнения диссоциации каждой соли.
3.Запишите уравнение диссоциации воды.
4.Запишите уравнение взаимодействия слабого иона с водой.
5.Определите характер среды.
6.По ионному уравнению составьте молекулярное уравнение.
1) Предлагает записать уравнение гидролиза хлорида алюминия. (Слайд 11)
Обращает внимание учащихся на кластер: каков состав соли?
AlCl3→Al3+ + 3Cl-
НОН↔Н+ +ОН-
Al3+ + НОН ↔AlОН2+ + Н+ рН < 7, среда кислая, гидролиз
по катиону. Р-я обратима.
Al3+ + 3Cl- +НОН ↔AlОН2+ + Н+ + 3Cl-
AlCl3 + HOH ↔ AlOHCl2 + HCl
Уточняет тип гидролиза: по катиону, заостряет внимание на обратимости реакции.
2) Предлагает записать уравнение гидролиза карбоната натрия. (Слайд 12)
.
Na2CO3 ↔ 2Na+ + CO32-
НОН↔Н+ +ОН-
CO32- + НОН ↔ HCO3- + OH- рН > 7, среда щелочная,
гидролиз по аниону. Р-я обратима.
2Na+ + CO32 + НОН ↔ 2Na+ + HCO3- + OH-
Na2CO3+ НОН ↔ NaHCO3 + NaOH
Какой слабый ион связался с водой? Какой тип гидролиза?
3) Предлагает записать уравнение реакции гидролиза хлорида натрия. (Слайд 13)
NaCl↔ Na+ + Cl-
Гидролиз не протекает, рН=7, среда нейтральная
4) Полный гидролиз - соль образована слабым основанием и слабой кислотой.
Al2S3+6HOH→2Al(OH)3↓+3H2S↑ рН=7, среда нейтральная, гидролиз по катиону и аниону.
Гидролиз в данном случае идет необратимо, соль полностью разлагается водой. В этом случае в таблице растворимости в ячейке соответствующей соли стоит прочерк.
Физкультминутка .
Предлагает вернуться к гипотезе и аргументировать её.
Дополнить кластер (слайд 14):
Тип гидролиза

По катиону и аниону,
реакция среды зависит от степени диссоциации
образующихся продуктов
Сообщает: гидролиз имеет огромное значение:
- в природе (например, в химическом преобразовании земной коры),
- народном хозяйтсве (например, известкование почв, очистка воды),
- в жизни человека (стирка белья, приготовление пищи). Подробнее о значении гидролиза мы услышим на следующем уроке из ваших докладов.
Делают выводы о среде раствора соли: р-р AlCl3 имеет кислую среду, р-р Na2CO3 - щелочную среду, растворы Na2CO3 и Al2S3 нейтральны.
Предполагают, что Na2CO3 и Al2S3 не взаимодействуют с водой.
Отвечают на вопрос.
Классифицируют соли, использованные в лабораторных опытах №2. Работают с таблицей учебника, находя аналогичные примеры солей.
Записывают определение.
Высказывают свои мысли, при помощи учителя составляют алгоритм написания уравнений гидролиза и записывают алгоритм в тетради.
Отвечают: соль образована слабым основанием и сильной кислотой.
Записывают уравнения согласно алгоритму, 1 ученик воспроизводит записи на доске.
Делают вывод:
гидролиз по катиону приводит к образованию основных солей и ионов водорода (среда кислая)
Рассуждают: соль образована сильным основанием и слабой кислотой.
Записывают уравнения.
Делают вывод: гидролиз по аниону приводит к образованию кислых солей и ионов гидроксильной группы (среда щелочная).
Рассуждают: соль образована сильным основанием и сильной кислотой.
Делают вывод: соли, образованные сильным основанием и сильной кислотой, не подвер-гаются гидролизу, т.к. невозможно образование слабых электролитов.
Записывают уравнение.
Делают вывод: гидролиз идет до конца, т.е. до образования кислоты и основания.
Находят сульфид алюминия в таблице растворимости солей, кислот и оснований в воде.
Обобщают, делают выводы.
Заполняют кластер.
Слушают, приводят свои примеры.
Групповая.
Фронтальная
Групповая
Групповая.
Индивидуальная
Личностные:
- оценивание усваиваемого
содержания.
Регулятивные:
- прогнозирование результата;
- контроль в форме сличения результата действия с заданным эталоном,
- саморегуляция как способность к мобилизации сил и энергии к волевому услилию.
Познавательные:
- построение речевого
высказывания;
- построение логической
цепочки рассуждений;
- классификация объектов;
- создание алгоритма действий;
- обобщение понятий;
- умение делать выводы,
- анализ истинности утверждений.
Коммуникативные:
- сотрудничество с учителем и сверстниками;
- учёт мнения партнёра,
- контроль, коррекция и
оценка действий партнёра;
- аргументирование своей
точки зрения;
- умение высказать свои
мысли;
- владение диалогической и монологической формами речи.
IV.
Итоговый самоконтроль и самооценка.
Рефлексия.
1.Выполнить тест и провести самопроверку. Слайд 15.
Гидролиз солей (2).
files.school-collection.edu.ru/dlrstore/a806e911-f330-1f06-2c50-d04ec2b2e82b/00119986510038960.htm</</u>
Задание : записать уравнение гидролиза выбранной соли в молекулярном и ионном виде, определить тип гидролиза и среду раствора.
2. Укажите среду раствора соли:
1 - CuSO4, LiNO3, K2S
2 - Mg(NO3)2, LiCl, K2SiO3.
После взаимопроверки показывает правильные ответы - (слайд 16)
Составить синквейн (5 строк) для понятия « гидролиз».
Например:
1- гидролиз
2 - обратимый, необратимый
3 - протекает, не идёт
4- гидролиз - взаимодействие соли с водой
5 - разложение водой
Предлагает высказать мнение об уроке.
1.Я считаю, что прошедший урок был…
2.На уроке мне понравилось…
3.Меня удивило…
4. Мне осталось непонятным …
4.После урока у меня осталось…настроение.
Выставление отметок.
Задание на дом (слайд 18):
1) прочитайте стр. 47-49 учебника; приведите свои примеры солей, растворы которых будут иметь кислую, щелочную и нейтральную среду, и напишите к ним ионные уравнения гидролиза.
2) Подготовьте доклад на тему: «Значение гидролиза». Область применения гидролиза выберите самостоятельно:
-в промышленности,
-в быту,
-в медицине,
-в сельском хозяйстве,
- в природе и других направлениях и сферах деятельности человека.
3) подумайте и ответьте на вопросы:
- почему место ожога кислотой на коже обрабатывают 5%-ным раствором питьевой соды?
- цинковую пластинку поместили в раствор хлорида цинка. Через некоторое время наблюдали появление пузырьков газа. Какой это газ? Объясните произошедшее явление.
Выполняют тест.
Выполняют задание.
Выполняют задание, осуществляют взаимопроверку.
Работают, опираясь на правила составления синквейна (слайд 17).
Высказывают своё мнение об уроке.
Записывают задание, темы докладов, вопросы для размышления и обоснования.
Индивидуальная.
Парная.
Парная
Регулятивные:
-умение самостоятельно
контролировать своё время.
- контроль в форме сличения результата с эталоном;
-коррекция результата с учётом оценки товарищем,
- оценка - выделение и
осознание учащимися того, что усвоено и что ещё нужно усвоить, осознание качества
и уровня усвоения, оценка результатов работы.
Познавательные:
-структурирование знаний;
-построение рассуждений;
- умение делать выводы,
- рефлексия способов и условий действия.
Коммуникативные:
- умение высказать свои
мысли,
- управление поведением партнёра - коррекция и оценка его действий,
- умение с достаточной полнотой и точностью выражать свои мысли в соответствии с задачами и условиями коммуникации.