- Учителю
- Опорный конспект для подготовки к ЕГЭ Амины
Опорный конспект для подготовки к ЕГЭ Амины
А
 мины-производные
NH3, в молекуле которых 1 или 2 или все 3 атома Н
замещены у/в радикалом. C2H5 C2H5
мины-производные
NH3, в молекуле которых 1 или 2 или все 3 атома Н
замещены у/в радикалом. C2H5 C2H5
С

 Н3
NH2 C2H5 NH С2Н5 N
Н3
NH2 C2H5 NH С2Н5 N
Метиламин диэтиламин вторичный С2H5
Первичный триэтиламин третичный
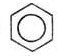 С6Н5
NH2
С6Н5
NH2
C-NH2
NH3
Фениламин аммиак
Анилин
Отличительной чертой электронного строения аминов является наличие у N неподеленной электронной пары, поэтому амины проявляют свойства оснований. Основные выражены сильнее, чем у NH3, R(+I) чем >R, тем сильнее основные свойства.
Бензольный R оттягивает электронную плотность от N основные свойства выражены слабее, чем у NH3.
1.Изомерия CH3-CH-CH2-CH3 CH3
| |
NH2 CH3-C-CH3
1. у/в скелета 2-аминобутан |
2. положение NH2 CH3-CH2-CH2-CH2-NH2 NH2 2-амино-2метилбутан
1-аминобутан
Первичные, вторичные, третичные амины - изомеры друг другу
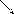 С3-Н7-NH2
C2H5 CH3
С3-Н7-NH2
C2H5 CH3


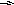 пропиламин
CH3NH СН3 N
пропиламин
CH3NH СН3 N
метилэтиламин СH3 триметиламин
ФИЗИЧЕСКИЕ СВ-ВА:
П
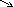 ростейшие -
(СН3-NH2 , CH3 CH3
ростейшие -
(СН3-NH2 , CH3 CH3


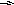 CH3 NH
СН3 N, газы
CH3 NH
СН3 N, газы
 СH3
СH3
C запахом NH3 , более сложные - Ж с З рыбы, растворимы в Н2О. Первичные и вторичные образуют водородные связи, поэтому t кип по сравнению с третичными аминами больше.
Анилин - маслянистая Ж, ограниченного р в Н2О. Высшие - Тв, З , в Н2О не растворимы.
ПОЛУЧЕНИЕ :
1. из галогенопроизводных С2Н5Br + NH2 C2H5NH3 + Br + NH4Br
C2H5NH3+Br + NaOH NaBr+C2H5NH2, бромид этиламмония
При взаимодействии первичного амина и галогенопроизводного и обработке щелочью получают вторичный амин:



 С2Н5Br+C2H5NH2
C2H5 NH2+Br + NaOH
C2H5 NH + NaBr
С2Н5Br+C2H5NH2
C2H5 NH2+Br + NaOH
C2H5 NH + NaBr
C2H5 C2H5
Повторение приводит к образованию третичного амина. Третичный амин может вступать с С2Н5Br с образованием четвертичной амминонийной соли

 C2H5
C2H5
C H3
H3
С
 Н3 N +
C2H5Br C2H5 - N -
C2H5 Br бромид тетраэтиламмония
Н3 N +
C2H5Br C2H5 - N -
C2H5 Br бромид тетраэтиламмония
CH3
C2H5
2. восстановление нитросоединений :
! R-NO2+3Zn+7HCl R-NH2-+3ZnCl2+2H2O
Реакция Зинина
C6H5-NO2+3(NH4)2S C6H5NH2 + 3S + 6NH3+ 2H2O
ХИМИЧЕСКИЕ СВ-ВА:
1. как основание - за счет неподеленной пары электронов образуются ковалентная связь по доноро-акцепторному механизму, выступая в роли донора.
А) с Н2О - щелочная среда
С2Н5-NH2+H2O C2H5 - NH3+ OH -
Б) с кислотами С2H5-NH2+H2SO4 (C2H5NH3)2SO4
В) Горят на воздухе с образованием СО2, Н2О, N2,
4СН3- NH2+9O2 4CO2 + 10H2O + 2N2