- Учителю
- Конспект урока по химии на тему Реакции ионного обмена (8 класс)
Конспект урока по химии на тему Реакции ионного обмена (8 класс)
Конспект урока на тему
«кислоты, щелочи и основания
как электролиты. реакции ионного обмена»
Элементы содержания: реакции ионного обмена; основные классы неорганических веществ.
Требования: уметь составлять уравнения реакций ионного обмена, определять возможность протекания реакций ионного обмена, объяснять сущность реакций ионного обмена.
Оборудование: растворы H2SO4, CuSO4, BaCl2, NaOH, Na2CO3, пробирки.
Ход урока
I. Проверка домашнего задания.
У доски:
- механизм диссоциации веществ с ионной и ковалентной связью (один учащийся);
- теория электролитической диссоциации, степень диссоциации (другой учащийся);
- упр. 4, 5 из домашнего задания (двое учащихся).
Экспресс-контроль: записать уравнения диссоциации:
Вариант II
Вариант III
Вариант IV
K3PO4
Na2CO3
Ca(NO3)2
FeCl3
KOH
Ca(OH)2
LiOH
Ba(OH)2
H2SO3
H2CO3
H2S
H3PO4
II. Объяснение нового материала.
- Итак, мы выяснили, что свойства электролитов определяются теми ионами, которые образовались при их диссоциации.
Какие же ионы образуются при диссоциации всех кислот?
Это ионы водорода и кислотного остатка:
![]()
Запишем определение:
Кислоты - это электролиты, при диссоциации которых образуются катионы водорода и анионы кислотного остатка.
Какие ионы образуются при диссоциации щелочей?
Катионы металла и гидроксид-анионы:
![]()
Щелочи - это электролиты, при диссоциации которых образуются катионы металла и гидроксид-анионы.
Составьте схему диссоциации соли и дайте определение солям как электролитам:
![]()
Электролиты могут взаимодействовать между собой, если при этом образуются неэлектролиты или слабые электролиты. Например, малорастворимые и практически нерастворимые вещества, летучие вещества (H2S), неустойчивые соединения (H2CO3 → H2O + CO2↑; H2SO3 → H2O + SO2↑; NH4OH → NH3↑ + H2O), вода.
Схема вещества
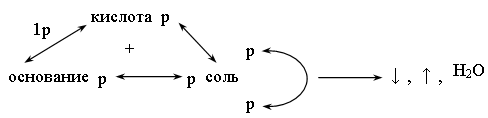
Эта схема показывает, что кислота может реагировать с основанием, если что-либо одно из них растворимо; растворимая кислота может реагировать с солью; соли между собой могут реагировать, если обе они растворимы; соль с основанием могут реагировать, если и соль, и основание растворимы. Реагируют в тех случаях, если образуются газ, осадок, вода.
В ходе этих реакций электролиты обмениваются своими составными частями - ионами, поэтому такие реакции называются реакциями ионного обмена.
Эти реакции можно составлять как в обычном, молекулярном виде, так и в ионном виде. Этому мы и должны поучиться.
Алгоритм
составления реакций ионного обмена
1. Записать исходные вещества. Подписать классы веществ.
2. Проверить, являются ли они электролитами (растворимыми) по таблице растворимости. По схеме определить, возможна ли такая реакция.
3. Если возможно, над ионами в исходных веществах проставить заряды (из таблицы растворимости).
4. Поменять первые части формул местами и записать таким образом продукты реакции.
5. Правильно составить формулы продуктов. Для этого поставить заряды ионов, снести их крест-накрест и сократить, если нужно.
6. Расставить коэффициенты в уравнении.
На этом заканчивается составление молекулярного уравнения.
7. Под формулами продуктов реакции подписать, являются ли они электролитами или неэлектролитами.
8. Записать электролиты в виде ионов с учетом индексов и коэффициентов; неэлектролиты оставить в молекулярном виде.
На этом заканчивается составление полного ионного уравнения.
9. В левой и правой части уравнения сократить одинаковые частицы.
10. Записать оставшиеся после сокращения ионы и молекулы.
Должно получиться сокращенное ионное уравнение.
Далее учитель демонстрирует опыты:
H2SO4 + Na2CO3
CuSO4 + NaOH
H2SO4 + NaOH (фенолфталеин)
BaCl2 + CuSO4
Для каждого случая составляются уравнения.
Например:
![]()
2. Электролит + электролит реакция возможна.
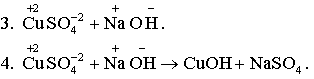
5. 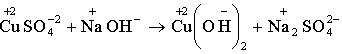 -
молекулярное уравнение.
-
молекулярное уравнение.
6. CuSO4 + 2NaOH → Cu(OH)2 + Na2SO4.
7. Электролит + электролит → неэлектролит + электролит.
8. ![]() -
полное ионное уравнение.
-
полное ионное уравнение.
![]()
10. Cu2+ + 2OH- → Cu(OH)2 - сокращенное ионное равнение.
В тетрадях у учеников должны быть записаны пункты 5, 8, 10.
Домашнее задание: § 36 (до конца), 37, упр. 1-3, 5.