- Учителю
- Основания, их классификация и свойства
Основания, их классификация и свойства
Тема. Основания, их классификация и свойства.
Цель урока: Сформировать представление об основаниях в свете ТЭД, как классе неорганических соединений.
Задачи урока.
Образовательные:
-
Познакомить учащихся с классом неорганических соединений - основания.
-
Составить опорный конспект: классификации и свойств оснований.
-
Изучить химические свойства оснований.
-
Выявить сходство и различие между различными группами оснований.
Воспитательные:
-
Продолжить формирование убеждения в познаваемости мира и убеждённости в том, что все природные явления имеют причинно - следственные связи.
-
Способствовать формированию добросовестного отношения к труду, дисциплинированности, аккуратности, культуре общения.
Развивающие:
-
Продолжить формирование умения классифицировать и обобщать и анализировать изучаемые факты и понятия; для развития речи - индивидуальные выступления; для развития познавательного интереса-дополнительный материал; для развития логического мышления-создание кластеров, заполнение опорного конспекта).
УУД.
Предметные: В ходе урока обучающиеся научатся классифицировать основания, усвоят знания о химических свойствах и получении оснований.
Метапредметные: Ребята закрепят экспериментальные навыки групповой работы и умения систематизировать информацию, логически мыслить.
Личностные: Продолжат дальнейшее развитие коммуникативных качеств.
Планируемые результаты.
Личностные УУД: самопознание, самоопределение.
Регулятивные УУД: целеполагание , прогнозирование - предвосхищение результата и уровня усвоения знаний, составление плана и последовательности действий, определение последовательности промежуточных целей с учётом конечного результата, контроль в форме сличения способа действия и его результата с заданным эталоном с целью обнаружения отклонений и отличий от эталона, оценка результатов работы, самоконтроль.
Коммуникативные УУД: умение выражать свои мысли в соответствии с задачами, инициативное сотрудничество при сборе информации, умение с достаточной полнотой и точностью выразить свои мысли, участвовать в коллективном обсуждении.
Познавательные УУД: строение логической цепочки рассуждения, подбор аргументации, структурирование знаний, определение основной и второстепенной информации, выбор наиболее эффективных способов решения практических задач.
Тип урока: комбинированный.
Форма обучения: индивидуальная, фронтальная, групповая.
Методы урока: словесные, наглядные, самостоятельные.
Оборудование: компьютер, презентация, шаблон опорного конспекта для индивидуальной работы учащихся.
Лабораторное оборудование на каждом столе: 7 пробирок, растворы индикаторов: фенолфталеина, лакмуса, метилового оранжевого; растворы: гидроксида кальция, сульфат меди (II), серная кислота, лабораторное стекло, держатель. Набор шаростержневых моделей атомов для составления моделей молекул.
Учебник. О.С. Габриелян Химия 8 класс
План урока.
-
Организационный момент - 1 мин.
-
Проверка домашнего задания - 4 мин.
-
Изучение нового материала - 25 мин.
-
Закрепление изученного материала -5 мин.
-
Рефлексия, подведение итогов урока и домашнее задание - 5 мин.
Ход урока
Организационный момент - 1 минута.
Учитель приветствует учеников, объясняет, что на уроке они будут составлять «Опорный конспект», который после проверки останется у них как подсказка. Начнем урок с загадки: «Капля воды попала на кусок и превратилась в кипяток». Объясните химическое явление.
Проверка домашнего задания - 4 минуты.
Актуализация знаний по теме: «Кислоты в свете ТЭД, их классификация и свойства».
Выполнение заданий №1 «Найдите ошибку» №2 «Установите соответствие»
Повторение понятий: кислоты, основность, химические свойства кислот, Т.Б. при проведении опытов.
Задание №1. Найдите ошибку (слайд 1)
1. Кислоты - это вещества кислые на вкус при диссоциации, которых образуются катионы водорода и кислотного остатка.
Ответ: Кислоты - это сложные вещества при диссоциации, которых образуются катионы водорода и анионы кислотного остатка.
2. Основность кислот определяется по количеству атомов водорода в кислоте, например:
Одноосновные: HCl, HI, H2SO4 HNO2
Двухосновные: H2CO3, H2SiO3, HNO3, H2S
Трехосновные: H3PO4, H2SO3
Задание №2 Установите соответствие между левой и правой частью уравнений химических реакций (слайд 2)
1. HCl + KOH
a. Zn(NO3)2 + H2O
2. 2HCl + Mg
b. BaSO4 + 2HCl
3. 2HNO3 + ZnO
c. MgCl2 + H2
4. H2SO4 + BaCl2
d. KCl + H2O
Ответ: 1-d 2-c 3-a 4- b
Изучение нового материала - 25 минут.
Целепологание.
Основой жизни на Земле является вода. Слово основание - однокоренное слово со словом основа. И наверно не случайно вода является основой для образования класса неорганических соединений - основания. Запишите тему урока (слайд 4), сформулируйте цель урока, заполните таблицу «Опасения-ожидания» в опорном конспекте.
Учитель предлагает нескольким ученикам озвучить цель урока и ожидания и опасения от урока.
Какие задачи нам нужно решить в ходе урока, чтобы изучить основания как класс неорганических соединений. Учитель после обсуждения записывает кратко на доске.
Задачи
-
Сформулировать определение «оснований» как электролитов
-
Классификация оснований
-
Получение оснований
-
Химические свойства оснований
Прочитайте абзацы 2,3 стр 215 сформулируйте определение оснований. Запишите в опорном конспекте.
Групповая работа с набором шаростержневых моделей атомов для моделирования молекул оснований с разным составом.
Задание. С помощью шаростержневых моделей атомов изобразите соединения: NaOH, Ca(OH)2, Fe(OH)3
После выполнения учитель открывает рисунок (слайд 6), чтобы все ученики проверили выполнение задания.
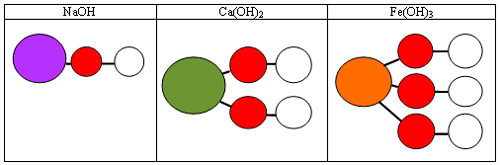
Подведение итогов работы на этом этапе.
Выполните задание №2 в опорных конспектах: Классификация оснований для этого рассмотрите схему и заполните её.
Учитель помогает, корректирует и проверяет выполнение задания, просит распределить формулы изготовленных шаростержневых моделей молекул оснований в данную схему.
В учебнике на стр 215 в таблице 11 представлен еще один тип классификации оснований. Какой? На каких свойствах он основан?
Подведение итогов работы на этом этапе.
Вывод: существует несколько классификаций оснований, сильные электролиты - это щелочи, все остальные - слабые основания.
Помните загадку в начале урока «Капля воды попала на кусок и превратилась в кипяток», чтобы дать ответ выполните задание №3. В опорных конспектах рассмотрите способы получения оснований, приведите примеры уравнений реакций.
Это задание повышенного уровня учитель проверит после сдачи опорного конспекта на проверку.
Подведение итогов работы на этом этапе. Согласны ли вы с выражением: «вода является основой для образования класса неорганических соединений - основания»?
Вывод: нерастворимые основания в отличие от растворимых получают перед проведением опытов. Кто может дать ответ на загадку? Посмотрите видеоролик: получение щелочей растворением активных металлов в воде.
Выполните задание №4 в опорном конспекте «Химические свойства оснований». Для этого проведите лабораторные опыты и заполните таблицу в опорном конспекте. Задание составить ионное уравнение реакции для тех, кто успеет сделать всю работу раньше остальных учеников.
Подведение итогов работы на этом этапе.
Вывод: растворимые и нерастворимые основания имеют разные свойства, но и те и другие реагируют с кислотами.
Закрепление изученного материала - 5 мин.
Для закрепления изученного учащиеся выполняют тест (слайды №8,9) ответы записывают в опорном конспекте. Тест:
1. Выберите формулы оснований:
а) SO3
б) Mg(OH)2
в) H2SO4
г) СаО
2. К каждому из ниже указанных веществ прибавили воду и фенолфталеин. В каких случаях появится малиновое окрашивание?
а) BaO
б) HNO3
в) CuO
г) КОН
3.Окраска индикаторов под действием раствора гидроксида калия меняется следующим образом:
а) лакмус краснеет
б) лакмус синеет
в) метилоранж краснеет
4. Диссоциации гидроксида бария соответствует уравнение:
а) Ba(ОН)2 = Ba+2 + ОН-2
б) Ba(ОН)2 = Ba+2 + 2ОН-
в) Ba(ОН)2 = BaОН- + H2O
Подведение итогов урока и обсуждение домашнего задания - 2 минуты
Рефлексия -3 минуты
Прочитайте цель и задачи урока, выполнили ли мы их? Желающие ученики озвучивают свои «ожидания и опасения» от урока.