- Учителю
- Разработка урока по химии в 9 классе на тему Амфотерные оксиды и гидроксиды
Разработка урока по химии в 9 классе на тему Амфотерные оксиды и гидроксиды
Открытый урок по химии для учащихся 9 класса:
« Амфотерные оксиды и гидроксиды»

Сведения об авторе:
Учитель химии
Лапина О.В.
Стаж работы 18 лет
с
Общеобразовательная цель:
-
формирование у учащихся представления о переходных элементах, амфотерных соединениях;
-
создание условий для выявления амфотерности соединений посредством решения экспериментальных задач;
-
отработка умений в написании уравнений реакций с участием амфотерных соединений.
Воспитательная цель: поддержание интереса к изучению темы через самостоятельную работу; воспитывать сотрудничество, способствовать развитию грамотной химической речи.
Развивающая цель: формирование исследовательских навыков учащихся при выполнении экспериментальной работы.
Тип урока: изучение нового материала
Методы обучения: частично-поисковый, исследовательский, репродуктивный.
Формы организации познавательной деятельности: групповая, общеклассная, индивидуальная
Оборудование: цинк Zn , хлорид цинка ZnCl2, гидроксид натрия NaOH, соляная кислота HCl, пробирки.
Структура урока:
-
Организационный этап.
-
Подготовительный этап (мотивация, актуализация знаний).
-
Основной этап (усвоение новых знаний и способов действий)
-
Закрепление и применение знаний.
-
Подведение итогов.
-
Домашнее задание.
1.Организационный этап.
Эпиграф « Ни одна наука не нуждается в эксперименте в такой степени, как химия.
А чтобы вы могли сравнить свои знания в начале и в конце урока, предлагаю определить свое место на «скале» (учитель раздает ученикам заранее приготовленные трафареты «скалы»).
</<img src="/prepod/_bloks/pic/dsfwslh-002.png" align="bottom" width="338" height="256" border="0" alt="Разработка урока по химии в 9 классе на тему Амфотерные оксиды и гидроксиды">
2. Подготовительный этап (мотивация, актуализация знаний).
Вопросы для актуализации знаний:
1. Заполните кластер «Классификация веществ» (Приложение 1)
«Почему остались пустые фрагменты в кластере?»Заполните схемы «Генетические ряды металлов и неметаллов». Вспомните, какой характер имеют оксиды и гидроксиды типичных металлов и неметаллов? (Приложение 2)
Как опытным путем доказать, что выданный вам оксид или гидроксид является:
а) основным; б) кислотным.
1 вариант задание
Экспериментально докажите кислотный характер серной кислоты.
2 вариант задание Экспериментально докажите основный характер гидроксида натрия.
Но прежде чем приступать к работе следует вспомнить правила обращения с химическими реактивами. Как следует вести себя в кабинете химии.
Вывод: что кислотные оксиды и гидроксиды (кислоты) взаимодействуют с основаниями с образованием соли и воды, но кислотные оксиды и гидроксиды не взаимодействуют с кислотами. Основные оксиды и гидроксиды (основания) взаимодействуют с кислотами, но не взаимодействуют с основаниями.
3. Основной этап (усвоение новых знаний и способов действий)
Внимательно посмотрите на предложенные объекты: амфитеатр, амфора, амфибии, склянки с твердыми веществами Zn(OH)2 и ZnO. Что объединят все эти объекты, и какое отношение они имеют к предложенным веществам?

амфитеатр - места для зрителей, расположенные полукругом на склонах холмов с двух сторон от артистов

амфора - древний глиняный сосуд для жидких и сыпучих продуктов, c двумя вертикальными ручками и узким горлом

амфибии - по-русски земноводные, живущие двоякой жизнью: и на суше, и в воде, и как животные, и как рыбы.
- В чем их сходство?Можно выделить
греческую частицу «амфо» или «амфи» - (что означает: с двух сторон; и то, и другое), все они обладают двойственностью.
-Правильно, они все обладают двойственностью. В химии она называется амфотерностью.
Амфотерность - (от греч. amphoteros и тот и другой). Получается, в химии это понятие применяется к веществам.
- Каким свойством обладает оксид и гидроксид цинка?
Выход на тему урока «Амфотерность оксидов и гидроксидов»
Постановка цели и задач урока . Мотивация учебной деятельности учащихся
Постановка учащимися цели урока как собственной учебной задачи.
Учащиеся ставят следующие цели: проверить данное предположение о существовании таких веществ с двойственными свойствами на примере Zn(OH)2 . Обращаем внимание учащихся на эпиграф урока.
Предлагаю учащимся выполнить практическую работу. Цель работы: получить амфотерный гидроксид и изучить его свойства.
Учащимся раздаются технологические карты которые они заполняют по ходу работы. На экране слайд «Технологическая карта»
Слайд Слайд
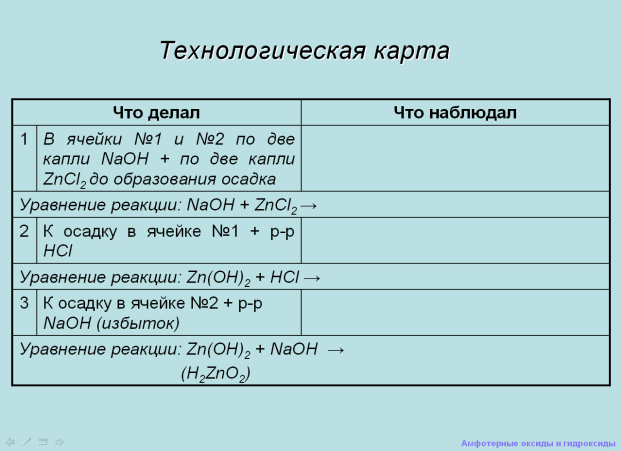

Учащиеся выполняют опыт «Получение гидроксида цинка».
Учащиеся на доске записывают уравнение реакции в молекулярной и ионной форме.
Учитель: Как проверить основный характер гидроксида цинка?
Учащиеся проводят опыт «Взаимодействие гидроксида алюминия с кислотами».
Учащиеся сообщают о результатах исследования, самостоятельно делают вывод и записывают на доске уравнение реакции в молекулярной и ионной форме.
Учитель:Как проверить кислотные свойства гидроксида алюминия?
Учащиеся проводят опыт « Взаимодействие гидроксида алюминия с щелочами». Учащиесясообщают о результатах исследования и самостоятельно делают вывод.
Учитель: Чтобы записать уравнение реакции гидроксида алюминия с щелочью, представим его в форме кислоты: Zn(OH)2 = H2AlO2. Учащиеся на доске записывают уравнение реакции в молекулярной и ионной форме.
Подтверждение гипотезы:
Учитель: Будет цинк типичным металлом? (Ответы учащихся). Учитель. Предлагаю учащимся сформулировать определение амфотерных (оксидов) гидроксидов. Привести примеры.
-
ответы учащихся: амфотерные (оксиды) гидроксиды - вещества, которые в зависимости от условий проявляют кислотные или основные свойства.
-
амфотерные оксиды: Al2O3, ZnO, BeO
-
амфотерные гидроксиды: Al(OH)3, Zn(OH)2, Be(OH)2,
Учащиеся записывают определения: а) Амфотерные вещества, б) Переходные элементы.
Учитель знакомит учащихся с другими переходными элементами, которые образуют амфотерные соединения.
Помимо цинка и алюминия амфотерные оксиды и гидроксиды имеют многие металлы побочных под-
групп, которые называются переходными.
В школьном мы курсе мы будем встречаться с
соединениями Be, Al, Zn, Cr+3.
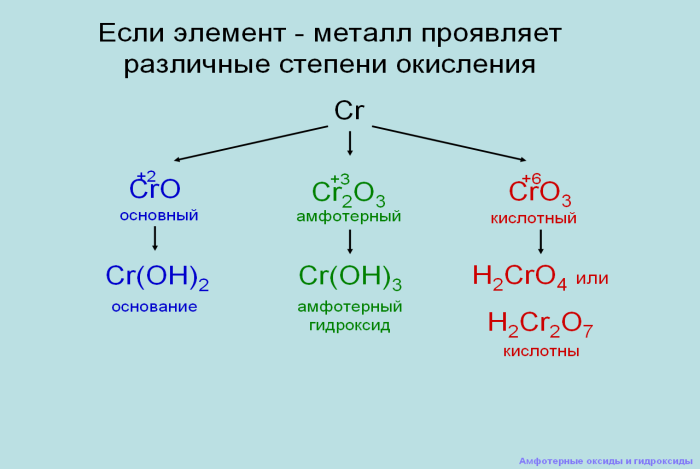
Почему хром, именно вс.о. +3 амфотерен?
Это вы поймете из схемы:
Дополнения учителя: если элемент металл проявляет различные степени окисления (демонстрация слайда)
Слайд
4. Закрепление новых знаний. Какие соединения называются амфотерными?
-
Как пользуясь ПСХЭ Д.И. Менделеева определить переходный элемент?
-
Какую степень окисления имеет металл в амфотерных соединениях?
-
Как опытным путем доказать амфотерный характер оксида и гидроксида?
5. Подведение итогов урока.
6. Домашнее задание. Параграф -2
Подсказка!
Кислоты, вещества, основные, металлы, сложные, основания, соли,
кислотные, щёлочи, неметаллы, бескислородные, нерастворимые,
кислородосодержащие, простые, оксиды.
|
Металлы |
|
Неметаллы |
|
Оксиды |
|
Основания |
|
Кислоты |
|
Соли |
-
Кислотные
Щёлочи
Нераство-
римые
Кислородо-
содержащие
-
Бескислород-
ные
Слайд № 3 « Генетические ряды металлов и неметаллов»
МЕТАЛЛ ОКСИД ГИДРОКСИД ХАРАКТЕР
__________ ______________
Na __________ ______________ ______________
НЕМЕТАЛЛ ОКСИД ГИДРОКСИД ХАРАКТЕР
__________ _______________
S __________ ______________ _____________