- Учителю
- Контрольная работа №1 по темам «Окислительно- восстановительные реакции», «Скорость химических реакций», «Электролитическая диссоциация»
Контрольная работа №1 по темам «Окислительно- восстановительные реакции», «Скорость химических реакций», «Электролитическая диссоциация»
|
Контрольная работа №1 по темам «Окислительно- восстановительные реакции», «Скорость химических реакций», «Электролитическая диссоциация» вариант 1 |
Контрольная работа №1 по темам «Окислительно- восстановительные реакции», «Скорость химических реакций», «Электролитическая диссоциация» вариант 2 |
Контрольная работа №1 по темам «Окислительно- восстановительные реакции», «Скорость химических реакций», «Электролитическая диссоциация» вариант 3* |
|
1. Расставьте коэффициенты в окислительно - восстановительной реакции, , укажите окислитель и восстановитель в данной реакции S
2. Определите количество теплоты, которое выделится при образовании 120 г MgO в результате реакции горения магния, с помощью термохимического уравнения. 2 Mq + O2 = 2MqO + 1204 кДж
3. В какую сторону сместится химическое равновесие 1)при повышении температуры, 2) увеличении концентрации азота в системе
4. Определите возможность протекания реакций и для возможных составьте молекулярные, полные ионные и сокращённые ионные уравнения. А) FeCl2 и KOH, Б) HCl и Na2CO3 5. Запишите формулы солей и определите характер среды в растворах следующих солей: хлорид меди, нитрат калия, сульфат ртути, сульфит натрия, бромид натрия 6. К раствору силиката калия массой 20,53 г и массовой долей 15% прилили избыток раствора нитрата кальция. Вычислите массу образовавшегося осадка.
|
1. Расставьте степени окисления элементов, укажите окислитель и восстановитель в данной реакции, расставьте коэффициенты методом электронного баланса S
2. В результате реакции, термохимическое уравнение которой 2 C2H2+ 5O2 = 4CO2 +2H2O + 2610 кДж выделилось 652,5 кДж теплоты. Определите массу сгоревшего ацетилена.
3. В какую сторону сместится химическое равновесие 1)при понижении температуры, 2) увеличении концентрации аммиака в системе
4. Определите возможность протекания реакций и для возможных составьте молекулярные, полные ионные и сокращённые ионные уравнения. А) NaCl и AgNO3, Б) BaCl2 и Na2SO4 5. Запишите формулы солей и определите характер среды в растворах следующих солей: хлорид лития, нитрит калия, сульфат меди, сульфид натрия, бромид кальция. 6. К раствору сульфата алюминия массой 68,4 г и массовой долей 8% прилили избыток раствора хлорида бария. Вычислите массу образовавшегося осадка. |
1. Определите степень окисления данных элементов в уравнении, укажите окислитель и восстановитель и расставьте коэффициенты методом электронного баланса. A
2. Тепловой эффект реакции горения серы равен 297 кДж. Какая масса серы сгорела, если выделилось 742,5 кДж теплоты.
3. В какую сторону сместится химическое равновесие 1)при понижении температуры, 2) увеличении концентрации серы в системе
4 Б Составьте уравнения реакций, согласно схеме в молекулярном и ионном виде.
5. Запишите формулы солей и определите характер среды в растворах следующих солей: сульфат ртути, сульфит натрия, бромид бария, хлорид меди, нитрит калия. 6. Вычислите объём газа (н. у.), который выделится при действии избытка сульфида железа(II) на 490 г 10%-ного раствора серной кислоты |
1 .
Расставьте степени окисления элементов, укажите окислитель и
восстановитель в данной реакции. P + H2O
H3PO3 + PH3
.
Расставьте степени окисления элементов, укажите окислитель и
восстановитель в данной реакции. P + H2O
H3PO3 + PH3
2. По термохимическому уравнению
H2+ Cl2 = 2HCl + 184,36 кДж рассчитайте, какой объем затрачен на образование хлороводорода (при н.у.), если при этом выделилось 921,8 кДж теплоты.
3. В какую сторону сместится химическое равновесие 1)при повышении температуры, 2) увеличении концентрации углекислого газа в системе
![]() -Q
-Q
4. Определите возможность протекания реакций и для возможных составьте молекулярные, полные ионные и сокращённые ионные уравнения А) HCl и KOH, Б) CuSO4 и Na2CO3
5. Запишите формулы солей и определите характер среды в растворах следующих солей: сульфат калия, сульфит лития, иодид бария, хлорид ртути, карбонат калия
6. Через 40 г раствора с массовой долей гидроксида натрия 8% пропустили сернистый газ. При этом образовался сульфит натрия. Вычислите объём (н. у.) вступившего в реакцию газа.
1. Расставьте степени окисления элементов, укажите окислитель и восстановитель в данной реакции.
F eCl2+
Cl2 FeCl3
eCl2+
Cl2 FeCl3
2. Какой объем кислорода (при н.у.) выделится в результате реакции, термохимическое уравнение которой 2KClO3 = 2KCl + 3O2 - 91 кДж,
если на разложение бертолетовой соли было затрачено 182 кДж теплоты.
3. В какую сторону сместится химическое равновесие 1)при повышении температуры, 2) уменьшении концентрации хлора в системе
H2+ Cl2 = 2HCl +Q
4. Напишите молекулярные и ионные уравнения, соответствующие сокращённым.
А )CO3
2-+Ca2+= CaCO3
)CO3
2-+Ca2+= CaCO3
Б )Ba2+
+ SO42- = BaSO4
)Ba2+
+ SO42- = BaSO4
5. Запишите формулы солей и определите характер среды в растворах следующих солей: сульфат натрия, сульфид калия, хлорид бария, хлорид меди, фосфат калия.
6. Раствор соляной кислоты массой 116,8 г и массовой долей 10% добавили к избытку сульфида магния. Вычислите объём (н. у.) выделившегося газа.
1.Определите степень окисления данных элементов в уравнении, укажите окислитель и восстановитель и расставьте коэффициенты методом электронного баланса.
-
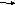 HNO3+
H2S S + NO2 + H2O
HNO3+
H2S S + NO2 + H2O
2. Определите количество теплоты, которое расходуется на разложение 110,5 г малахита. Термохимическое уравнение разложения малахита (CuOH)2 CO3 = 2CuO + H 2 O + CO 2 - 47 кДж
3. В какую сторону сместится химическое равновесие 1)при понижении температуры, 2) увеличении концентрации ацетилена в системе
2 C2H2+ 5O2 = 4CO2 +2H2O + Q
4. Напишите молекулярные и ионные уравнения, соответствующие сокращённым.
А)CO3 2-+2H+= H2O + CO2
Б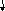 )Fe3+
+ 3OH- = Fe(OH)3
)Fe3+
+ 3OH- = Fe(OH)3
5. Запишите формулы солей и определите характер среды в растворах следующих солей: сульфат кобальта , сульфит калия, бромид кальция, хлорид цинка, нитрат железа.
6. К раствору карбоната калия массой 110,4 г и массовой долей 5% прилили избыток раствора нитрата кальция. Вычислите массу образовавшегося осадка
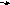 O2+
H2S S + H2O
O2+
H2S S + H2O