- Учителю
- Урок химии на тему Коррозия металлов
Урок химии на тему Коррозия металлов
|
Тема: Коррозия металлов. Способы защиты металлов от коррозии.. | |||
|
Цель урока: изучить сущность процесса коррозии металлов и способы защиты от коррозии; научить использовать приобретённые знания для объяснения явлений окружающей среды; развивать умения наблюдать, сравнивать, обобщать, делать самостоятельные выводы, работать с учебником; развивать познавательный интерес к предмету, используя межпредметные связи;
| |||
|
|
Деятельность учителя |
Деятельность обучающихся |
наглядности |
|
3 мин. |
I. Организационный момент. Приветствует учеников, проверяет готовность к уроку, желает успеха. |
Ученики осмысливают поставленную цель. |
|
|
5 мин. |
II. Проверка домашней работы. С помощью метода «Ромашка Блума» осуществляет проверку домашней работы.
|
Ученики отвечают на разноуровневые вопросы. |
Ромашка Блума |
|
20 мин. |
III. Актуализация знаний по методу «Кластер»
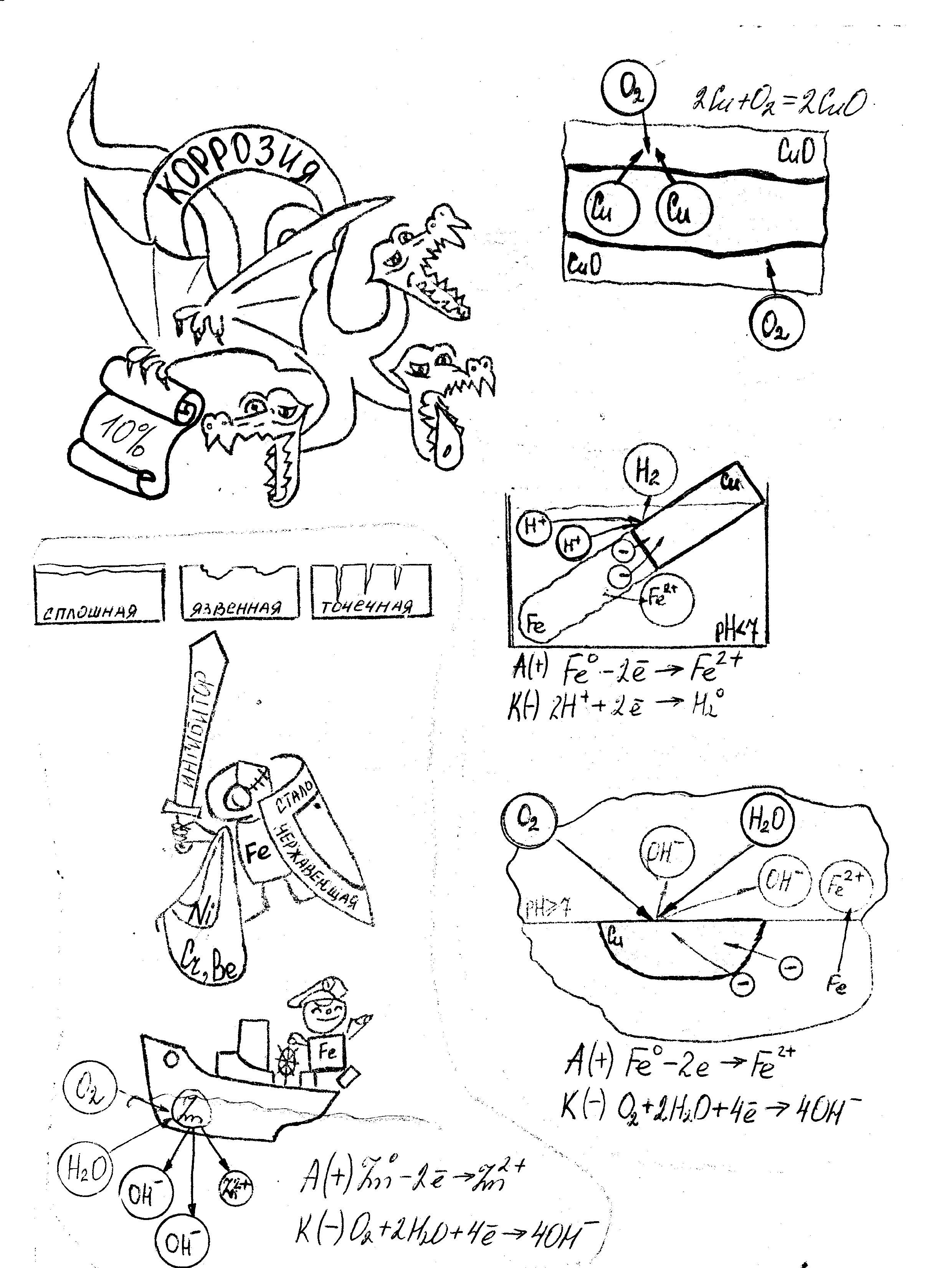
Виды коррозии
вос-ль Сu0 - 2e→ Cu2+ /2/ окисление ок-ль O20+4e→2O2-/1/ восстановление Вывод: кислород оказывает огромное влияние на процесс коррозии, являясь одним из наиболее агрессивных ее факторов.
Учитель вспоминает еще раз о разрушении Эйфелевой башни, она ржавеет и разрушается. Это сложный процесс, который включает несколько стадий. Суммарно оно выглядит следующим образом: 4Fe + 6H2O(влага) + 3O2(воздух) → 4Fe(OH)3 (учащиеся самостоятельно рассматривают окислительно - восстановительые процессы, делают выводы). Однако химически чистое железо почти не
корродирует. Техническое железо, содержащее различные
примеси, например, в чугунах и сталях, ржавеет. Если на
контакт двух металлов (железо и медь) попадает раствор
электролита, например, соляная кислота, то образуется
гальванический элемент, и начинается
окислительно-восстановительная реакция. В результате реакции
более активный металл (железо) окисляется и переходит в
раствор, а ионы водорода восстанавливаются на менее активном
металле (меди): в-ль Fe0 - 2e →Fe 2+ (ок-ие) ок-ль 2H+ + 2e → H2 (вос-ие)
Способы защиты металлов от коррозии. Далее учитель рассказывает о том, что еще в Древнем Египте было замечено, что латунные изделия (сплав меди и цинка) со временем покрываются слоем губчатой меди, а цинк окисляется. В средние века было рассмотрено отбеливание монет из сплава меди с серебром в растворе винного камня, при этом медь растворялась, а на поверхности монеты оставалось серебро. 1.Защитные поверхностные покрытия: а) металлическое (цинк, олово, никель, свинец) б) неметаллические (лаки, краски, эмали…) 2.Создание сплавов с антикоррозионными свойствами - легирование металлов (никель, кобальт, хром, вольфрам…) 3. Введение ингибиторов 4. Протекторная защита
Самостоятельная работа для группы . 1 группа
2 группа
3 группа
4 группа
| ||
|
10 мин. |
IV. Закрепление урока. Работа в парах по методике «Кластер» Что вы поняли по данной теме?
|
Ученики обсуждают между собой, отвечают на вопросы своих одноклассников. |
|
|
5 мин. |
V. Итог урока. Этап рефлексии: Стратегия «Телеграмма» - Что тебе понравилось на уроке? - Что не понравилось? - Насколько трудным был урок? Кратко написать самое важное, что уяснил с урока с пожеланиями соседу по парте и отправить. |
Оценивают работу своих одноклассников, пишут телеграммы. |
фишки
стикеры |
|
2 мин. |
VI. Домашнее задание. Объясняет особенности выполнения домашней работы. |
Записывают домашнюю работу в дневниках. |
|