- Учителю
- Урок по химии 9 класс на тему Алюминий
Урок по химии 9 класс на тему Алюминий
Рудницкая Любовь Борисовна
Учитель химии
КГУ «Многоцветенская ОШ»
Тайыншинский район
СКО
Урок химии 9 класс Тема: «Алюминий»
Цели:
-
Дать представление о строении атома алюминия на основании его положения в ПСХЭ, о физических и химических свойствах простого вещества алюминия и его нахождении в природе
-
Обобщить знания учащихся о применении алюминия, его соединений и сплавов в народном хозяйстве
-
Обсудить значение алюминия в организме человека
Ход урока
-
Организационный момент
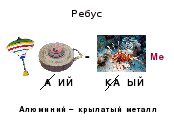
Из глины я обыкновенной,
Но я на редкость современный.
Я не боюсь электротока,
Бесстрашно в воздухе лечу;
Служу на кухне я без срока-
Мне все задачи по плечу.
Горжусь своим я именем:
Зовусь я ………
Отгадайте ребус и ли загадку, о каком элементе сегодня пойдет речь?
2. Введение в новую тему
Современную жизнь невозможно представить без алюминия. Этот блестящий легкий металл, прекрасный проводник электричества, получил в последние десятилетия самое широкое применение в различных отраслях производства. Между тем известно, что в свободном виде алюминий не встречается в природе, и вплоть до XIX века наука даже не знала о его существовании. Только в последней четверти прошлого столетия была разрешена проблема промышленного производства металлического алюминия в свободном виде. Это стало одним из крупнейших завоеваний науки и техники этого периода, значение которого мы, может быть, еще не оценили до конца.
3. Изучение нового материала
-
Строение атома алюминия
Вопрос: Дайте характеристику химического элемента алюминия по его положению в ПСХЭ
Ответ:
Порядковый номер - 13. Это означает, что в состав атома алюминия входят 13 электронов и 13 протонов (заряд ядра +13). Относительная атомная масса алюминия - 27, следовательно, в состав ядра входят 14 протонов (27-13=14).
Как и положено элементу 3-го периода, атомы алюминия имеют три энергетических уровня. На последнем уровне атомы алюминия содержат три электрона. Следовательно, распределение электронов по уровням в атомах алюминия таково: 13Al 2e-, 8e-, 3e-.
Вопрос: Какие свойства (окислительные или восстановительные) проявляют атомы алюминия?
Ответ: Подобно всем металлам, атомы алюминия проявляют восстановительные свойства.
Вопрос: Какую степень окисления при этом будет проявлять алюминий?
Ответ: +3
Задание: Дополните предложение:
1 Алюминий - элемент главной подгруппы ____ группы и ____ периода ПСХЭ
Д.И. Менделеева.
2.Так как у атома алюминия на внешнем уровне ____ электрона, то алюминий в соединениях проявляет степень окисления______ .
3. Так как атом алюминия находится в ______ периоде, то число энергетических уровней равно ____.
-
Нахождение алюминия в природе
По содержанию в земной коре алюминий занимает первое место среди металлов и третье среди других элементов (после кислорода и кремния). Земная кора на 8,8% состоит из алюминия. Однако этот химически активный металл не может существовать в свободном состоянии и встречается только в виде различных и очень разнообразных по своему составу соединений.
Задание: Из текста выпишите природные соединения алюминия:
Что может быть обыкновеннее глины? Красная глина речного обрыва, коричневая глинистая грязь проселочной дороги, белая или синеватая глина, которая неожиданно оказывается на лопате, когда копают глубокую яму или колодец…
В составе этого, на первый взгляд ни чем ни не примечательного минерала, кроме оксида натрия и диоксид кремния , содержится оксид алюминия. Поэтому глину относят к классу минералов -алюмосиликатов. Кроме минерала каолина Al2O3×2SiO2 × 2H2O, полевого шпата K2O×Al2O3×6SiO2 есть и чисто «алюминиевые» минералы. Это боксит - Al2O3 • H2O и корунд Аl2О3. Драгоценные разновидности очень твердого природного корунда ( оксида алюминия), окрашенные примесями- Al2O3 (рубин- красные, сапфир- синие.)
Лабораторная работа «Ознакомление с образцами природных соединений алюминия»
3) История открытия и получения алюминия
(сообщение учащегося)
В 1807 году английский химик Гэмфри Дэви открыл вещество под названием "alum" ("квасцы"), которое представляло собой соль неизвестного металла, этот металл был назван им "алюмиум". Позднее, это название было преобразовано в "aluminium" ("алюминий"). Дэви безуспешно пытался выделить этот металл с помощью электролиза (вещество практически не растворялось в воде).
В 1825 году датскому физику Эрстеду удалось выделить алюминий, как отдельный элемент. Вначале он пропустил газообразный хлор через слой раскаленного оксида алюминия , смешанного с углем. И выделил хлорид алюминия без малейших следов влаги. Чтобы восстановить металлический алюминий Эрстеду понадобилось обработать хлорид алюминия амальгамой калия .
В 1845 Немецкий учёный Фридрих Вёлер году провёл обширные исследования по изучению свойств алюминия, одно из которых была его необычайная лёгкость. Также он использовал новый способ получения алюминия, заменив амальгаму калия чистым калием. AlCl3 + 3K = 3KCl + Al
В 1886 году Поль Эру во Франции и Чарльз Холл из Огайо одновременно изобрели способ получения алюминия с помощью электролитического метода. Оба этих учёных родились в 1863 году и умерли в 1914 году в возрасте 51 года. Согласно этому методу расплаву подвергался не сам Al2O3, а его раствор в расплавленном криолите Na3AlF6. Данный процесс проводится в электрических печах при температуре 960°C. Способ, изобретённый двумя этими выдающимися учёными, используется и до сих пор.
Р еакция:
2Al2O3Na3AlF6,
ток 4Al + 3O2
еакция:
2Al2O3Na3AlF6,
ток 4Al + 3O2
Задание: Подумайте и ответьте: Почему большие алюминиевые заводы во всем мире стараются строить вблизи крупных гидроэлектростанций?
4) Физические свойства алюминия и его применение
Задание:1) Рассмотрите образцы алюминия и дайте характеристику его физическим свойствам
2) Как человек использует физические свойства алюминия? Запишите ответ в свой опорный конспект
Проверка записей(лёгкость, податливость штамповке, коррозионная стойкость, нетоксичен, высокая теплопроводность, электропроводность)
5) Сплавы алюминия ( сообщение учащегося)
Основной недостаток алюминия как конструкционного материала - малая прочность, поэтому обычно используют не чистый алюминий, а разные сплавы на его основе.
1) Алюминиево-магниевые сплавы обладают высокой коррозионной стойкостью и хорошо свариваются; из них делают, например, корпуса быстроходных судов.
2) Алюминиево-кремниевые сплавы (силумины) лучше всего подходят для литья. Из них часто отливают корпуса разных механизмов.
3) Алюминиево-медные сплавы (в частности, дюралюминий) можно подвергать термообработке, что намного повышает их прочность. К сожалению, термообработанные материалы нельзя сваривать, поэтому детали самолётов до сих пор соединяют заклёпками. Сплав с бо́льшим содержанием меди по цвету внешне очень похож на золото, и его иногда применяют для имитации последнего.
Дуралюмин, или просто "дюраль"; название происходит от немецкого города Дюрена)- Кельты называли его Дурум (Durum), что в переводе означает «замок, крепость». Этот сплав после закалки приобретает особую твёрдость и становится примерно в 7 раз прочнее чистого алюминия. В то же время он почти втрое легче железа. Его получают, сплавляя алюминий с небольшими добавками меди, магния, марганца, кремния и железа.
6) Химические свойства алюминия
Легко реагирует с простыми веществами:
1) с кислородом:
4Al + 3O2 = 2Al2O3 (демонстрация горения бенгальских огней)
2) с галогенами:
2Al + 3Br2 = 2AlBr3 (демонстрация видеоролика)
Задание На стр. 69 учебника вы найдёте записи взаимодействия алюминия с бромом, серой и углеродом. Дополнительное домашнее задание: рассмотрите эти реакции с точки зрения окислительно-восстановительных реакций.
Со сложными веществами:
3) восстанавливает металлы из их оксидов (алюминотермия)(демонстрация видеоролика):
8Al + 3Fe3O4 = 4Al2O3 + 9Fe
При нормальных условиях алюминий покрыт тонкой и прочной оксидной плёнкой. Благодаря этому алюминий практически не подвержен коррозии и потому широко востребован современной индустрией. Демонстрация оксидной плёнки алюминия
4) с водой (после удаления защитной оксидной пленки (демонстрация видеоролика)):
2Al + 6H2O = 2Al(OH)3 + 3H2
Самопроверка записи химических уравнений
5) со щелочами (с образованием тетрагидроксоалюминатов и других алюминатов):
(демонстрация видеоролика)
2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2 или
2(NaOH•H2O) + 2Al = 2NaAlO2 + 3H2
6) Легко растворяется в соляной и разбавленной серной кислотах (Лабораторная работа):
2Al + 6HCl = 2AlCl3 + 3H2 2Al + 3H2SO4(разб) = Al2(SO4)3 + 3H2
А вот концентрированные серная и азотная кислоты пассивируют алюминий, образуя на поверхности металла плотную, прочную оксидную плёнку, которая препятствует дальнейшему протеканию реакции. Поэтому эти кислоты перевозят в алюминиевых цистернах
Вывод об амфотерности алюминия.
Гидроксид и кислота
Растворят металл всегда.
Потому любой уверен -
Алюминий амфотерен
7) Применение алюминия и его соединений (обобщение знаний, проверка записей конспекта)
Игра: выберите предметы, сделанные из алюминия и объясните какие свойства использовал человек при их изготовлении
-
конструкционный материал (лёгкость, податливость штамповке, коррозионная стойкость);
-
производство кухонной посуды, алюминиевой фольги (нетоксичен, высокая теплопроводность);
-
изготовление проводов (лёгкость, электропроводность). Электропроводность алюминия всего в 1,7 раза меньше, чем у меди, при этом алюминий приблизительно в 2 раза дешевле. Правда, у алюминия как электротехнического материала есть неприятное свойство - из-за прочной оксидной плёнки его тяжело паять;
-
изготовления зеркал (высокий коэффициент отражения в сочетании с дешевизной и лёгкостью напыления);
-
ювелирные изделия (когда алюминий был очень дорог, из него делали разнообразные ювелирные изделия. Мода на них сразу прошла, когда появились новые технологии его получения, во много раз снизившие себестоимость. Сейчас алюминий иногда используют в производстве бижутерии);
-
алюминий зарегистрирован в качестве пищевой добавки Е173 (группа красителей);
-
высокоэффективное ракетное горючее;
-
краска «серебрянка» (блеск в порошке);
-
восстанавливает металлы из их оксидов (алюминотермия);
-
</ хлорид алюминия AlCl3 применяют в качестве катализатора (?) в производстве очень многих органических веществ
8) Алюминий в организме человека (сообщение учащегося)
-
В организм человека ежесуточно поступает от 5 до 50 мг алюминия
-
При горячей обработке пищевых продуктов за счёт использования алюминиевой посуды, происходит загрязнение пищи этим металлом
-
Алюминий также поступает в организм с пищей, питьевой водой, через лёгкие, с лекарственными препаратами, дезодорантами
-
Депонируется в костях, печени, лёгких и сером веществе головного мозга
-
С возрастом содержание алюминия в лёгких и головном мозге увеличивается
Внимание! Опасность! В больших концентрациях алюминий отрицательно действует на нервную систему и может вызвать судороги, снижение или потерю памяти, способствует развитию старческого атеросклероза, у детей замедляется развитие, поражается желудок, кишечник. В этом случае помогут крапива, хвощ полевой, препараты, содержащие янтарную кислоту.
Памятка: «Алюминий является постоянной составной частью клеток. В небольших количествах он необходим человеку, но в случае избытка этот металл может представлять серьёзную опасность для здоровья. Алюминий попадает в организм с пищей, водой, дезодорантами, из алюминиевой посуды. Поэтому хранить и готовить в такой посуде молочные блюда, щи, компоты, солёную рыбу, маринованные овощи и грибы, квашеную капусту нельзя, так как в кислой среде алюминий постепенно растворяется и частично переходит в продукты».
4. Закрепление полученных знаний
1) Тест с взаимопроверкой «Какие утверждения верны?»
1. Алюминий встречается в природе только в виде соединений (+)
2. Силумин - сплав алюминия с серой (-)
3. Атомы алюминия проявляют восстановительные свойства (+)
4. Алюминий плохо проводит электричество (-)
5. Алюминий может реагировать как с кислотами, так и со щелочами (+)
6. В случае избытка алюминий может представлять серьёзную опасность для здоровья (+)
7. Мировое производство алюминия постоянно уменьшается (-)
5. Домашнее задание
Обязательное: § 13 стр. 68-74, ? 1, 4 стр. 75, закончите конспект урока
Дополнительное: 1) Запишите уравнения химических реакций взаимодействия алюминия с бромом, серой и углеродом. Рассмотрите их с точки зрения ОВР. 2) ? 5 стр.75
Творческое: Поэт Андрей Вознесенский написал в 1959 году стихотворение «Осень», в котором использовал алюминий в качестве художественного образа:…А за окошком в юном инее лежат поля из алюминия…Объясните, какие свойства алюминия подразумевал поэт. Придумайте красивые образные выражения с использованием свойств алюминия, которые можно использовать при написании сочинений.
6. Окончание урока
7. Рефлексия