- Учителю
- Тест по теме Химические реакции
Тест по теме Химические реакции
ТЕСТ ПО ТЕМЕ «ХИМИЧЕСКИЕ РЕАКЦИИ»
Колесникова Наталья Кузьминична,
учитель химии муниципального бюджетного общеобразовательного учреждения «Бехтеевская средняя общеобразовательная школа Корочанского района Белгородской области»
Цель: контроль знаний и умений учащихся о результатах учебной деятельности по теме «Химические реакции».
Тест состоит из трех частей. В части 1 приведены задания с выбором ответа, в части 2 - задания с кратким свободным ответом (тест на соответствие или задача), в части 3 - задания с развернутым ответом. Работа рассчитана на 45 минут.
Задание с выбором ответа считается выполненным верно, если учащийся указал код правильного ответа. Каждый правильный ответ оценивается 1 баллом. Задание с кратким свободным ответом считается выполненным верно, если правильно указана последовательность цифр (число). За полный правильный ответ на задание В1 - В2 ставятся 2 балла, за правильный неполный - 1 балл. Задание С1 оценивается 3 баллами, С2 - 2 баллами. Тест максимально оценивается 15 баллами.
Шкала перевода в пятибалльную систему оценки:
14 - 15 баллов - «5»
10 - 13 баллов - «4»
5 - 9 баллов - «3»
менее 5 баллов - «2»
Вариант 1
Часть 1
При выполнении заданий части 1 нужно выбрать один правильный ответ.
А1. Реакция, уравнение которой CaCO3 = CaO + CO2 - Q, относится к реакциям
-
соединения, экзотермическим 3) соединения, эндотермическим
-
разложения, эндотермическим 4) разложения, экзотермическим
А2. При комнатной температуре с наибольшей скоростью протекает реакция между
-
NaOH (р-р) и HCI (р-р) 3) CaCO3 (тв.) и HCI (р-р)
-
CuO (тв.) и H2SO4 (р-р) 4) Zn (тв.) и H2SO4 (р-р)
А3. В уравнении окислительно - восстановительной реакции расставьте коэффициенты:
P H3 +
KMnO4 + HCI H3PO4 + KCI +
MnCI2 + H2O
H3 +
KMnO4 + HCI H3PO4 + KCI +
MnCI2 + H2O
Укажите коэффициент перед формулой восстановителя
-
3 2) 4 3) 5 4) 6
А
 4. Химическое равновесие в
системе CO2 + C 2CO - Q сместится в право при
4. Химическое равновесие в
системе CO2 + C 2CO - Q сместится в право при
-
повышении давления 3) повышении концентрации СО
-
понижении температуры 4) повышении температуры
А5. Нейтральную среду имеет водный раствор соли
-
NaNO3 2) (NH4)2SO4 3) FeSO4 4)Na2S
А6. Сокращенное ионное уравнение Ag+ + CI- = AgCI соответствует взаимодействию веществ
-
AgNO3 и CI2 2) Ag2O и HCI 3) AgNO3 и AICI3 4) Ag и HCI
Част 2
Ответом к заданиям В1-В2 является последовательность цифр (число).
В1. Установите соответствие между солью и реакцией среды в её водном растворе.
СОЛЬ РЕАКЦИЯ СРЕДЫ
А) нитрат бария 1) кислотная
Б) хлорид железа(III) 2) нейтральная
В) сульфат алюминия 3) щелочная
Г) ацетат калия
В2. По термохимическому уравнению реакции вычислите количество теплоты, выделившейся при сжигании 33,6 л (н. у.) водорода с точностью до целых.
H2 + 1/2O2 = H2O + 242 кДж
Часть 3
С1. Перечислите факторы, смещающие равновесие в системе
C
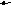 O + 2H2
CH3OH (г) + Q в сторону образования продуктов реакции.
Ответ поясните.
O + 2H2
CH3OH (г) + Q в сторону образования продуктов реакции.
Ответ поясните.
С2. Реакция протекает по уравнению А+В = 2С. Начальная концентрация вещества А равна 0,22 моль/л, а через 10 с - 0,215 моль/л. Вычислите среднюю скорость реакции.
Вариант 2
Часть 1
При выполнении заданий части 1 нужно выбрать один правильный ответ.
А1. Процесс CuО + C = CO + Cu - Q является
-
экзотермической реакцией замещения
-
экзотермической реакцией обмена
-
эндотермической реакцией замещения
-
экзотермической реакцией обмена
А2. Скорость реакции 2H2O2 = 2H2O +O2 будет выше, если использовать
-
3%-ный раствор Н2О2 и катализатор
-
30%-ный раствор Н2О2 и катализатор
-
3%-ный раствор Н2О2 и без катализатор
-
30%-ный раствор Н2О2 и без катализатор
А3. В уравнении окислительно - восстановительной реакции расставьте коэффициенты:
K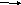 2SO3 +
KMnO4 + H2SO4 MnSO4 +
K2SO4 + H2O
2SO3 +
KMnO4 + H2SO4 MnSO4 +
K2SO4 + H2O
Укажите коэффициент перед формулой восстановителя
-
3 2) 4 3) 5 4) 6
А4. При увеличении давления химическое равновесие не смещается в сторону
-
C

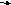
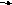
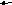
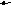 O(г) + CI2(г)
COCI2(г) 3) 2CO(г) + O2(г)
2CO2(г)
O(г) + CI2(г)
COCI2(г) 3) 2CO(г) + O2(г)
2CO2(г)
-
C
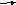
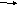
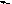
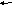


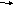 O2(г) + С(тв.)
2CO(г) 4) N2(г) + O2(г) 2NO(г)
O2(г) + С(тв.)
2CO(г) 4) N2(г) + O2(г) 2NO(г)
А5. Кислотную среду имеет водный раствор соли
-
Ca(NO3)2 2) FeCI3 3) AgCI 4) CaI2
А6. Сокращенное ионное уравнение Н+ + ОН- = Н2О соответствует взаимодействию веществ
1) Fe(OH)2 + HCI 2) NaOH + AI(OH)3 3) NaOH + HNO3 4) Ba(OH)2 + H2SO4
Часть 2
Ответом к заданиям В1-В2 является последовательность цифр (число).
В1. Установите соответствие между названием соли и средой его водного раствора.
НАЗВАНИЕ СОЛИ СРЕДА РАСТВОРА


 А)
нитрат калия 1) кислотная
А)
нитрат калия 1) кислотная
Б) сульфат алюминия 2) нейтральная
В) сульфид калия 3) щелочная
Г) фосфат натрия
В2. Термохимическое уравнение горения метана:
CH4 + 2O2 = CO2 + 2H2O + 802 кДж
Какое количество теплоты выделится при сжигании 24 г метана?
Отвез запишите с точностью до целых.
Часть 3
С1. Перечислите факторы, смещающие химическое равновесие в системе
СН4(г) + 3Н2О(г) = 3Н2(г) + СО(г) - Q
В сторону исходных веществ. Ответ поясните.
С2. Вычислите, во сколько раз увеличится скорость реакции при повышении температуры от 30 до 70∘ С, если температурный коэффициент скорости равен 2.
Ответы
Вариант 1
Часть 1
А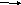 3 .
5PH3 + 8 KMnO4 + 24HCI
5H3PO4 + 8KCI + 8MnCI2 +
12H2O
3 .
5PH3 + 8 KMnO4 + 24HCI
5H3PO4 + 8KCI + 8MnCI2 +
12H2O
Часть 2
В1.
В2. Ответ: 363 кДж
Часть 3
С1.
1) понижение температуры
2) повышение давления
3) повышение концентрации исходных веществ
4) понижение концентрации продуктов реакции
Смещение равновесия происходит по принципу Ле-Шателье
С2.
Решение:
Используем формулу для расчёта
υ = ± ΔС/Δτ = ± (0,215-0,22)/(10-0) = 0,0005 моль/л ∙ с
Вариант 2
А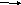 3.
5K2SO3 + 2KMnO4 +
3H2SO4 2MnSO4 + 6
K2SO4 + 3H2O
3.
5K2SO3 + 2KMnO4 +
3H2SO4 2MnSO4 + 6
K2SO4 + 3H2O
В1.В2. Ответ: 1203 кДж
Часть 3
С1.
1) повышение температуры
2) повышение концентрации исходных веществ
3) понижение концентрации продуктов реакции
Смещение равновесия происходит по принципу Ле-Шателье
С2.
Решение:
По правилу Вант-Гоффа
υ=υ0·γ (t2-t1)/10
По условию задачи требуется определить υ/υ0:
υ/υ0=2 (70-30)/10 = 24 = 16
Литература
1. Рудзитис, Г.Е. Химия. Основы общей химии. 11 класс [Текст]: учеб. для общеобразовательных организаций: базовый уровень / Г.Е. Рудзитис, Ф.Г. Фельдман. - 15-е изд. - М.: Просвещение, 2013. - 159 с.: ил. - 15 000 экз. - ISBN 978-5-09-031322-3.
2.Гара, Н.Н. Химия. Программы общеобразовательных учреждений. 8-9 классы 10-11 классы [Текст] / Н.Н. Гара // Пособие для учителей общеобразовательных учреждений. Базовый уровень. - 2-е издание. - М: Просвещение, 2009. - 56 с.: - 5000 экз. Заказ № 576. - ISBN 978-5-09-021793-4.
3. Гнутова, О.А. Контрольная работа по теме «Химические реакции». [Текст] / О.А. Гнутова // Химия в школе. - 2012, №2. - С. 22 - 30. - Тираж 12 000 экз. Заказ № 3444. - ISSN 0368-5632.