- Учителю
- Конспект теоретического занятия в рамках подготовки к ЕГЭ по химии на тему ОВР, электролиз, коррозия
Конспект теоретического занятия в рамках подготовки к ЕГЭ по химии на тему ОВР, электролиз, коррозия
Занятие 11.1.Окислительно-восстановительные процессы.
2.Электролиз растворов и расплавов электролитов.
3. Коррозия металлов и способы защиты от коррозии.
4. Задачи на электролиз и пластинку.
Теория.Окислительно-восстановительные процессы
Все процессы неорганической химии можно разбить на две группы:
-
Процессы, идущие без изменения степени окисления атомов элементов в составе реагирующих веществ. К ним относятся различные случаи обмена атомами или ионами: так называемые реакции обмена.
-
Процессы, идущие с изменением степеней окисления атомов элементов в составе реагирующих веществ. Такие химические реакции принято называть окислительно-восстановительными реакциями.
Химические реакции, в результате которых происходит изменение степеней окисления атомов химических элементов или ионов, образующих реагирующие вещества, называют окислительно-восстановительными реакциями.
В окислительно-восстановительных реакциях электроны не уходят из сферы реакции, а переносятся от одного элемента к другому.
В окислительно-восстановительных реакциях идут два процесса: процесс окисления - потеря электронов окисляющимся веществом, и процесс восстановления - присоединении электронов восстанавливающимся веществом.
В данном случае несущественно, переходят ли электроны с одного атома на другой (ионная связь) или же только более или менее оттягиваются (ковалентная полярная связь). Поэтому мы говорим об отдаче или присоединении электронов независимо от действительного типа химической связи в веществе.
Вещества, участвующие в окислительно-восстановительных реакциях, и
у которых изменились степени окисления, являются либо окислителями,
либо восстановителями.
Окислитель - это атомы, ионы или молекулы, которые принимают
электроны.
Восстановитель - это атомы, ионы или молекулы, которые отдают
электроны.
Пример1:
Zn0 + 2H+1Cl = Zn+2Cl2 + H20
Мы видим, что степень окисления цинка меняется от 0 до +2, а степень окисления водорода от +1 до 0. Следовательно, в ходе этой реакции атом цинка теряет два электрона, т.е. окисляется (восстановитель), а водород принимает два электрона, т.е. восстанавливается (окислитель).
Задание 1:
-
5HClO3+6 P +9 H2O=6H3PO4+ 5HCl
-
Cu+2H2SO4= CuSO4+ SO2+2H2O
Определите степени окисления элементов. Назовите окислитель и восстановитель.
Типичные восстановители и окислители.
Окислители:
1) вещества (оксиды, кислоты, соли) с максимально положительной или высокой степенью окисления входящего в них элемента.
Например: кислоты - HNO3, H2SO4, HClO4, H2Cr2O7;
соли - KСlO4, KClO3, KNO3, KMnO4, K2Cr2O7;
оксиды -PbO2, Mn2O7, CrO3, N2O5
2) Активные неметаллы - фтор, кислород, озон
Восстановители:
1) Bсе металлы в нулевой степени окисления!!! (они могут только отдавать электроны);
2) Bещества с минимально возможной (отрицательной) степенью окисления неметалла.
Например: водородные соединения - РН3, NH3, HI, HBr, H2S;
соли - KI, NaBr, K2S.
Все остальные вещества в зависимости от условий могут быть как окислителями, так и восстановителями: Н2О2, KNO2, Cl2, простые вещества-неметаллы могут как принимать, так и отдавать электроны.
Задание 2: Укажите, какую роль в окислительно-восстановительных реакциях могут играть следующие вещества:
-
H2S, P, HCl, Cu, H2SO4, SO2, H2O2, HNO3, Mg, F2, MnO4-, Cr+3.
Уравнения окислительно-восстановительных реакций составляют, пользуясь методом ЭЛЕКТРОННОГО БАЛАНСА: число отданных и принятых электронов должно быть одинаково.
Пример: Н N+5O3 + C0
Азотная кислота - типичный окислитель. Восстанавливается до N+4O2, углерод в этой реакции будет восстановителем, окислится до С+4О2.
HN+5O3 + C0 С+4О2 + N+4O2+ Н2О
 Составляем
электронный баланс:
Составляем
электронный баланс:
N+5 + 1е N+4 4 - окислитель, восстанавливается
C0 - 4 е С+4 1 - восстановитель, окисляется.
Таким образом, в уравнении реакции перед оксидом азота и азотной кислотой должен стоять коэффициент 4, а перед углеродом и углекислым газом - 1. Остаётся уравнять воду.
4HNO3 + C à СО2 + 4NO2+ 2Н2О
Задание 3:
Поставьте коэффициенты методом электронного баланса, укажите окислитель и восстановитель.
-
Ca3( PO4)2 + Al → Ca3P2 + Al2O3
-
KI + KNO2 + H2SO4 → NO + I2 + K2SO4 + H2O
-
NH3+ CuO = Cu+ N2+ H2O
-
NH3+ Na = NaNH2 + H2
Окислительно-восстановительные процессы зависят от реакции среды:
Чаще всего окислитель или восстановитель является таковым только в определенной среде. Иногда влияние среды определяет направление протекания реакции, а также, продукты восстановления или окисления.
Пример:
-
Направление
____в щелочной среде___
3I2+ 3H2O = HIO3+ 5HI
В кислой среде__
-
Среда определяет продукты реакции:
Сa3P2+KMnO4+H2SO4= MnSO4+ CaSO4+ H3PO4+ K2SO4+ H2O
среда
Сa3P2+KMnO4+H2O= MnO2+ Ca3(PO4)2+KOH
среда
Главные схемы окислительно-восстановительных переходов
KMnO4
(малиновый раствор)
 + восстановитель
+ восстановитель
кислая среда:
Mn2+
(MnCl2, MnSO4)
Обесцвечивание
нейтральная среда:
Mn +4
(MnO2↓ бурый осадок)
щелочная среда:
Mn+6
(K2MnO4,
зеленый раствор)
Задание 4: Написать уравнения реакций, указав продукт восстановления марганца. Поставьте коэффициенты методом электронного баланса:
KMnO4+ KNO2 + H2SO4 K2SO4 + KNO3 + H2O + …
KMnO4+ KNO2 + KOH KNO3 + H2O + …
KMnO4+ KNO2 + H2O KNO3 + КОН + …
2. Дихромат и хромат как окислители.K2Cr2O7 (кислая и нейтральная среда),
K2CrO4 (щелочная среда) + восстановители всегда получается Cr+3
кислая среда
нейтральная среда
щелочная среда
Соли тех кислот, которые участвуют в реакции:
CrCl3, Cr2(SO4)3
Cr(OH)3
K3[Cr(OH)6] в растворе,
K3CrO3 или KCrO2 в расплаве
Задание 5: Написать уравнения реакций, указав продукт восстановления хрома. Поставьте коэффициенты методом электронного баланса:
K2Cr2O7 + KJ + H2SO4 J2 + K2SO4 + H2O + …
K2CrO4+ KJ +КОН J2 + H2O + …
Схема 3: Повышение степеней окисления хрома и марганца+3 + очень сильные окислители: (всегда независимо от среды!) Cr+6
Cr2O3, Cr(OH)3, соли, гидроксокомплексы
+ очень сильные окислители:
а)KNO3, кислородсодержащие соли хлора (в расплаве)
б) Cl2, Br2, H2O2 (в растворе)
Щелочная среда: образуется хромат K2CrO4
Cr(OH)3, соли
+ очень сильные окислители: PbO2, KBiO3
Кислая среда: образуется дихромат K2Cr2O7 или дихромовая кислота H2Cr2O7
KNO3, кислородсодержащие соли хлора (в расплаве)
Щелочная среда: Mn+6 K2MnO4 - манганат
Mn+2 - соли
+ очень сильные окислители:PbO2, KBiO3
Кислая среда: Mn+7: KMnO4- перманганат HMnO4 - марганцевая кислота
Задание 6: Написать уравнения реакций, указав продукт окисления хрома и марганца. Поставьте коэффициенты методом электронного баланса:
CrCl3 + Cl2 + KOH → ... + KCl + H2O
MnO2 + KNO3 + KOH → ... + KNO2 + H2O
Схема 4: Азотная кислота.
Разложение нитратов (по ряду активности).KNO3 КNO2 + O2
нитрит
металла + кислород
2. От магния
до меди + литий
Mg(NO3) 2 MgO + NO2 + O2
оксид
металла* + NO2 + O2
3. После меди
AgNO3 Ag + NO2 + O2
металл + NO2 + O2
*оксид металла в наиболее устойчивой степени окисления
Задание 7:
Написать уравнения реакций. Поставьте коэффициенты методом электронного баланса:
а) реакции концентрированной азотной кислоты с Р, С, Cu, Mg
b) реакции разбавленной азотной кислоты с Al, Fe, Cu.
Задание 8:
Написать уравнения реакций разложения нитратов калия, меди(2), свинца, серебра
Схема 5. Серная кислота.- SO2 + сульфат металла
сульфат металла
(в минимально возможной степени окисления)
+ Н2
Железо
только при нагревании
SO2 + сульфат металла (+3)
Алюминий
Хром
Не реагирует
бериллий
Не реагирует
щелочные
Н2S + сульфат металла
щелочноземельные и магний
S + сульфат металла
неметаллы
SO2 + неметалл в высшей степени окисления.
Сульфаты:
-
Сульфаты щелочных металлов - плавятся без разложения.
-
Сульфаты металлов средней активности - при нагревании разлагаются с образованием соответствующего оксида.
![]()
-
При разложении сульфата переходного металла в низкой степени окисления - образуется оксид (с более высокой степенью окисления)
![]()
-
Сульфаты тяжелых металлов - разлагаются с образованием соответствующего металла.
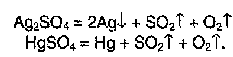
-
Сульфаты металлов при прокаливании с углем - восстанавливаются до сульфидов.
BaSO4+2C = BaS + 2CO2
Задание 9: Написать уравнения реакций. Поставьте коэффициенты методом электронного баланса:
а) реакции концентрированной серной кислоты с C, Cu, Ca.
b) реакции разбавленной серной кислоты с Al, Cr.
Задание 10: Написать уравнения возможных реакций разложения сульфатов калия, железа(2), железа(3), ртути
Схема 6: Диспропорционирование
Реакции диспропорционирования - это реакции, в которых один и тот же элемент является и окислителем, и восстановителем, одновременно и повышая, и понижая свою степень окисления.
Простые вещества:S0 S-2
и S+4
Фосфор + щелочь фосфин РН3 и соль ГИПОФОСФИТ КН2РО2 (реакция идёт при кипячении)
Р0 Р-3
и Р+1
Хлор, бром, иод + вода (без нагревания) 2 кислоты, HCl, HClO
Хлор, бром, иод + щелочь (без нагревания) 2 соли, КCl и КClO и вода
Cl20 Cl-1
и Cl+1
Хлор, бром, иод + вода (при нагревании) 2 кислоты, HCl, HClO3
Хлор, бром, иод + щелочь (при нагревании) 2 соли, КCl и КClO3 и вода
Cl20 Cl-1
и Cl+5
Пример: Сl2 + KOH = KCl + KClO + H2O (холодный раствор)
Задание 11: Написать уравнения реакций взаимодействия серы с раствором гидроксида натрия (при кипячении). Поставьте коэффициенты методом электронного баланса:
Оксиды, солиNO2 + вода 2 кислоты, азотная и азотистая
NO2 + щелочь 2 соли, нитрат и нитрит
N+4 N+3
и N+5
K2SO3 -(t) сульфид и сульфат
S+4 S-2
и S+6
KClO3 -(t) 2 соли, хлорид и перхлорат КСlO4
В присутствии катализатора разлагается на кислород и хлорид калия.
Cl+5 Cl-1
и Cl+7
Задание 12: Написать уравнения реакций взаимодействия оксида азота (IV) с раствором гидроксида бария. Поставьте коэффициенты методом электронного баланса:
6. Запомните особенности поведения некоторых окислителей и восстановителей:
а) кислородсодержащие соли и кислоты хлора обычно переходят в хлориды:
Пример: КClO3 + P = P2O5 + KCl
б) если в реакции участвуют вещества, в которых один и тот же элемент имеет степени окисления отрицательную и положительную - они встречаются в нулевой степени окисления (выделяется простое вещество).
Пример: H2S + SO2 = S + H2O
Восстановители + KMnO4 или K2Cr2O7:
а) S2-, I-, Br-, Cl- переходят в Э0
б) Р-3, As-3 +5
в) N+3,S+4, P+3, и т.п. в высшую степень окисления (соль или кислота)
7. Вещества с двойственной природой:
Н2О2 + окислитель O2
+ восстановитель Н2О или ОН-
КNO2 + окислитель KNO3
+ восстановитель NO
Чётко запомните, как отличаются активности неметаллов, какой из неметаллов более активен, а какой менее.
Более активный неметалл будет окислителем, а менее активный будет довольствоваться ролью восстановителя, если они реагируют друг с другом.H, As, I, Si, P, Se, C, S, Br, Cl, N, O, F
-------------------------------------------------->
увеличение электроотрицательности
Электролиз
Электролиз - это процесс разложения расплавов и растворов электролитов под действием электрического тока.
В раствор или расплав какого-либо электролита опускают электроды: катод (-) и анод (+).
Пропускание электрического тока через раствор или расплав вызывает разрядку на электродах частиц, из которых он состоит.
На катоде происходит восстановление катионов,
на аноде - окисление анионов.
Электролиз расплавов.
1) Расплав хлорида натрия. Он содержит катион натрия и анион хлора.
На катоде: восстанавливается КАТИОН натрия, на аноде окисляется АНИОН хлора:
 катод:
Na+ + 1e Na0 2
катод:
Na+ + 1e Na0 2
анод: 2Cl- - 2e Cl20 1
Cуммарное уравнение электролиза: 2 NaCl(расплав) -(эл. ток) 2Na + Cl2
2) Расплав гидроксида натрия.
4NaOH (расплав) -(эл. ток)à 4Na + O2 + 2H2O
 катод:
Na+ + 1e Na0 4
катод:
Na+ + 1e Na0 4
анод: 4ОН- - 4e O2 + 2H2O 1
3) Расплав оксида алюминия в криолите.
(Криолит - Na3[AlF6], в нем температура плавления оксида алюминия меньше). Электролиз проводится на графитовых электродах, при этом часть электрода сгорает в выделяющемся кислороде, выделяются оксиды углерода.
2Al2O3 (расплав) -(эл. ток)à4 Al + 3O2
Электролиз растворов электролитов (с инертными электродами)
(в процессе могут участвовать молекулы воды, материал электродов - не участвует).1. Металлы после Н:
восстанавливаются на катоде
Меn++ne- Ме0↓
На катоде выделяется металл.
1. Анионы бескислородных кислот (кроме F-) - окисляются до простого вещества: S2- >I- >Br ->Cl-
2. Металлы после Al до Н:
идёт два параллельных процесса:
а) восстановление металла
Меn++ne- Ме0↓
б) восстановление воды:
2H2O + 2e- Н20↑+2ОН-
На катоде выделяется металл и водород.
2. Анионы кислородсодержащих кислот и F- не окисляются, идёт окисление воды:
2H2O-4e- О20↑+4H+
3. Металлы до алюминия (включительно) - НЕ восстанавливаются, идёт восстановление воды:
2H2O + 2e- Н20↑+2ОН-
На катоде выделяется водород.
3. Если есть ОН-:
он окисляется с выделением О2↑:
Примеры:
1) раствор хлорида натрия.
NaCl + H2O -(эл. ток)à
катод: около катода Na+ и H2O. Натрий находится в ряду левее Al,
 поэтому
идёт восстановление воды.
поэтому
идёт восстановление воды.
2Н2О +2е- H20 + OH- 1
анод: около анода хлорид-анион
и вода. Окисляется ион Cl-
2Cl- + 2e Cl2 1
Cуммарное уравнение электролиза:
2NaCl + 2H2O -(эл. ток)à Сl2 + H2 + 2NaOH
На электродах выделяются газообразные продукты - хлор и водород, в растворе накапливается гидроксид натрия.
2) раствор сульфата меди (II)
CuSO4 + H2O -(эл. ток)
катод: около катода Cu2+ и H2O.
Медь находится в ряду после Н, поэтому она сама будет восстанавливаться на катоде:
 Cu2+ +2е Cu 1
Cu2+ +2е Cu 1
анод: около анода - сульфат- анион
и вода. Окисляется вода.
2H2O + 2e O2 + 4H+ 1
Cуммарное уравнение электролиза:
CuSO4 + H2O -(эл. ток)àCu + O2 + H2SO4
На катоде выделяется металл - медь, на аноде - газообразный кислород, в растворе накапливается серная кислота.
Таким образом, сравнивая активность тех молекул и ионов, которые находятся у каждого электрода, мы можем определить, какое вещество выделяется на каждом электроде в первую очередь.
Задание 13: Написать уравнения реакций электролиза растворов следующих солей: K2SO4, AgNO3, CuI2
Электролиз с растворимыми электродами.
В случае, если электроды НЕинертны, то происходит окисление материала анода
Пример: Электролиз раствора хлорида меди с медными электродами.
CuCl2 + H2O -(эл. ток)
катод: около катода Cu2+ и H2O.
Медь находится в ряду после Н, поэтому она сама будет восстанавливаться на катоде:
 Cu2+ +2е Cu0 1
Cu2+ +2е Cu0 1
анод: около анода - хлорид- анион,
вода и сам материал анода (медь).
Окисляется материал анода.
Cu0 - 2e-Cu2+ 1
на аноде - происходит растворение материала анода (окисление), на катоде - восстановление катионов меди, в растворе - хлорид меди (II). Масса катода растет, масса анода уменьшается.
Электролиз смеси веществ:
-
На катоде восстанавливается в первую очередь более электроотрицательный элемент. (стоящий в ряду напряжений правее)
-
На аноде окисляется менее электроотрицательный элемент.
Пример:
СuF2 + MnCl2 (раствор)-(эл. ток)Cu0+ Cl2+ MnF2
катод: около катода Cu2+, Mn2+ и H2O.
Медь находится в ряду после Н и после Mn, поэтому она сама будет восстанавливаться на катоде:
 Cu2+ +2е Cu0 1
Cu2+ +2е Cu0 1
анод: около анода - хлорид- анион, F-
вода. Окисляется Сl-
2Cl- - 2e-Cl20 1
В растворе: накапливается MnF2.
Задание 14: Написать уравнения реакций протекающих при электролизе раствора нитрата серебра на серебряных электродах.
Коррозия металлов.
Коррозия - это разрушение металлов и металлических конструкций под воздействием различных факторов окружающей среды - кислорода, влаги, вредных примесей в воздухе.
Коррозионная стойкость металла зависит от его природы, характера среды и температуры.
-
Благородные металлы не подвергаются коррозии из-за химической инертности;
-
Металлы Al, Ti, Zn, Cr, Ni имеют плотные газонепроницаемые оксидные плёнки, которые препятствуют коррозии;
-
Металлы с рыхлой оксидной плёнкой - Fe, Cu и другие - коррозионно неустойчивы. Особенно сильно ржавеет железо.
Различают химическую и электрохимическую коррозию.
Химическая коррозия происходит при воздействии на металл сухих газов, её называют газовой.
3Fe + 2O2 Fe3O4
В аппаратах химических производств возможны процессы:
Fe + 2HCl FeCl2 + H2
2 Fe + 3Cl2 2FeCl3
Электрохимическая коррозия - разрушение металла в присутствии воды и кислорода, либо в растворах электролитов. В таких растворах на поверхности металла возникают процессы переноса электронов от металла к окислителю, которым является либо кислород, либо кислота, содержащаяся в растворе:
Электродами являются сам металл (например, железо) и содержащиеся в нем примеси (обычно менее активные металлы, например, олово).
В таком загрязнённом металле идёт перенос электронов от железа к меди, при этом железо (анод) растворяется, т.е. подвергается коррозии:
Fe -2e = Fe 2+,
а на поверхности олова (катод) идёт процесс восстановления водорода из воды или растворённого кислорода:
а) 2H+ + 2e = H2;
б) O2 + 2H2O + 4e=4OH-
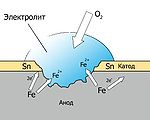
Пример: при контакте железа с оловом в растворе соляной кислоты происходят процессы:
анод: Fe -2e = Fe 2+,
катод: 2H+ + 2e = H2
Суммарная реакция:
Fe + 2H+ = H2 + Fe2+ ,
Если реакция проходит в атмосферных условиях в воде, в ней участвует кислород и происходят процессы:
анод: Fe -2e = Fe 2+,
катод: O2 + 2H2O + 4e=4OH-
Суммарная реакция:
Fe 2+ + 2OH - = Fe(OH)2
4Fe(OH)2 + O2+ 2H2O = 4Fe(OH)3
Образуется ржавчина.
Методы защиты от коррозии.а) Катодное покрытие - покрытие менее активным металлом (защищает металл только неповреждённое покрытие).
б) Покрытие краской, лаками, смазками.
в) Создание на поверхности некоторых металлов прочной оксидной плёнки химическим путём (анодирование алюминия, кипячение железа в фосфорной кислоте)
Нержавеющая сталь, новые сплавы с большой коррозионной устойчивостью.
Добавление в среду, окружающую металлическую конструкцию, ингибиторов коррозии (веществ, подавляющих процессы коррозии)
Протекторная защита: присоединение к металлической конструкции пластинок из более активного металла - протекторов.