- Учителю
- Опорный конспект для подготовки к ЕГЭ Алкены
Опорный конспект для подготовки к ЕГЭ Алкены

 Алкены -
СnH2n одна двойная связь
ен-суффикс (бутен-1) С-С-С= С 120
Алкены -
СnH2n одна двойная связь
ен-суффикс (бутен-1) С-С-С= С 120
-
С
 троение C=C-C-C
нумерация с того конца,где ближе двойная связь
троение C=C-C-C
нумерация с того конца,где ближе двойная связь
|C=C| =0,134nm sp2 sp3
Энергия больше 680 кдж/моль, чем у алканов -350,
Но П-связь легко поляризуется, алкены химически активнее, чем алканы; реакции присоединения имеет электрофильный механизм.
-
Изомерия
 1. у/в цепи 2.
положение 2-й связи, 3. межклассовая- циклоалканы
1. у/в цепи 2.
положение 2-й связи, 3. межклассовая- циклоалканы
Пространственная структурная
Геометрическая СH2=CH2 -этилен (этен)
 H H
H H

 С= C цис-бутен-2
СH3-CH=CH2 -пропилен (пропен)
С= C цис-бутен-2
СH3-CH=CH2 -пропилен (пропен)
 CH3
CH3
CH3
CH3
 H CH3
H CH3

 С= C транс-бутен-2
С= C транс-бутен-2
 CH3 H
CH3 H
3.Получение:
1. крекинг нефтепродуктов C16H34=C8H18 + C8H16
Гексадекан октан октен
2. дегидрирование алканов C-C-C-C Pt, Ni, Cr2, O3 C=C-C-C+H2
 бутан
400-600 C бутен-1
бутан
400-600 C бутен-1
3. дегидратация спиртов СH3-CH2-OH H2SO4,Al2O3 C-C=C-C+H2
 (внутримолекулярная)
Br 140-150 С Бутен -2
(внутримолекулярная)
Br 140-150 С Бутен -2
 СH2=CH2+H2O
СH2=CH2+H2O
 4.дегидрогалогенирование
CH3-CH-CH2-CH2+NaOH
спирт t
4.дегидрогалогенирование
CH3-CH-CH2-CH2+NaOH
спирт t
2-бромбутан
Правило Зайцева: при отщеплении галогеноводорода атом Н отщепляется от наименее гидрированного С !!!
CH3-CH=CH-CH3+NaBr +H2O бутен-2

 5. дегалогенирование
CH3-CH-CH-CH3+Zn=
CH2-CH=CH-CH2+ZnBr2
5. дегалогенирование
CH3-CH-CH-CH3+Zn=
CH2-CH=CH-CH2+ZnBr2
(Zn, Mg) Br Br бутен-2
(при соседних атомах С) 2,3 -дибромбутан
4. Физические свойства: С2H4, C3H6, C4H8 -Г
T пл , T кип повышается при увел. Mr, С5H10-C16H32 - Ж, С16 > Тв
5. Химические свойства:
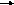 1)Реакция
присоединения (электрофильный механизм) sp2 ---- sp3
1)Реакция
присоединения (электрофильный механизм) sp2 ---- sp3
 А) гидрирования
+ H2 Pd,Pt,Ni
А) гидрирования
+ H2 Pd,Pt,Ni
 C-C-C=C+H2
Pt, t C-C-C-C бутан
C-C-C=C+H2
Pt, t C-C-C-C бутан
Б) галогенирование СH2=CH2+ Br2 = CH2Br2 -CH2 -Br2
(+Br2 - бромная вода (качественная реакция) 1,2- дибромэтан
 В)
гидрогалогенирование СH3-CH=CH2+HBr =
CH3-CH-CH3 2-бромпропан
В)
гидрогалогенирование СH3-CH=CH2+HBr =
CH3-CH-CH3 2-бромпропан
Br
Правило Марковникова: Н присоединяется к более гидрированному атому С
Г) гидратация: промышленное получение C2H5OH
 CH2=CH2+H2O
t H3PO4
CH3-CH2OH
CH2=CH2+H2O
t H3PO4
CH3-CH2OH
CH3-CH=CH2+H2O t H2SO4 CH3-CH-CH3
 пропен
пропен
OH пропанол-2
2.реакция полимеризации (свободнорадикальное присоединение)


 n CH=CH2
(-CH-CH2-) n (-CH-CH2-) n
(-CH-CH2-) n
n CH=CH2
(-CH-CH2-) n (-CH-CH2-) n
(-CH-CH2-) n


CH3 CH3 C6H5 Cl
Мономер полипропилен полистирол поливинилхлорид
3. Реакция окисления
А) C2H4+3O2=2CO2 + 2H2O
Б) в нейтральной среде или слабощелочных растворах

 3CH2=CH2+2KMnO4+4H2O=3CH2-CH2+2MnO2+2KOH
3CH2=CH2+2KMnO4+4H2O=3CH2-CH2+2MnO2+2KOH
Вос-ль ок-ль этандиол-1,2
ОН ОН
В ) в кислой среде
(H2SO4) t разрушение двойной связи
и превращение атомов углерода, между которыми существовала двойная
связь, в атомы углерода карбоксильной группы :
) в кислой среде
(H2SO4) t разрушение двойной связи
и превращение атомов углерода, между которыми существовала двойная
связь, в атомы углерода карбоксильной группы :
5CH3-CH=CH-CH3+8KMnO4+12H2SO4 =10CH3COOH+ 8MnSO4 +4K2SO4+12H2O
Бутен-2 вос-ль ок-ль
5H3C-CH-CH=CH2+2KMnO4+3H2SO4 = 5CH-CH2-COOH+2MnSO4+K2SO4+CO2+4H2O
Бутен-1 пропановая кислота
 СН3
СН3
5 С=CH-CH3+6KMnO4+9H2SO4=5CH3-C-CH3+5CH3COOH
+6MnSO4+3K2SO4+9H2O
С=CH-CH3+6KMnO4+9H2SO4=5CH3-C-CH3+5CH3COOH
+6MnSO4+3K2SO4+9H2O
CH3 2-метилбутен-2 || кетон
(2 углеродных заместителя у С при = связи) О
Для определения структуры алкена
 С-С-С=C-C
[O] CH3-CH2-COOH +
CH3-COOH
С-С-С=C-C
[O] CH3-CH2-COOH +
CH3-COOH
Пентен-2 пропановая уксусная
кислота кислота
 2CH2=CH2+O2
= 2CH2 -CH2 эпоксид
2CH2=CH2+O2
= 2CH2 -CH2 эпоксид
О
С-C-C-C=C [O] CH3-CH2-CH2-COOH+CO2+H2O
Пентен-1 бутановая
кислота
CH2=CH2+2KMnO4+H2SO4 = MnSO4+ K2SO4+4H2O+HOOC-COOH
Этандиовая (щавелевая) кислота