- Учителю
- Интегрированный урок по химии и биологии «Загрязнители окружающей среды через призму ОВР», 11 класс
Интегрированный урок по химии и биологии «Загрязнители окружающей среды через призму ОВР», 11 класс
МБОУ «Холмовская средняя общеобразовательная школа»
Холм-Жирковского района Смоленской области.
Интегрированный урок по химии - биологии
на тему:
«Основные загрязнители
окружающей среды и
их влияние на организм человека
через призму окислительно-восстановительных реакций»
Учитель химии: Сергеева В.Н.
Учитель биологии: Набережная И.А.
2012 год
Основные загрязнители
окружающей среды и
их влияние на организм человека
через призму окислительно-восстановительных реакций.
Интегрированный урок по химии - биологии, 11 класс.
Учитель химии: Сергеева Вера Николаевна
Учитель биологии: Набережная Ирина Алексеевна
Цели:
1. Обобщить и систематизировать знания учащихся об основных загрязнителях окружающей среды, относящихся к органическим и неорганическим соединениям, об их влиянии на здоровье человека и на экологическое состояние планеты в целом.
2. Повторить основные понятия об окислении и восстановлении, рассмотреть сущность окислительно-восстановительных реакций.
3. Вырабатывать умения по составлению уравнений химических реакций, протекающих в различных средах методом электронного баланса.
4. Показать разнообразие и значение ОВР в природе и повседневной жизни.
Универсальные учебные действия:
Учебно-образовательные. Обобщить знания об основных загрязнителях окружающей среды, относящихся к органическим и неорганическим соединениям; предложить способы сохранения здоровья человека и природы.
Учебно-развивающие. Развивать умения публичного выступления, способностей дискутировать, искать пути решения проблем, умений проводить исследование и моделирование.
Учебно-воспитательные. Продолжить формирование научного мировоззрения, экологической культуры, гражданственности и патриотизма.
Коммуникативные. Продолжить развивать умения слушать и вступать в диалог, участвовать в коллективном обсуждении поставленной проблемы, развивать умения с достаточной полнотой и точностью выражать свои мысли в соответствии с задачами и условиями коммуникации.
Личностные. Помочь учащимся в профессиональном самоопределении.
Регулятивные. Помочь учащимся выделить и осознать то, что уже освоено ими и что еще подлежит освоению по данной проблеме.
Оборудование и реактивы:
1.Периодическая система Д.И.Менделеева.
2.Белок яйца.
3.Соли тяжёлых металлов.
4.Соляная кислота.
5.Азотная кислота.
6.Скорлупа яиц.
7.Штатив с пробирками.
8.Мармелад, аспарагус Шпрингера, хлорофитум, колбаса.
9.Раздаточный материал.
10.Компьютер, проектор, экран.
Эпиграф к уроку:
Жить счастливо и жить согласно с природой - одно и то же! (Сенека, древнеримский философ.)
ХОД УРОКА.
Учитель биологии:
Здравствуйте, ребята! Тема нашего сегодняшнего урока - «Основные загрязнители окружающей среды и их влияние на организм человека через призму окислительно-восстановительных реакций».
Человек всегда использовал окружающую среду в основном как источник ресурсов, и в течение длительного времени его деятельность не оказывала заметного влияния на биосферу.
Лишь в конце прошлого столетия изменения биосферы под влиянием хозяйственной деятельности обратили на себя внимание ученых. В настоящее время эти изменения лавиной обрушились на человеческую цивилизацию. Стремясь улучшить условия своей жизни, человек постоянно наращивает темпы материального производства, не задумываясь о последствиях. При таком подходе большая часть взятых от природы ресурсов возвращается ей в виде отходов, часто ядовитых или непригодных для утилизации. Это создает угрозу существованию биосферы и самого человека.
(Учащийся читает стихотворение)
Планета когда-то
Прекрасной была.
И реки струились
Прозрачней стекла.
Был снег белоснежным
И дождь, как слеза,
Сияла на солнце небес бирюза.
Планету природы искусный резец
Миллионами лет
Превращал в образец.
Но … сейчас
Истыкали трубы просторы небес.
Отравлены воды, испакощен лес,
Плывут облака,
Точно черная ночь:
Дышать и животным,
И людям невмочь…
Учитель биологии:
Влияние условий жизни на здоровье людей было замечено еще в глубокой древности. Но лишь в XX в. человечество в полной море осознало, что многие болезни непосредственно связаны с загрязнением атмосферы, плохим водоснабжением, употреблением некачественных продуктов. По данным Всемирной организации здравоохранения от качества окружающей среды на 20 % зависит здоровье населения.
Исследования, проведенные в 100 городах России, показали, что интенсивному воздействию различных загрязняющих веществ, содержащихся в атмосфере, подвергается около 60 млн. человек, т.е. более 40 % населения нашей страны.
Классификация загрязнений.
Для начала определимся, что же считать загрязнением окружающей среды.
Загрязнение - привнесение в среду или возникновение в ней новых, не характерных для среды химических, физических, биологических или информационных агентов; или повышение концентрации этих агентов сверх среднего наблюдавшегося количества или уровня.
Иными словами, загрязнение в общем виде - все то, что не в том месте, не в то время и не в том количестве, которые характерны (естественны) для природы и отличаются от обычно наблюдаемых норм. Загрязнение выводит системы природы из равновесия.
Все виды загрязнителей можно разделить по их природе на:
-
физические,
-
химические,
-
биологические,
-
информационные.
Кроме того, существуют классификации загрязнителей по их происхождению (сельскохозяйственные, промышленные, бытовые), по степени их опасности (классы опасности) и ряд других. На нашем уроке нам будет удобно пользоваться приведенной выше классификацией, так как основное внимание мы уделим химическим загрязнителям.
Химическое загрязнение.
Один из старейших видов загрязнения окружающей среды, с которым сталкивался человек. Включает минеральные и органические вещества. Различают разрушаемые и стойкие химические загрязнители. Последние особо опасны, так как могут накапливаться в биосфере. Наличие стойких загрязнителей объясняется тем, что человек синтезировал новые вещества и даже классы веществ, которые ранее отсутствовали в биосфере,а, следовательно, в природе отсутствуют естественные пути утилизации этих веществ. Примером чрезвычайно стойкого загрязнителя является инсектицид ДДТ: не смотря на то, что его не применяют уже несколько десятков лет, ДДТ обнаруживает в крови животных, обитающих в самых удаленных уголках земного шара, где этот ядохимикат никогда не применялся.
Учитель химии:
Химические процессы, протекающие при загрязнении окружающей среды, в большинстве случаев относятся к процессам окисления и восстановления. Давайте вспомним понятия окислитель, восстановитель, процессы окисления и восстановления (ответы учащихся).
Восстановлением называют процесс присоединения электронов атомом, молекулой или ионом, который сопровождается понижением степени окисления.
Окислением называют процесс отдачи электронов атомом, молекулой или ионом, который сопровождается повышением степени окисления.
Восстановителем называют реагент, который отдает электроны в ходе окислительно-восстановительной реакции.
Окислителем называют реагент, который принимает электроны в ходе окислительно-восстановительной реакции.
- Как называют реакции, в которых имеют место такие процессы? (ответ ученика).
Окислительно-восстановительными называют реакции, которые сопровождаются изменением степеней окисления химических элементов, входящих в состав реагентов.
- Давайте рассмотрим классификацию окислительно-восстановительных реакций.
Классификация ОВР
Окислительно-восстановительные реакции делят на:
1.реакции межмолекулярного окисления-восстановления,
2.реакции внутримолекулярного окисления-восстановления,
3.реакции диспропорционирования
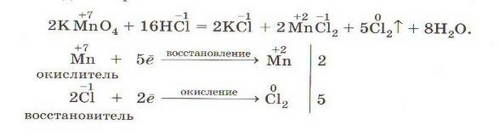
Межмолекулярные реакции: частицы - доноры электронов (восстановители) - и частицы - акцепторы электронов (окислители) - находятся в разных веществах.
К этому типу относится большинство ОВР.
Внутримолекулярные реакции: донор электронов - восстановитель и акцептор электронов - окислитель находятся в одном и том же веществе.
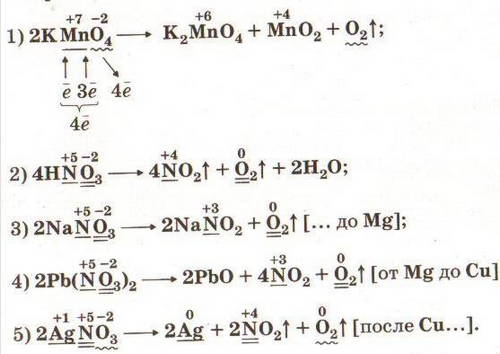
Реакции дисмутации, или диспропорционирования, или самоокисления-самовосстановления: атомы одного и того же элемента в веществе выполняют одновременно функции и доноров электронов (восстановителей) и акцепторов электронов (окислителей). Эти реакции возможны для веществ, содержащих атомы химических элементов в промежуточной степени окисления.
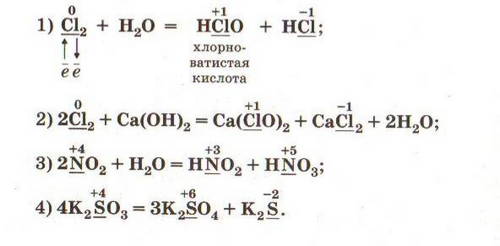
Составление уравнений окислительно-восстановительных реакций методом электронного баланса
- Для составления окислительно-восстановительных реакций используют метод электронного баланса.
Метод основан на сравнении степеней окисления атомов в исходных веществах и продуктах реакции и на балансировании числа электронов, смещаемых от восстановителя к окислителю.
Метод применяют для составления уравнений реакций, протекающих в любых фазах. В этом универсальность и удобство метода.
Недостаток метода - при выражении сущности реакций, протекающих в растворах, не отражается существование реальных частиц.
(Учитель предлагает учащимся рассмотреть алгоритм составления уравнений окислительно-восстановительных реакций методом электронного баланса).
Алгоритмическое предписание для составления уравнений окислительно-восстановительных реакций методом электронного баланса:
1. Составить схему реакции.
2. Определить степени окисления элементов в реагентах и продуктах реакции.
3. Определить, является реакция окислительно-восстановительной или она протекает без изменения степеней окисления элементов. В первом случае выполнить все последующие операции.
4. Подчеркнуть элементы, степени, окисления которых изменяются.
5. Определить, какой элемент окисляется (его степень окисления повышается) и какой элемент восстанавливается (его степень окисления понижается) в процессе реакции.
6. В левой части схемы обозначить с помощью стрелок процесс окисления (смещения электронов от атома элемента) и процесс восстановления (смещения электронов к атому элемента)
7. Определить восстановитель (атом элемента, от которого смещаются электроны) и окислитель (атом элемента, к которому смещаются электроны).
8. Сбалансировать число электронов между окислителем и восстановителем.
9. Определить коэффициенты для окислителя и восстановителя, продуктов окисления и восстановления.
10. Записать коэффициент перед формулой вещества, определяющего среду раствора.
11. Проверить уравнение реакции.
Учитель биологии:
Загрязняющие вещества, образующиеся в результате хозяйственной деятельности человека, и их влияние на природу очень разнообразны. К ним относятся:
- соединения углерода, серы, азота;
- тяжелые металлы;
- различные органические вещества;
- искусственно созданные материалы;
- радиоактивные элементы и многое другое.
Кислотные осадки представляют собой различные виды атмосферных осадков (дождь, снег, туман, роса) с кислотностью выше нормы.
Даже нормальная дождевая вода имеет слабокислую реакцию из-за наличия в воздухе диоксида углерода. А кислотный дождь образуется в результате реакции между водой и такими загрязняющими веществами, как оксид серы и различными оксидами азота. Эти вещества выбрасываются в атмосферу автомобильным транспортом, в результате деятельности металлургических предприятий, тепловых электростанций. При сжигании полезных ископаемых угля, нефти, мазута, торфа, сланцев образуются оксиды азота (например, оксид азота, вступая в реакцию с водой атмосферы, под воздействием солнечного излучения, или так называемых «фотохимических реакций»), которые превращаются в растворы кислот - серной, сернистой, азотистой и азотной. Затем, вместе со снегом или дождем, они выпадают на землю, в воду повышается их кислотность до такого уровня, что в них погибает флора и фауна. Рыба исчезла из многих озер. Поверхность каменных и бетонных домов, мраморных статуй разъедена. С/х культуры замедляются в росте, леса умирают. Под действием кислотных дождей выпадает шерсть животных и перья птиц, гибнут яйца птиц. Тревожит следующее: живые организмы могут существовать в узком кислотно - щелочном диапозоне, и вряд ли им по вкусу придется чрезмерно « газированная» вода.
Учитель химии:
Давайте рассмотрим, как кислотные дожди влияют на скорлупу яиц и на белок куриного яйца.
Опыт 1. « Действие азотной кислоты на белок куриного яйца».
(Учащиеся приливают к белку яйца азотную кислоту).
- Белок денатурирует, т.е. разрушается.
Опыт 2 «Действие соляной кислоты на скорлупу яиц».
(Учащиеся приливают к скорлупе соляную кислоту).
- Скорлупа разрушается.
CaCO3 + 2HCl = CaCl2 + CO2 + H2O (уравнение рассматривает и записывает учащийся)
- Рассмотрите, является ли эта реакция ОВР?
- Нет, не является.
- А вот образование кислотных дождей может быть окислительно-восстановительным процессом. Углекислый газ, оксиды серы и азота, которые попадают в атмосферу и образуют кислотные дожди.
Оксиды азота обладают токсичным и раздражающим действием. Если они попадают на влажную поверхность легких, то в них происходит образование азотистой и азотной кислот, которые поражают альвеолярную ткань, что приводит к отеку легких.
+4 +3 +5
2NO2 + H2O = HNO2 + HNO3 (уравнение записывает и рассматривает учащийся)
Окислитель N+4 +1e = N+3 пр. восстановление.
Восстановитель N+4 - 1e = N+5 пр. окисление.
Тип ОВР - диспропорционирования или самоокисления-самовосстановления.
Оксид серы(IV), или сернистый газ, вызывает заболевания дыхательных путей. Существует благодаря металлургическим заводам и угольным электростанциям. В больших количествах находится в городах Норильск, Мончегорск, Никель.
Серная кислота, содержащаяся в атмосферных осадках, представляет для живой природы и человека большую опасность. Кислотные дожди постепенно загрязняют водоемы ионами тяжелых металлов, таких, как ртуть, свинец, кадмий. Кислоты вытесняют металлы из горных пород, через почву металлы попадают в водоемы. Последствия этого - тяжелейшие отравления людей.
SO2 +H2O = H2SO3
2SO2 + O2 = 2SO3
SO3 + H2O = H2SO4
Единственный способ изменить ситуацию к лучшему, по мнению многих специалистов,- это уменьшить количество вредных выбросов в атмосферу.
Учитель биологии:
Мы повинны не только в образовании кислотных дождей, но и в образовании смога
Смог - это туман, возникающий в крупных городах в результате фотохимических реакций в атмосфере, которые происходят при действии ультрафиолетовой солнечной радиации на газовые выбросы промышленных предприятий и автотранспорта. При смоге резко ухудшается видимость, появляется неприятный запах, воздух становится ядовитым. Этот воздух поражает, прежде всего, слизистые оболочки глаз и дыхательных путей.

Смог - бич мегаполисов
Учитель химии:
Угарный газ - бесцветный газ без запаха, легче воздуха, оксид углерода(II). Химическая формула - СО. Самый таинственный, загадочный и коварный среди газов. Попадая в воздух при сжигании топлива в промышленных печах и двигателях автомобилей, прочно соединяется с гемоглобином крови, и кровь теряет способность переносить кислород из легких к тканям. Даже низкая его концентрация способна вызывать у человека удушье, остановку дыхания, поэтому его еще называют угарным газом.
2С0+О02=2С+2О-2 (уравнение записывает и рассматривает учащийся)
Восстановитель С0- 2е = С+2 пр. окисление
Окислитель О0 +2е = О-2 пр. восстановление
ОВР межмолекулярная.
Углекислый газ при сжигании различного топлива поступает в атмосферу, а чем больше его в атмосфере, тем теплее становится климат. Считают, что с ним связан «парниковый эффект», т.е. увеличение средней температуры атмосферы на несколько градусов.
Потепление климата может привести к таянию ледников и повышению уровня Мирового океана. Во-вторых, при содержании в воздухе больше 15 % (по объему) становится ядовитым для всего живого.
Учитель биологии:
Вода всегда рядом с нами, мы используем воду с рождения, привыкаем к ней и потому за чудо не считаем. Между тем вода - одно из ярких чудес природы. Она является главной составной частью всех живых организмов. В сказках вода бывает живая и мертвая. В жизни мертвую воду часто делает сам человек, сбрасывая в нее в немыслимых количествах отходы своей жизнедеятельности. Загрязненная вода еще годится на технологические процессы, но для питья нет. И человек начинает придумывать очень дорогие и сложные системы и способы очистки самим же загрязненной воды. Такие болезни, как холера, брюшной тиф, гепатит - непосредственно связаны с качеством воды и передаются через нее. Если верить прогнозам комиссии ООН, то в 21 веке несколько млрд землян не будут знать вкуса чистой воды. В России половина населения пользуется водой, которая не соответствует стандартам качества. Заглянем в чайник после неоднократного кипячения в нем воды. Такие же узоры накипи откладываются в суставах, почках, на стенках кровеносных сосудов, когда люди пьют некачественную воду.
Учитель химии:
Хлор - самый дешевый реагент для обеззараживания воды. Можно заменить его ультрафиолетом или озонированием, но пока ни одному городскому бюджету это не по силам. Хлорированной водой еще никто не отравился, но даже вскипяченная она отчетливо пахнет хлором. А потому не безопасна - аквариумные рыбки в ней дохнут. Хлор раздражает слизистую желудочно-кишечного тракта, убивая в нем полезную микрофлору. Xлорорганические соединения обладают канцерогенным действием, вдыхание их паров приводит к раздражению слизистых оболочек, воспалению легких, помутнению роговицы глаза.
Много лет назад ученые обнаружили, что хлорирование воды приводит к образованию в ней новых, до конца не изученных химических загрязнителей. Что же происходит при хлорировании воды?
Cl20 + H2O = HCl-1O + HCl-1
Восстановитель Cl0 - 1e = Cl+1 пр.окисление.
Окислитель Cl0 + 1e = Cl-1 пр. восстановление.
Тип ОВР - диспропорционирования или самоокисление-самовосстановление.
Образуемые кислоты способны реагировать с теми ионами и веществами, которые находятся в воде и продукты реакций предугадать очень сложно.
Учитель биологии:
С каждым годом растет производство и применение удобрений и ядохимикатов в сельском хозяйстве. Нужно принять во внимание, что из всего количества вносимых удобрений с/х растения используют всего лишь 40 - 50%. Остальное вымывается из почвы в виде нитратов в водоемы или улетучивается в атмосферу. Химикатов накопилось столько в земле, что потребуется несколько десятилетий, чтобы они разложились. И еще столько же, чтобы почва стала снова плодородной. Так в южных областях России, где наиболее развито сельское хозяйство, чаще, чем в других местах, рождаются дети, страдающие тяжелыми заболеваниями, в том числе умственно отсталые, развиваются раковые заболевания, нарушается деятельность щитовидной железы, кислородное голодание органов и др.
Там, где сильно загрязнены почвы, заболеваемость детей в 2 раза выше, чем в других районах. На Урале было отмечено заболевание, получившее название «картофельная болезнь». Ею болели студенты, занятые на уборке картофеля и других овощей. Выяснилось, что студенты ели морковь с высоким содержанием химических удобрений.
Наибольшую опасность для человека представляет включение всех загрязнителей почвы в экологические пищевые цепи, когда они переходят из почвы и воды в растения, затем в животных, и в конечном итоге попадают с пищей в наш организм.
Учитель химии:
Избыток в почве нитратов ухудшает качество овощей, фруктов, зерновых культур. Корневые системы всех растений хорошо усваивают нитраты. В растении происходит их восстановление до аммиака, который реагирует с некоторыми органическими кислотами и в результате образуются аминокислоты - строительный материал для белков. Но если в почве избыток нитратов, то они не успевают полностью превратиться в аминокислоты. Нитраты превращаются в нитриты и отравляют наш организм.
+5-2 +3 0
2NaNO3 = 2NaNO2 + O2
Окислитель N+5 +1e = N+4 пр. восстановление.
Восстановитель О-2 -2е = О0 пр. окисление.
Тип ОВР - внутримолекулярная.
Нитриты так же применяет человек для консервирования и окраски мясных продуктов. Это позволяет достичь тройного эффекта: предотвращение роста бактерий, вызывающих пищевые отравления - страшен ботулический токсин, смертельно ядовитый в ничтожных количествах; окрашивание мяса в розовый свежий цвет и придание ему характерного солоноватого вкуса. Однако нитриты связывают гемоглобин крови, образуя метгемоглобин, накопление которого в организме человека вызывает одышку. Иногда острое отравление. Кроме того, нитриты, взаимодействуя с аминами, образуют канцерогенные вещества - нитрозамины.
Учитель биологии:
Тяжелые металлы.
Металлы с плотностью 8 тыс. кг/м3 и более (кроме благородных и редких). К тяжёлым металлам относятся: свинец, медь, цинк, никель, кадмий, кобальт, сурьма, олово, висмут, ртуть.
Часть техногенных выбросов т.м., поступающих в атмосферу в виде тонких аэрозолей, переносится на значительные расстояния и приводит к глобальному загрязнению. Основной поставщик - предприятия цветной металлургии. Для таких предприятий характерно наличие 5 км- зоны максимальных концентраций т.м. и 20-50 км- зоны повышенных концентраций. Сильное загрязнение свинцом и другими тяжелыми металлами наблюдается вокруг автострад.
Растения могут накапливать тяжелые металлы, являясь промежуточным звеном в цепи почва -> растение -> животное -> человек (или минуя животных). Однако растения не повторяют химический состав почвы, так как способны к избирательному поглощению. Главным показателем здесь является коэффициент биологического поглощения - отношение содержания элемента в золе растения к концентрации в почве. Медь накапливают растения семейства гвоздичные, кобальт - перцы, цинк поглощают карликовые березы и лишайники и т.д.
Тяжелые металлы являются ядами. Механизмы их токсического действия различны. Многие металлы при определенных концентрациях ингибируют действие ферментов (медь, ртуть). Некоторые металлы образуют хелатоподобные комплексы с обычными метаболитами, нарушая обмен веществ (железо). Другие металлы повреждают клеточные мембраны, изменяя их проницаемость и другие свойства. Некоторые металлы конкурируют с необходимыми организму элементами (Sr-90 может замещать в организме Ca, Cs-137 - калий, кадмий может замещать цинк).
Сообщения учащихся.
-
«Ртуть»
Положение металлов в Периодической системе Д.И.Менделеева
Ртуть (порядковый номер 80) находится в 6-м большом периоде, 2 группе побочной подгруппе.
Историческая справка.
У писателя-фантаста И.А.Ефремова есть рассказ «Озеро горных духов». Люди, оказавшиеся на берегах этого озера в солнечную погоду, погибали. Местные жители уверяли, что озеро населяют духи, которые не терпят пришельцев.
Экспедиция геологов смогла добраться до затерянного в горах озера, и с изумлением обнаружили, что озеро состояло не только из воды. Вместе с водой присутствовала самородная ртуть. А «злыми духами» были ртутные пары, которые в жаркую погоду поднимались на поверхности больших и маленьких луж, окружавших озеро и наполненных ртутью. Ртуть находили в Испании на дне колодцев, при раскопках египетских гробниц в середине 2 тысячелетия н.э. Ртуть была известна в древности в Китае и Индии. Ртуть упоминается в трудах древних учёных, которые использовали её в качестве лекарства. С помощью ртути изготавливали амальгамированные зеркала. Амальгаму металла золота или серебра наносили на металлический лист и сильно нагревали. При этом ртуть испарялась, а тончайший слой золота или серебра оставался на листе. Но этот способ был очень опасным из-за отравлений парами ртути. При золочении купола Христа Спасителя в г. Москве использовался метод лазерного напыления золота на металлические листы, из которых состоит купол.
Наиболее крупное месторождение ртути находится в Альмадене (Испания). Разработка этого месторождения началась ещё в период Римской империи. Ежегодно римляне добывали 4,5 т ртути.
Токсическое действие ртути.
В организме человека ионы ртути энергично соединяются с белками и прочно удерживаются в образовавшихся комплексах. Белки, содержащие эти группы, находятся в почках, поэтому ртуть, попадая в организм, сосредотачивается преимущественно в почках и нарушает их нормальную деятельность. При вдыхании паров ртути она концентрируется в мозге.
В1953 г. Более ста жителей японского городка заболели странной болезнью. У них появились конвульсии, судороги сводили мышцы. Наиболее тяжёлые случаи заканчивались полной слепотой, параличом, безумием, смертью. Оказалось, что они употребляли в пищу морскую рыбу, которая была напичкана ртутью, сбрасываемой хим.предприятием (ртуть накапливается в основном в голове рыбы).
При отравлении ртутью появляются симптомы: расстройство речи, ухудшение слуха, потеря памяти и усталость, нарушение координации движений, ЦНС.
Источники загрязнения
Сжигание топлива, металлургические процессы, потери ртути на предприятиях по производству хлора и каустической соды, сжигание мусора, сточные воды, коксование угля.
-
«Свинец»
Положение в Периодической системе Д.И.Менделеева
Свинец (порядковый номер 82) находится в 8-м большом периоде, 4 группе главной подгруппе.
Историческая справка.
Рим спасли гуси - это известно всем. Бдительные птицы своевременно заметили приближение неприятельских войск и резким гортанным звуком сигнализировали об опасности. Но впоследствии Римской империи суждено было пасть.
Что погубило Рим? «В падении Рима повинно отравление свинцом» - так считают учёные-токсикологи. Люди пользовались знаменитым водопроводом, «сработанным ещё рабами Рима», а трубы его, как известно, были сделаны из свинца. Кроме этого, использование оправленной в свинец посудой, свинцовых косметических красок, палочек для письма обусловило быстрое вымирание римской аристократии. Из-за систематического отравления малыми дозами свинца средняя продолжительность жизни римских патрициев не превышала 25 лет. При раскопках останки древних римлян содержали большое количество свинца.
С
 винец редко встречается в самородном виде, но из руд выплавляется легко. Впервые свинец стал известен египтянам одновременно с железом и серебром. За 2 тыс. до н.э. свинец умели выплавлять в Индии и Китае. В России производство свинца известно с давних пор. Но до 18 века производство его носило кустарный характер.
винец редко встречается в самородном виде, но из руд выплавляется легко. Впервые свинец стал известен египтянам одновременно с железом и серебром. За 2 тыс. до н.э. свинец умели выплавлять в Индии и Китае. В России производство свинца известно с давних пор. Но до 18 века производство его носило кустарный характер.
Токсическое действие свинца.
Все растворимые соединения этого элемента ядовиты. Вода, которая питала Древний Рим, была богата углекислым газом. Реагируя со свинцом, он образует хорошо растворимый в воде кислый углекислый свинец. Поступая даже в малых порциях в организм, свинец задерживается в нём и постепенно замещает кальций, который входит в состав костей. Это приводит к хроническим заболеваниям. Испанский художник Ф. Гойя часто использовал в живописи свинцовые белила для получения любимых серых тонов. И он тяжело болел. Его изнуряли припадки, галлюцинации, был разбит параличом.
При отравлении свинцом появляются симптомы: поражения дёсен, заболевания почек, сосудов и ЦНС, головные боли, головокружение, повышение внутричерепного давления, блокируется синтез гемоглобина.
Источники загрязнения.
Промышленные и бытовые сточные воды, выбросы автотранспорта(главным образом этилированный бензин-тетраэтилсвинец), производство фотоматериалов, спичек. красок, аккумуляторов.
-
«Медь»
Положение в Периодической системе Д.И.Менделеева
Медь (порядковый номер 29) находится в 4-м большом периоде, 1 группе побочной подгруппе.
Историческая справка.
По мнению французского учёного М.Бертло, человечество познакомилось с медью не менее 5 тыс. лет назад. По мнению других исследователей - раньше. Медь и её сплав с оловом - бронза - обозначили целую эпоху в истории развития человечества - бронзовый век. Бронза вытеснила каменные орудия труда. Бронза как и медь оказались прекрасным материалом для чеканки и скульптуры. В 5 веке до н.э. люди научились отливать бронзовые статуи. При сплавлении меди с цинковой пылью получается замечательный сплав - латунь.



Медь, наряду с золотом и серебром встречается в природе в самородном состоянии (самый крупный из когда-либо найденных самородков меди весил 420 тонн). Она обладает хорошей ковкостью, легко обрабатывается. Хотя медное орудие было не таким твёрдым, как камень, но затупившееся остриё его можно опять заточить и использовать снова. В рукописях, найденных при раскопках одной из гробниц в Фивах, содержались секреты «получения» золота из меди египетскими жрецами.
В 3-м тысячелетии до н.э. в Египте было сооружено одно из семи чудес света - пирамида Хеопса. Эта величественная гробница фараона сложена из 2 миллионов 300 тысяч каменных глыб весом по 2,5 тонны, и каждая из них была добыта и обработана медным инструментом.
Токсическое действие меди.
Медь относят к группе высокотоксичных металлов. Ионы меди способны блокировать ферменты и нарушать их каталитическую функцию. Медь в организме играет важную роль в поддержании нормального состава крови, т.к. активизирует железо печени для образования гемоглобина.
При отравлении медью появляются симптомы: соли меди вызывают расстройство ЦНС, печени и почек, поражение зубов и слизистой рта, вызывают гастриты, язвенную болезнь желудка, снижение иммунобиологической реактивности, разрушают эритроциты. При малых концентрациях возможны анемия и заболевания костной ткани. Избыток меди может вызвать желтуху.
Источники загрязнения.
Промышленные выбросы, отходы, стоки предприятий цветной металлургии, выхлопные газы автотранспорта, медьсодержащие удобрения и пестициды, сжигание топлива.
-
«Кадмий»
Положение в Периодической системе Д.И.Менделеева
Кадмий (порядковый номер 48) находится в 5-м большом периоде, 2 группе побочной подгруппе.
Историческая справка.
В 1817 г. A Штромейер, приват-доцент кафедры химии медицинского факультета Геттингенского университета и главный инспектор аптек в Ганновере, обнаружил, что при прокаливании карбоната цинка, продаваемого в аптеках, образуется жёлтое вещество, хотя никаких других примесей не было. При исследовании полученного при прокаливании оксида цинка, ему удалось отделить это вещество от оксида цинка и восстановить его до металлического состояния. В результате реакции получился голубовато-серый металл. Это был кадмий. Но так как Ф.Штромейер располагал всего 3 г этого металла, у него не было возможности провести более или менее тщательное исследование свойств нового элемента. Название металлу дано по греческому названию природного карбоната цинка. Предлагали назвать новый металл мелинумом из-за жёлтого цвета его сульфида, юнонием по названию астероида. Но ни одно из этих названий не привелось Несколько позже кадмий был открыт в Германии (1818г.)
Токсическое действие кадмия.
Кадмий - бомба замедленного действия. В организме человека кадмий накапливается в почках, при его избытке развивается болезнь «итай-итай». Это искривление и деформация костей, сопровождающиеся сильными болями, необычайная хрупкость и ломкость костей. Кадмий повышает кровяное давление и обладает канцерогенными свойствами. В течение жизни его содержание в почках может увеличиваться в 100-1000 раз. Особенно быстро к критическому порогу приходят курильщики. Курение приводит к нарушению функций почек, болезням лёгких и костей. Растения табака аккумулируют кадмий из почвы. Одна сигарета содержит 2,2-2,5 мкг кадмия, в организм с ней попадает 0,1-0,2мкг. Много кадмия находится в высушенном табаке. Сигаретный дым отравляет как курильщика, так и некурящего. Активное и пассивное курение - сильные источники кадмия.


При отравлении кадмием появляются симптомы: воспаление суставов, пониженный аппетит, камни в почках, тормозится рост костей, сильные боли в пояснице и в мышцах ног, а также опасность частых переломов, например, переломы рёбер при кашле. Действуя на кожу, кадмий вызывает дерматиты. Кадмий - канцероген, вызывает рак лёгких, прямой кишки. Почки, печень, поджелудочная и щитовидная железы - органы, в которых кадмий может оставаться годами. Источники загрязнения Сточные воды горно-металлургических комбинатов, производств красителей, кадмий - никелевых аккумуляторов. Детские китайские игрушки могут содержать токсичные красители, в состав которых входит кадмий.
Учитель химии:
Каким образом действуют тяжелые металлы и их соли на живые организмы, рассмотрим на примере следующих опытов. Все живые организмы состоят из белков. Вот и мы возьмем белок куриного яйца и подействуем на него солями тяжелых металлов: ацетатом свинца, сульфатом меди, нитратом кобальта.
Рассмотрим как действуют соли тяжелых металлов на белок куриного яйца, проведя соответствующий опыт.
Опыт 3. «Действие солей тяжелых металлов на белок куриного яйца»
(Учащиеся приливают к белку куриного яйца соли тяжелых металлов).
-Белок разрушается, денатурирует.
Белок состоит из аминокислот, которые и взаимодействуют с тяжелыми металлами, что приводит к разрушению белка, т.е. денатурации. Этот процесс может привести к гибели живого организма.
+ 0 +2 0
2NH2-CH2-COOH + Pb = (NH2-CH2-COO)2Pb + H2 (уравнение записывает и рассматривает учащийся)
Окислитель Н+ +1е = Н0пр. восстановление.
Восстановитель Pb0 - 2e = Pb+2 пр. окисление.
Тип ОВР - межмолекулярная.
Полезные советы:
(зачитывает учащийся)
-
Противоядием от тяжёлых металлов и их солей является яичный белок.
-
Если металлическая ртуть оказалась в помещении, её следует засыпать порошком серы или залить раствором хлорида железа (III).
-
Жестяная тара спаивается припоем, содержащим определённое количество свинца, поэтому консервы следует перекладывать в стеклянную посуду после её открывания.
-
Нельзя хранить и готовить пищу в декоративной посуде, так как она предназначена для украшения, а не для пищи - глазурь, которой покрыта посуда, содержит соли свинца и кадмия.
-
Вдоль дорог следует сажать только декоративные и лесные породы деревьев, а не пищевые и кормовые, так как этилированный бензин, попадая в почву, поглощается растениями, и употреблять их в пищу нельзя.
Снижение воздействия тяжёлых металлов


Учитель биологии:
Пектиновые вещества, содержащиеся в плодах яблок и корнеплодах красной свеклы, защищают организм от воздействия радиоактивных и тяжёлых металлов (свинца, стронция и др.) Сок красной свёклы способствует оздоровлению крови. Яблочный сок богат железом и, кроме того, является антиоксидантом.

По мнению специалистов хлорофитум лучше всего нейтрализует токсины: очищает воздух от формальдегида и угарного газа. Его рекомендуется выращивать на кухне
Если в горшочки с хлорофитумом положить несколько таблеток активированного угля, очистительные свойства растения заметно усилятся.
Х
 орошей способностью поглощать тяжелые металлы обладает и такое растение, как аспарагус Шпрингера.
орошей способностью поглощать тяжелые металлы обладает и такое растение, как аспарагус Шпрингера.

Такие лакомства, как мармелад и фруктовое желе, содержат пектин, вещество, являющееся желеобразным углеводом, способным выводить из организма свинец. Причем действие пектина сильнее действия лигнина, кристаллической целлюлозы или активированного угля.

Пектиновые вещества, содержащиеся в лимоне, обладают способностью выводить из организма тяжелые металлы. Пектин обладает уникальными свойствами - способностью образовывать комплексы с тяжелыми и радиоактивными элементами и выводить их из организма. Свежая кожица лимона, благодаря содержащейся горечи, считается хорошим антисептиком и очистителем кишечника и крови.
Раздаточный материал:
Название металла
Источники поступления в организм
Вызываемые заболевания
Кадмий
Поступает с промышленными отходами в реки, моря, накапливается в морских организмах, которые употребляет в пищу человек
Вызывает воспаление почек, поражает центральную нервную систему (ЦНС)
Таллий
Используют в средствах для борьбы с грызунами, в стекольной отрасли промышленности. Очень ядовит
Вызывает облысение, расстройство желудка, боли в суставах. Большие дозы вызывают летальный исход
Кобальт
Поступает в организм в виде пыли, через органы дыхания. Накапливается во внутренних органах
Вызывает острые дерматиты с появлением красных пятен, сильные отеки, кашель
Медь
В сельском хозяйстве медным купоросом обрабатывают бобовые растения, из меди изготавливают посуду
Медь накапливается в печени. При отравлении вызывает тошноту, проявляется зеленой каймой на деснах и зеленой окраской волос
Ртуть
Содержится в продуктах сгорания топлива, является загрязнителем пищевых продуктов
Поражает ЦНС, связывает белки, в результате чего нарушается клеточное дыхание. Отравление проявляется металлическим вкусом во рту, болями в желудке, тошнотой. В тяжелых случаях через 5-10 дней наступает смерть
Свинец
Вода из свинцовых труб; недоброкачественная посуда, покрытая глазурью. Содержится в выбросах металлургических предприятий и выхлопных газах автомобилей
Накапливается в организме. Ядовит. Вызывает необратимые изменения в головном мозге, онкологические заболевания
Название металла
Источники поступления в организм
Функции в организме
Натрий и калий
Основные источники калия: шпинат, огурцы, картофель, морковь, петрушка, одуванчик, чеснок, черная смородина, бананы, капуста, грейпфруты, редис, помидоры, курага, изюм, чернослив, все бобовые культуры, ржаной хлеб, крупа овсяная, киви, авокадо, брокколи, печень, молоко, ореховое масло, цитрусовые, виноград. Калия достаточно много в рыбе и молочных продуктах. Источник натрия - поваренная соль
Жизненно необходимые элементы натрий и калий функционируют в паре. Вместе с натрием калий регулирует полный баланс в организме и нормализует ритм сердца. (Калий действует внутри клеток, а натрий - в межклеточном пространстве.) Этот механизм получил название натрий-калиевого насоса
Кальций
Продукты, особенно богатые кальцием: абрикосы, смородина, виноград, крыжовник, ежевика, свекла, морковь, земляника, вишня, огурцы, апельсины, персики, ананасы, клубника, укроп, петрушка, сельдерей, лук, ботва молодой репы, фасоль зеленая, кожица всех фруктов и овощей, шпинат, одуванчик, отруби, мед, миндаль, кисломолочные продукты
Соли кальция - основной строительный материал для костей, зубов, ногтей; кальций также необходим и для работы мышц, участвует в процессах кроветворения, обмена веществ, способствует уменьшению проницаемости сосудов, препятствуя проникновению микроорганизмов в кровь. Кальций благотворно влияет на нервную систему, оказывает противовоспалительное действие
Магний
Магний содержится: в проросшей пшенице, печени, отрубях, дрожжах, большинстве растительных продуктов, бобовых культурах, яичном желтке, сыре, картофеле, зеленом горошке, рыбе, твороге, кислом молоке, сметане, капусте, свекле
Магний является биоэлементом, который эффективно действует на все, что происходит в клетках. Ион магния облегчает ход всех жизненных процессов, а недостаток магния тормозит их
Учитель химии:
Мы думаем, что эти факты просто пугающие. Как не допустить, чтобы наша голубая планета превратилась в безжизненную пустыню? Что может сделать каждый из вас, чтобы сохранить природу и здоровье человека?
Закрепление пройденного материала
Обсуждение проблемного вопроса учащимися.
Учащиеся предлагают меры борьбы с загрязнением окружающей среды:
• Не уничтожать растения, сажать больше деревьев, кустарников, трав.
• Не мусорить, следить за чистотой своего дома, двора, города, загородных территорий.
• Бережно относиться к животным.
• Проводить агитационную работу среди жителей города, создавать и реализовывать социальные проекты, направленные на информирование граждан по сохранению окружающей среды.
Еще в прошлом столетии прекрасным русским поэтом Робертом Рождественским были написаны такие строки, которыми хочется закончить урок:
(стихотворение читает учащийся)
«… Кромсаем лед,
Меняем рек теченье,
Твердим о том, что дел не впроворот.
Но мы еще придем просить прощенья
У этих вод, барханов и болот,
У самого гигантского восхода,
У самого мельчайшего малька…
Пока об этом думать неохота,
Сейчас нам не до этого пока…
Аэропорты, пирсы и перроны,
Леса без птиц и реки без воды…
Все меньше - окружающей природы,
Все больше - окружающей среды!»
Домашнее задание: $11. Составить синквейн на тему «Тяжелые металлы».
Например, синквейн о ртути:
1. Жидкость
2. Ядовитая, подвижная
3. Бегает, блестит, испаряется
4.Накапливаясь, отравляет организм человека
5.Термометр и лампочка.
Литература.
-
Габриелян О.С. Химия: 10 класс: Учебник для общеобразовательных учебных заведений. - Москва: «Дрофа», 2010.
-
Габриелян О.С. Химия: 11 класс: Учебник для общеобразовательных учебных заведений. - Москва: «Дрофа», 2010.
-
Хомченко Г.П., Хомченко И.Г. Химия для поступающих в вузы. Москва: «Издательство Новая Волна», 2005.
-
Потапов В.М. Органическая химия. Москва: «Просвещение», 1983.
-
Кузьменко Н.Е., Еремин В.В., Попков В.А. Начала химии. Москва: «Экзамен», 2001.
-
Колесов Д.В., Маш Р.Д., Беляев И.Н. Биология: 11 класс. Учебник для общеобразовательных учебных заведений. - Москва: «Дрофа», 2010.
-
Мустафин А.Г., Лагкуева Ф.К. Биология для поступающих в вузы. Москва: «Высшая школа», 2001.
-
Селевко Г.К. Энциклопедия образовательных технологий. - М., 2006.
-
Шалашова М.М. К методике оценивания химических компетенций. Химия в школе. - 2010. - №8. - с. 115 - 126.
-
Педагогическая рабочая матрица проекта «Лестница учебных достижений».
22