- Учителю
- Урок 'Химическое равновесие и условия его смещения' (9 класс)
Урок 'Химическое равновесие и условия его смещения' (9 класс)
Конспект урока
"Химическое равновесие и условия его смещения"
Романцева Т.В.
учитель химии
Цель урока: формирование представлений учащихся о химическом равновесии, условиях его смещения.
Задачи:
Образовательные: дать понятия об обратимости химических реакций, о химическом равновесии. Формировать умение применять знания о закономерностях смещения химического равновесия.
Развивающие: развивать умение устанавливать причинно-следственные связи, развивать познавательный интерес к предмету и творческую активность.
Воспитательные: воспитывать личные качества учащихся: коммуникативность, самостоятельность.
Коррекционные: развивать грамотную речь, расширять словарь учащихся, корректировать произношение сложных химических терминов.
Реактивы: хлорид железа (III), роданид аммония, крахмальный клейстер, йод.
Тип урока: изучение нового материала.
Ход урока
1. Организационный момент.
Приветствие.
Определение отсутствующих.
Проверка готовности учащихся к уроку.
2. Мотивация и актуализация знаний.
Начинается наш урок, эпиграф к которому звучит так: "Ум заключается не только в знании, но и в умении прилагать знание на деле". (Аристотель).
Мы ещё вернёмся к этому эпиграфу, и вы сами сможете объяснить, почему именно его я взяла, чтобы озаглавить наш урок. А на уроке мы будем говорить о химических реакциях.
Самое интересное в окружающем нас мире - это то, что он очень сложно устроен, и к тому же постоянно изменяется. Каждую секунду в нём происходит множество химических реакций, образуется множество химических веществ.
Фронтальный опрос.
-
В чём суть химических реакций?
- Каковы условия, необходимые для возникновения химических
реакций?
- Перечислите признаки химических реакций?
- Дайте определение скорости химической реакции.
- Что является гомогенной и гетерогенной реакциями?
- Какие реакции относят к экзотермическим, а какие
к эндотермическим?
- От каких факторов зависит скорость химической реакции?
3. Вводная информация учителя и формирование цели урока.
Сегодня на уроке мы познакомимся с новым понятием "химическое равновесие". Понятие это имеет очень большое значение, как для химии, так и для химической технологии. Знание о химическом равновесии необходимы для предсказания условий, при которых можно осуществлять химические превращения, а так же помогут добиться максимального выхода продукта реакции. (слайд 1)
Итак, давайте вместе сформулируем цель нашего занятия.
Цель урока: изучить химическое равновесие и условия его смещения. (слайд 2)
4.Изучение нового материала.
Большинство химических реакций может протекать в двух противоположных направлениях, т.е. являются обратимыми.
Откроем учебник (Кузнецова Н.Е., Титова И.Н., Гара Н.Н., Химия 9 класс) параграф 2. Найдите в тексте определение, какие реакции называют обратимыми. (слайд 3)
(
 Обратимыми - называются реакции, которые протекают при данных условиях одновременно в двух противоположных направлениях - прямом и обратном). В уравнениях обратимых реакций используют знак обратимости ( ).
Обратимыми - называются реакции, которые протекают при данных условиях одновременно в двух противоположных направлениях - прямом и обратном). В уравнениях обратимых реакций используют знак обратимости ( ).
Примером обратимой реакции может служить синтез йодоводорода из водорода и йода:
H
 2 (г) + I2(г) 2HI(г)
2 (г) + I2(г) 2HI(г)
(слайд 4)
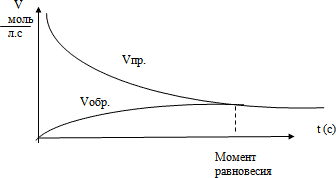
Скорость прямой реакции (V1) вначале максимальна, а скорость обратной (V2) - равняется нулю. Концентрация реагирующих веществ с течением времени уменьшается, а концентрация продуктов реакции увеличивается. Поэтому скорость прямой реакции уменьшается, а скорость обратной реакции увеличивается. В определённый момент времени скорости прямой и обратной реакций становятся равными (V1=V2).
Это означает, что реакция достигла состояния равновесия.
Отметим, что понятие равновесие можно использовать только по отношению к закрытой системе.
Запишем определение: состояние обратимой реакции, при котором скорость прямой реакции равна скорости обратной реакции, называется химическим равновесием. (слайд 5)
Е
 сли записать реакцию, в которой наступило равновесие, в общем виде следующим образом: aA + bB cC + dD,
сли записать реакцию, в которой наступило равновесие, в общем виде следующим образом: aA + bB cC + dD,

То равновесие можно охарактеризовать через константу равновесия K. Эта величина показывает соотношение между концентрациями продуктов реакции (числитель) и исходных веществ (знаменатель), которое устанавливается при равновесии.
Если константа равновесия больше единицы, что это значит? (Значит, на момент установления равновесия большая часть исходных веществ превратилась в продукт).
Вы часто встречались с механическим равновесием. Приведите примеры. (Весы в состояния равновесия, маятник).
В отличие от механического равновесия, при котором всякое движение прекращается, при химическом равновесии обе реакции (прямая и обратная) продолжают идти, но скорости их равны, и поэтому никакие изменения в системе не происходят. Если изменение условий не происходит, то состояние равновесия может продолжаться бесконечно долго. По вашему мнению, можно ли сместить химическое равновесие? Как вы предлагаете это делать?
Химическое равновесие легко нарушить. Изменяя определённые условия можно добиться смещения химического равновесия. При этом скорости прямой и обратной реакций становятся не одинаковыми.
Направление смещения равновесия определяется принципом, который был сформулирован французским учёным Ле Шателье: Если на равновесную систему оказывается внешнее воздействие, то равновесие смещается в сторону той реакции, которая противодействует этому воздействию. (слайд 6)
Факторы, которые могут приводить к смещению химического равновесия:
А) Концентрация реагирующих веществ.
Б
) Температура.
В) Давление.
Рассмотрим влияние этих факторов более подробно.
Влияние концентрации реагирующих веществ.
Повышение концентрации исходных веществ смещает равновесие в сторону прямой реакции, понижение - в сторону обратной реакции.
Демонстрация опыта. В качестве равновесной системы используется реакция образования роданида железа (III) из хлорида железа (III) и роданида аммония.
F eCI3 + 3NH4CNS Fe(CNS)3 + 3NH4CI
eCI3 + 3NH4CNS Fe(CNS)3 + 3NH4CI
Признаком, указывающим на смещение равновесия в ту или иную сторону, служит изменение интенсивности окраски раствора, обусловленной концентрацией роданида железа (III).
Проводим реакцию. Содержимое делим на две части. В один стакан добавляем 10 мл. исходного 0.1М раствора хлорида железа (III).Наблюдаем увеличение интенсивности окраски. Вопрос к классу "почему"? Во второй стакан добавляем 20мл. насыщенного раствора хлорида аммония. Анализируем, почему идёт ослабление окраски.
Влияние температуры.
При нагревании системы равновесие смещается в сторону эндотермической реакции; при охлаждении в сторону экзотермической реакции.
Демонстрация опыта. В две пробирки крахмального клейстера добавляем две капли йода. Появляется синий цвет.
К рахмал + I2 вещество синего цвета
рахмал + I2 вещество синего цвета
При нагревании пробирки окраска исчезает. Почему? В какую сторону смещается равновесие. При понижении температуры (охлаждаем пробирку) окраска проявляется. Почему? Куда смещается равновесие.
Какой знак теплового эффекта отвечает данной реакции?
Влияние давления.
Давление влияет на равновесие реакций, в которых принимают участие газообразные вещества. При увеличении давления равновесие смещается в сторону меньшего объема, при уменьшении давления равновесие смещается в сторону большего объема.
Так для увеличения выхода аммиака необходимо повышать давление в системе. Если внешнее давление повышается, то равновесие смещается в сторону той реакции, при которой число молекул газа уменьшается.
N
 2(г) + 3H2(г) 2NH3(г)
2(г) + 3H2(г) 2NH3(г)
Если же реакция протекает без изменения числа молекул газообразных веществ, то давление не влияет на равновесие в данной системе.
Как вы думаете, катализатор может повлиять на смещение химического равновесия?
Использование катализатора, приводящего к ускорению данной обратимой реакции, никак не влияет на состояние равновесия.
5. Закрепление нового материала. А сейчас мы вернёмся к эпиграфу нашего урока и постараемся полученные знания использовать при решении заданий.
Задание №1 (решаем, рассуждаем совместно).
Какой знак теплового эффекта, отвечающего процессу растворения кислорода в воде? Учитывайте тот факт, что с нагреванием растворимость кислорода в воде снижается.
O
 2 + вода водный раствор кислорода
2 + вода водный раствор кислорода
Задание №2 (решаем совместно).
При термическом разложении карбоната кальция может установиться равновесие. В каком направлении оно будет смещаться при повышении температуры?
З адание №3 (самостоятельная работа). (слайд 7)
адание №3 (самостоятельная работа). (слайд 7)
Используя принцип Ле Шателье, определите в какую сторону сместится химическое равновесие при повышении или понижении температуры, давления, и концентрации
![]()
Учащиеся решают самостоятельно, затем осуществляют самоконтроль, опираясь на материал слайда. (слайд 8)
6. Подведение итогов.
Что нового и интересного вы узнали на данном уроке?
П
 очему нужно знать способы смещения химического равновесия?
очему нужно знать способы смещения химического равновесия?
В каких областях эти знания необходимы?
7. Рефлексия. Выставление оценок.
8. Домашнее задание. Параграф 2, знать основные понятия, внимательно прочитать выводы. Задача: укажите знак теплового эффекта растворения азота в воде (при нагревании растворимость азота в воде уменьшается). (слайд 9)
Литература, используемая при составления конспекта урока:
Бердоносов С.С., Менделеева Е.А. Материалы курса "Особенности содержания и методики преподавания избранных тем курса химии 8-9-х классов" -М.: Пед.университет "Первое сентября", 2006.
Кушнарев А.А. Экспресс - курс по неорганической химии с примерами, задачами, реакциями. 8-9 классы - М.: Школьная пресса, 2002.
Химия. Пособие - репетитор для поступающих в вузы. /Под ред. Егорова - Ростов н/Д, Феникс, 2003
Химия. Базовый уровень. Книга для учителя./ Под ред. О.С. Габриелян и др. - М.: Дрофа, 2009.