- Учителю
- Лекция по курсу Химия на тему: Химическая связь и строение молекул
Лекция по курсу Химия на тему: Химическая связь и строение молекул
доц. Гарибян Ирина Ивановна
Лекция 3
Тема: «ХИМИЧЕСКАЯ СВЯЗЬ И СТРОЕНИЕ МОЛЕКУЛ»
План:
-
Теория химического строения А.М.Бутлерова
2.
Общее представление о химической связи
3.
Типы химической связи: ионная, ковалентная, металлическая, межмолекулярное взаимодействие, электростатическое взаимодействие молекул (ориентационное, индукционное, дисперсионное), донорно- акцепторное взаимодействие молекул, водородная связь
Крупным шагом в развитии представлений о строении молекул явилась теория химического строения, выдвинутая в 1861 г. выдающимся химиком А.М.Бутлеровым.
Основные положения:
1. Атомы в молекулах соединены друг с другом в определённой последовательности. Изменение этой последовательности приводит к образованию нового вещества с новыми свойствами.
2. Соединение атомов происходит в соответствии с их валентностью.
3. Свойства веществ зависят не только от того, какие атомы и в каком количестве они входят в состав молекулы, но и от их химического строения, т.е. от порядка соединения атомов в молекулах и характера их взаимного влияния.
Из теории Бутлерова вытекает возможность изображать строение молекул в виде структурных формул, в которых указана последовательность соединения атомов друг с другом, а каждая чёрточка, соединяющая атомы, обозначает валентности.
Например,
НCl CO2 A2O3
Н - Cl O = C = O O = Al - O - Al = O
соляная кислота оксид углерода (IV) оксид алюминия
H2SO4 H3PO4
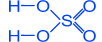
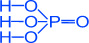
серная кислота ортофосфорная кислота
Учение о химической связи - центральная проблема современной химии. Без знания природы взаимодействия атомов в веществе нельзя понять причины многообразия химических соединений, представить механизм их образования, их состав, строение и реакционную способность.
● Химическая связь - взаимодействие атомов, приводящее к образованию молекул, ионов, радикалов, кристаллов.
Чем прочнее химическая связь, тем больше энергии нужно затратить для её разрыва.
В зависимости от характера распределения валентных электронов в веществе основными типами химических связей, отличающихся друг от друга электронным строением и механизмом взаимодействия связываемых атомов, являются ковалентная и ионная связи. Тип связи в значительной степени определяется разностью электроотрицательностей элементов, участвующих в ее образовании:
∆ЭО = ЭО(A) - ЭО (B),
где ЭО(A) и ЭО(B) - электроотрицательности атомов А и В.
Основные типы химических связей:
● Ионная связь - образуется при взаимодействии атомов элементов, электроотрицательность которых резко отличается.
При этом происходит переход электронов от атома с меньшей электроотрицательностью к атомам с большей электроотрицательностью. Ионная связь образуется между атомами, имеющими разность ∆ЭО > 1,7;
В качестве примера рассмотрим схему образования молекулы фторида натрия. Атомы натрия и фтора, из которых образовалось это соединение, резко отличаются по электроотрицательности: для атома натрия она равна 0,9, для атома фтора она равна 4,0, её разность равна:
ΔЭО = 4,0 (F) - 0,9 (Na) = 3,1
Как видно из электронных формул:
+11Na 1s22s22p63s1 +9F 1s22s22p5
атомы этих элементов с незавершёнными внешними энергетическими уровнями.
+ -
Na0 + F0 ® NaF ) ) ) + ) )
атом атом молекула 2 8 1 2 7
Последний электрон в атоме натрия связан не очень сильно. С другой стороны, атом фтора имеет на последнем слое семь электронов и до завершения внешнего слоя ему легче присоединить один электрон. Действительно, если атом натрия и атом фтора близко подходят друг к другу, то последний электрон натрия может перейти к атому фтора, в результате чего образуется молекула фторида натрия, состоящая из положительного иона натрия и отрицательного иона фтора, испытывающих притяжение друг к другу.
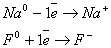
Атомы, которые полностью отдают свои валентные электроны, превращаются в положительно заряженные ионы - катионы, а которые приобретают - в отрицательно заряженные ионы - анионы. Отсюда вытекает, что ионная связь осуществляется в результате электростатического взаимодействия противоположно заряженных ионов.
Ионные соединения образуют атомы элементов главных подгрупп I и II групп с элементами главных подгрупп VI, VII групп, т.е. она характерна между атомами металлов и неметаллов, при этом электроны перемещаются из внешнего слоя металлов во внешний слой неметаллов. Например, CsF, NaBr, K2O, Li3N, BaCI2 .
• Химическая связь, образованная за счёт общей электронной пары двух атомов, называется ковалентной связью.
Электроны образуют пары при условии, если они имеют противоположные спины. Спаривание электронов с противоположными спинами связано с тем, что в пространство, занимаемое «облаком» одного электрона, проникает «облако» другого электрона. В результате перекрывания в пространстве между ядрами соединяющихся атомов возникает область повышенной электронной плотности, а это приводит к сближению ядер и установлению связи между атомами.
Различают две разновидности ковалентной связи:
а) в случае неполярной ковалентной связи электронное облако, образованное общей электронной парой электронов, распределяется в пространстве симметрично относительно ядер обоих атомов. ЭО обоих атомов практически одинакова (0,4 >ΔЭО = 0).
Пример: двухатомные молекулы - Н2 (H - H), СI2 (Cl - Cl), O2, N2.
Н2 Cl2
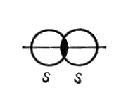
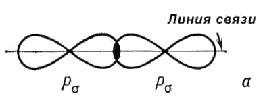
В данном случае ковалентная связь между атомами образуется при перекрывании атомных орбиталей, например 1s-орбиталей при образовании связи H−H, 2p-орбиталей при образовании связи Cl− Cl.
б) в случае полярной ковалентной связи - электронное облако связи смещено в сторону более электроотрицательного атома.
Например, образование молекулы хлороводорода HCI можно представить схемой:
 H
Cl
H
Cl
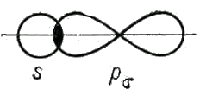
Здесь ковалентная связь образуется при перекрывании атомных орбиталей: 1s-орбитали атома H и 3p-орбитали атома Cl. Общая электронная пара смещена в сторону атома хлора.
Химическая связь тем полярнее и прочнее, чем больше различие в значениях по абсолютной величине относительных электроотрицательностей атомов, между которыми она образована..
В металлах связь металлическая.
С точки зрения строения атома, большинство металлов характеризуются небольшим числом электронов на внешнем энергетическом уровне, т.е. число вакантных орбиталей в них значительно больше числа вакантных электронов. Все металлы в твёрдом состоянии имеют металлическую кристаллическую решётку. При её образовании атомы начинают перекрываться. Валентный электрон может при этом относительно свободно перемещаться с орбитали своего атома на свободную, и близкую по энергии, орбиталь соседних атомов. Потеряв электрон, исходный атом превращается в катион.
Связь в металлах и сплавах, обусловленная взаимодействием относительно свободных электронов с катионами в узлах кристаллической решётки, называют металлической
Металлическая связь характерна для металлов, как в твёрдом (AI), так и в жидком состоянии (Hg). Особый тип связи в металлах и сплавах определяет все их общие физические свойства: электропроводность, теплопроводность, пластичность, металлический блеск. Все металлы являются электрическими проводниками первого рода, т.е. обладают электронной проводимостью. Их электропроводность с увеличением температуры уменьшается, так как в результате тепловых колебаний атомов в узлах кристаллической решетки сопротивление направленному движению электронов возрастает.
Металлы обладают пластичностью, т.е. способны без разрушения изменять свою форму под действием силы. Многие из них имеют высокие температуры плавления и кипения.
● Водородная связь возникает между атомом водорода и сильно электроотрицательными элементами (например, фтором, кислородом или азотом) другой молекулы (Н2О, НF).
Водородные связи характерны для таких веществ, как вода H2O, аммиак NH3, фтороводород HF. В качестве примера рассмотрим образование водородной связи между двумя молекулами воды. Связи О-Н в Н2О имеют заметный полярный характер с избытком отрицательного заряда δ- - на атоме кислорода. Атом водорода, наоборот, приобретает небольшой положительный заряд δ+ и может взаимодействовать с неподелёнными парами электронов атома кислорода соседней молекулы воды. Схематически водородную связь обозначают точками.
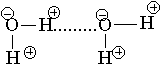
Атом водорода, связанный с сильно электроотрицательным элементом (азотом, кислородом, фтором и др.), испытывает недостаток электронов и поэтому способен взаимодействовать с неподелённой парой электронов другого электроотрицательного атома этой же или другой молекулы. Или, например, молекула HF:
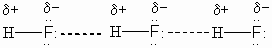
Это примеры образования межмолекулярных водородных связей. Водородные связи малоустойчивы и разрываются довольно легко, их наличием объясняются более высокие температура кипения и температура плавления веществ (в HF, H2O и NH3 есть водородная связь, а в HCI и H2S её нет). Водородная связь характерна для многих органических соединений (фенолов, карбоновых кислот, белков, нуклеиновых кислот и др.).
Донорно - акцепторное взаимодействие молекул. Если одна из молекул имеет неподелённые пары электронов (донор), а другая - свободные орбитали (акцептор), то между ними возможно донорно - акцепторное взаимодействие.
Рассмотрим образование химической связи по донорно - акцепторному механизму при взаимодействии молекулы аммиака с ионом водорода молекулы хлороводорода. Так, аммиак, соединяясь с хлороводородом, образует хлорид аммония: NH3 + HCI = NH4CI
Атом азота имеет на внешнем энергетическом уровне пять электронов 2s22p3 , два спаренных и три неспаренных электрона:
2s2 2p3


7N ¯
Из электронной структуры молекулы аммиака видно, что у атома азота остаётся одна пара электронов (2s2), не участвующая в образовании химической связи. Это так называемая неподелённая пара электронов. За счёт этой пары появляется возможность образования новой химической связи между атомом азота в молекуле аммиака и иона водорода, у которого 1s- орбиталь свободна. Схема образхования иона аммония NH4+
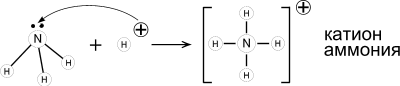
Атом азота молекулы аммиака является донором, а ион водорода - акцептором.
Этот тип связи имеет место в комплексных соединениях.
Контрольные вопросы:
-
</