- Учителю
- Сера и ее соеднения
Сера и ее соеднения
Урок 20: Сера и ее соединения. Аллотропия, сероводород, оксиды серы (IV, VI)
Цель: рассмотреть вещество «сера», аллотропию серы, ознакомиться с физическими и химическими свойствами серы.
Задачи:
а) Рассмотреть положение элемента серы в ПСХЭ Д.И.Менделеева, строение атома; аллотропные видоизменения серы; физические и химические свойства; применение серы и ее соединений человеком.
б) Развивать интеллектуальные и познавательные умения учащихся добывать самостоятельно знания, обобщать и делать выводы, фиксировать главное в свернутом виде.
в) Содействовать воспитанию организованности учащихся при решении проблемных вопросов.
Тип урока: урок изучения нового материала
Формы организации познавательной деятельности: фронтальная, групповая
Ход урока:
I.Орг.момент
II.Проверка домашнего задания
1.Рассказать о положение неМе в ПСХЭ и особенности их строения.
2.Общие физические и химические свойства неМе
III. Изучение нового материала
Химический символ - S
Порядковый номер - 16
Относительная атомная масса - 32
Электронная формула строения атома - 1s22s22p63s23p4. (Слайд 3)
Сера расположена в главной подгруппе VI группе, в 3 - м периоде.
Строение атома серы
Размещение электронов по уровням и подуровням
Основное состояние
1s22s22p63s23p4
Размещение электронов по орбиталям (последний слой)
Степень окисления
Валентность
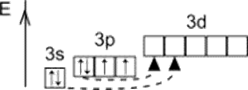
+2, -2
В основном состоянии
II
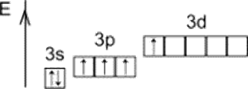
+4
Первое возбуждённое состояние
IV
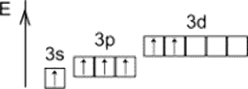
+6
Второе возбуждённое состояние
VI
Физические свойства и нахождение в природе изучить самостоятельно
Аллотропия.
Для серы характерны несколько аллотропных модификаций:
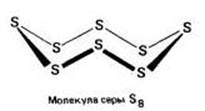
Ромбическая (a - сера) - S8
t°пл. = 113°C; ρ = 2,07 г/см3.
Наиболее устойчивая модификация.
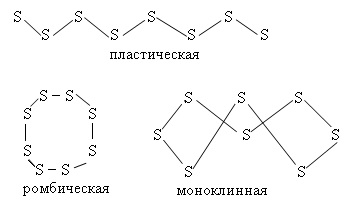
Моноклинная (b - сера) - S8
темно-желтые иглы,
t°пл. = 119°C; ρ = 1,96 г/см3.
Устойчивая при температуре более 96°С;
при обычных условиях превращается в ромбическую.
Пластическая Sn
коричневая резиноподобная (аморфная) масса.
Неустойчива, при затвердевании превращается в ромбическую.

Получение серы.
1. Промышленный метод - выплавление из руды с помощью водяного пара.
2. Неполное окисление сероводорода (при недостатке кислорода):
2H2S + O2 = 2S + 2H2O
Химические свойства серы:
Сера - окислитель
S0 + 2ē S-2
Сера - восстановитель
S - 2ē S+2; S - 4ē S+4; S - 6ē S+6
1) Сера реагирует со щелочными металлами без нагревания:
2Na + S Na2S ОПЫТ
c остальными металлами (кроме Au, Pt) - при повышенной t:
Cu + S -tCuS ОПЫТ</</p>
2) С некоторыми неметаллами сера образует бинарные соединения:
H2 + S H2S
2P + 3S P2S3
C + 2S CS2
1) c кислородом:
S + O2 -t S+4O2
2) c галогенами (кромейода):
S + Cl2 S+2Cl2
3) c кислотами - окислителями:
S + 2H2SO4(конц) 3S+4O2 + 2H2O
S + 6HNO3(конц) H2S+6O4 + 6NO2 + 2H2O
Реакции диспропорционирования:
4) 3S + 6KOH 2K2S+4 + K2SO3 + 3H2O
Важнейшие соединения серы.
Сероводород.
Сера, взаимодействует с водородом, образует газообразное соединение - сероводород H2S. Степень окисления серы в сероводороде равна -2.
Физические свойства. Сероводород - ядовитый, бесцветный газ с характерным запахом гниющего белка, плохо растворяется в воде.
Получение. В лаборатории сероводород получают при взаимодействии сульфида железа с разбавленной соляной кислотой:
FeS + 2HCl = H2S +FeCl2
Химические свойства. Сероводород - горючий газ. Он горит на воздухе голубоватым пламенем. При полном сгорании образуется сернистый газ SO2:
2H2S + 3O2 = 2H2O + 2SO2
При неполном горение образуется элементарная сера:
2H2S + O2 = 2H2O + 2S
Раствор сероводорода взаимодействует с растворимыми основаниями и солями:
H2S + 2NaOH = 2H2O + Na2S
Для распознавания сероводорода и его солей служит реактив нитрат свинца:
H2S + Pb(NO3)2 =
2HNO2 + PbS
в результате реакции выпадает черный осадок - сульфида свинца.
IV.Самостоятельная работа учащихся
Изучить оксиды серы и составить опорный конспект
V.Закрепление:
Напишите уравнения реакций
S → SO2 → SO3 → H2SO4 → CaSO4
MgS
S + O2 = SO2 2SO2 + O2 = 2SO3 SO3 + H2O = H2SO4
H2SO4 + Ca(OH)2 = CaSO4 + 2H2 S + Mg = MgS
VI.Домашнее задание:§