- Учителю
- Урок по химии« классификация химических реакций», 11 класс
Урок по химии« классификация химических реакций», 11 класс
Тема урока. Классификация химических реакций.
Цель:
Организовать деятельность учащихся по обобщению и систематизации знаний по теме классификация химических реакций;
создавать на уроке условия для самоопределения каждого учащегося для проявления им своей индивидуальности и эмоционального восприятия материала урока;
содействовать развитию у учащихся умений классифицировать химические реакции, а так же на основе анализа учебного материала делать выводы;
содействовать воспитанию интереса к предмету.
Задачи.
Образовательные
Способствовать формированию учебно-познавательных, образовательных компетенций, формированию умений проводить химические эксперименты с соблюдением правил техники безопасности, наблюдать за реакциями.
Воспитательные.
Способствовать формированию коммуникативной, общекультурной компетентности.
Развивающие.
Способствовать развитию памяти, внимания, мышления, речи.
Способствовать формированию материалистической картины мира.
Оборудование: дидактические карточки для опроса учащихся; карточки с химическими реакциями, таблица «Периодическая система химических элементов Д.И.Менделеева», компьютер, мультимедийный проектор, реактивы, пробирки, спиртовки, спички, штативы для пробирок.
Реактивы: КМnO4, СuSO4, Fe.
Литература:
Учебник О.С.Габриелян, «Химия», Базовый уровень, 11 класс 2012г
Электронное приложение к учебнику О.С.Габриелян, «Химия», Базовый уровень, 11 класс 2012г
Химия. 8-11 классы. Методические рекомендации и рабочая программа к линии УМК О. С. Габриеляна
Интернет ресурсы:
Межпредметные связи ( биология: химические реакции в организме человека), связь с профессией.
Планируемые результаты урока.
-
Студенты должны знать типы химических реакций.
-
Определять тип химической реакции по уравнению.
-
Составлять уравнения химических реакций.
Тип урока: комбинированный
Педагогическая технология.
Образовательные, воспитательные, здоровьесберегающие, информационно-коммуникационные
Методы и приёмы.
1.Словесный (фронтальный опрос, рассказ, беседа, объяснение)
2.Наглядный (проектор, презентация, демонстрационный опыт, таблица «Периодическая система химических элементов Д.И.Менделеева», дидактические карточки, раздаточный материал)
3.Практический (работа с учебником, таблицей ПС, выполнение проверочной работы, составление опорного конспекта в рабочих тетрадях, опережающее задание - выполнение опыта)
Форма работы: индивидуальная, групповая, фронтальная
Ход урока
-
Организационный момент.
-
Разминка
III. Проверка знаний учащихся. (Уплотнённый опрос)
IV. Актуализация знаний
V. Изучение новой темы.
VI. Рефлексия.
VII. Домашнее задание.
Ход урока
-
Организационный момент.
(На уроке студенты осуществляют самоконтроль своей работы, взаимоконтроль, заполняя листы самоконтроля)
-
Разминка.
-
Проверка домашнего задания.
- Работа по карточкам
- Экспресс - опрос
- Выполнение проверочной работы
- Взаимопроверка в парах
-
Изучение нового материала.
Постановка темы урока совместно со студентами
В окружающем нас мире протекает огромное число реакций. Ежесекундно в организме человека происходят сотни и тысячи всевозможных реакций. В печени человека протекает 20 000 000
химических реакций.
Как же удержать в памяти многообразие химических процессов, как практически ориентироваться в них?
Предполагаемый ответ. Классифицировать, объединить, группировать.
Запись темы урока. «Классификация химических реакций»
Студенты знакомятся с планом урока.
План.
1. Признаки классификации химических реакций
2. Классификация химических реакций
Целеполагание.
Познакомьтесь с планом урока и назовите цель урока.
Ответы студентов
У.- Как же учёным - химикам удается ориентироваться в огромном количестве химических реакций? (создание проблемной ситуации)
Актуализация знаний.
-У- Что такое реакция?
Термин «реакция» с латыни означает «противодействие», «отпор», «ответное действие»
-У- Что такое «химическая реакция»?
У. -В любой науке применяется прием классификации, позволяющий по общим признакам разделить все множество объектов на группы.
При изучении курсов неорганической и органической химии мы изучили множество химических реакций. Какие признаки могут быть выделены при классификации химических реакций?
Ответ учащихся:
1) количество и состав исходных веществ и продуктов реакции;
2) изменение степени окисления;
3) тепловой эффект;
4) участие катализаторов;
5) обратимость реакции;
6) исходное состояние реагирующей системы;
7) механизм химической реакции (для органических веществ).
Учитель. Рассмотрим 1 классификацию. Количество и состав исходных и конечных веществ
Работа с учебником. § 14
Задание студентам. Назвать какие реакции называются реакциями соединения?
Студент: Реакция разложения АВ=А+В+…
Реакции, при которых из одного вещества, образуется несколько называются реакциями разложения.
Демонстрация опыта учителем: 2КМnO4=K2MnO4+MnO4+O2
- Закрепление. Из раздаточного материала выбрать примеры реакций разложения.
Задание студентам. Назвать какие реакции называются реакциями разложения?
2 студент: Реакции, при которых из нескольких веществ , образуется одно, называются реакциями соединения.
Реакция соединения А+В=АВ (Запись в тетрадь)
Просмотр видео
- Закрепление. Из раздаточного материала выбрать примеры реакций соединения.
5.Физкульт минутка. Давайте дадим глазам отдохнуть и сделаем небольшую зарядку для глаз: посмотрите наверх, вниз, направо, налево, закройте глаза. Продолжим…
Задание студентам. Назвать какие реакции называются реакциями замещения?
3 студент: Реакция замещения АВ +С=А+СВ
Реакции, при которых простое вещество замещает один из элементов в сложном называются реакциями замещения.
Демонстрация подготовленного опыта студентами.
- Закрепление. Из раздаточного материала выбрать примеры реакций замещения.
Задание студентам. Назвать какие реакции называются реакциями обмена?
4 ученик: Реакция обмена АВ +СD=АD+СВ
Реакции, при которых вещества обмениваются своими составными частями , называются реакциями обмена.
СuSO4+2NaOH=Cu(OH)2+Na2SO4
- Закрепление. Из раздаточного материала выбрать примеры реакций обмена.
6.Рефлексия. Заполнение схемы
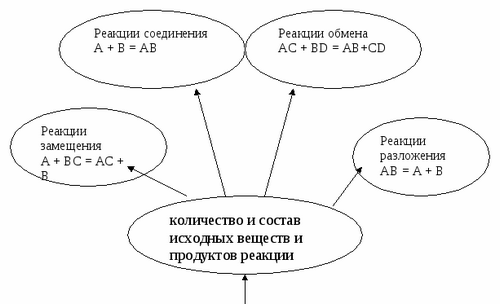

Вывод.
Таким образом классификация химических реакций помогает учёным в изучении науки химия.
Домашнее задание. § 14
Приложение к конспекту урока.
Задание. Определите тип реакций.
1). P + Cl2 = PCl5
2). CH4 = C + H2
3). Na + S = Na2S
4). HCl + Mg = MgCl2 + H2
5). ZnSO4 + KOH = K2SO4 + Zn(OH)2
6). BaCl2 + Na2SO4 = BaSO4 + NaCl
7). AlCl3 + NaOH = NaCl + Al(OH)3
8). Fe(OH)3 = Fe2O3 + H2O
9). H2SO4 + Al = Al2(SO4)3 + H2
10). P2O5 + Na2O = Na3PO4
11). 2HgO=2Hg+O2
12). 2Аl+6HCl=3H2+2AlCl3
Проверочная работа
Вариант№1
Задание 1. Распределить формулы веществ по классам неорганических веществ : BaCl2 , Na2O, KOH, HCl, HgO, Na2SO4, Al(OH)3, H3РO4
-
Кислоты:
-
Основания:
-
Соли:
-
Оксиды:
Задание 2. Расставить коэффициенты в уравнении реакции
1. AlCl3 + NaOH = NaCl + Al(OH)3
Проверочная работа
Вариант№2
Задание 1. Распределить формулы веществ по классам неорганических веществ : Zn(OH)2, Fe2O3, H2СO3, MgCl2, СuO, Na2SO4, NaOH, H2SiO3
-
Кислоты:
-
Основания:
-
Соли:
-
Оксиды:
Задание 2. Расставить коэффициенты в уравнении реакции
1. ZnSO4 + KOH = K2SO4 + Zn(OH)2
Проверочная работа
Ответы.
Вариант №1
1. Кислоты: HCl, H3РO4 1 балл
2. Основания: KOH, Al(OH)3 1 балл
3. Соли: BaCl2, Na2SO4 1 балл
4. Оксиды: Na2O, HgO 1 балл
AlCl3 + 3NaOH = 3NaCl + Al(OH)3 1 балл
Вариант №2
1. Кислоты: H2СO3,H2SiO3 1 балл
2. Основания: Zn(OH)2, NaOH 1 балл
3. Соли: MgCl2, Na2SO4 1 балл
4. Оксиды: Fe2O3, СuO 1 балл
ZnSO4 + 2KOH = K2SO4 + Zn(OH)2 1 балл
Проверочная работа
Ответы.
Вариант №1
1. Кислоты: HCl, H3РO4 1 балл
2. Основания: KOH, Al(OH)3 1 балл
3. Соли: BaCl2, Na2SO4 1 балл
4. Оксиды: Na2O, HgO 1 балл
AlCl3 + 3NaOH = 3NaCl + Al(OH)3 1 балл
Вариант №2
1. Кислоты: H2СO3,H2SiO3 1 балл
2. Основания: Zn(OH)2, NaOH 1 балл
3. Соли: MgCl2, Na2SO4 1 балл
4. Оксиды: Fe2O3, СuO 1 балл
ZnSO4 + 2KOH = K2SO4 + Zn(OH)2 1 балл
Лист самоконтроля
Ф.И.
№
Этап урока
Количество баллов
1
Проверка домашнего задания
2
Изучение новой темы
3
Итог
Лист самоконтроля
Ф.И.
№
Этап урока
Количество баллов
1
Проверка домашнего задания
2
Изучение новой темы
3
Итог
Лист самоконтроля
Ф.И.
№
Этап урока
Количество баллов
1
Проверка домашнего задания
2
Изучение новой темы
3
Итог
Карточка№1
Задание. Закончить уравнение реакций и расставить коэффициенты
BaO + HCl =
MqO + H2O =
Карточка№2
Задание. Закончить уравнение реакций и расставить коэффициенты
Fe(OH)3 + HCl =
SO3 +H2O =
Карточка№3
Задание. Закончить уравнение реакций и расставить коэффициенты
CuO + H2SO4 =
CaO + CO2 =
Карточка№1
Задание. Закончить уравнение реакций и расставить коэффициенты
BaO + HCl =
MqO + H2O =
Карточка№2
Задание. Закончить уравнение реакций и расставить коэффициенты
Fe(OH)3 + HCl =
SO3 +H2O =
Карточка№1
BaO + 2HCl = BaCl2 + H2O
MqO + H2O = Mq(OH)2
Карточка№2
Fe(OH)3 + HCl = FeCl3 + 3H2O
SO3 +H2O = H2SO4
Карточка№3
CuO + H2SO4 = CuSO4 + H2O
CaO + CO2 = CaCO3