- Учителю
- Урок химии в 10 классе «Производство серной кислоты контактным способом»
Урок химии в 10 классе «Производство серной кислоты контактным способом»
Предмет: химия
Класс: 10
Тема урока: Производство серной кислоты контактным способом.
Цель урока: Формирование функциональной грамотности по естественнонаучным знаниям.
КЛАСС: технология
Подкласс: Отходы.
Цель урока: Выявить основные возможные экологические проблемы при сернокислотном производстве. Предложить возможные пути их решения.
Учебные задания
1-ый уровень
Учитель
Ученики
Тема урока «Производство серной кислоты контактным способом».
О чем пойдет речь? Давайте составим вопросы, по которым необходимо провести урок.
-
Основные этапы производства.
-
Постановка проблем экологического характера, пути их решения.
-
Привести конкретные примеры ситуаций на производстве, предложить их решение с химической точки зрения (работа в группах).
-
Обобщить и сделать выводы.
2-ой уровень
Учитель
Ученик
2. Рассмотрите схему сернокислотного производства контактным способом;
запишите в тетради основные этапы производства, реакции, происходящие при этом, отметьте виды сырья.
Стадия
Процессы
1.Обжиг пирита, Получение оксида серы (II). Очистка печного газа.
Уравнение реакции первой стадии:
4FeS2 + 11O2![]() 2Fe2O3 + 8SO2 + Q
2Fe2O3 + 8SO2 + Q
Измельчённый очищенный влажный (после флотации) пирит сверху засыпают в печь для обжига в "кипящем слое". Снизу (принцип противотока) пропускают воздух, обогащённый кислородом, для более полного обжига пирита. Температура в печи для обжига достигает 8000С. Пирит раскаляется до красна и находится в "подвешенном состоянии" из-за продуваемого снизу воздуха. Похоже это всё на кипящую жидкость раскалённо-красного цвета.
Очистка печного газа
Из печи выходит печной газ, состав которого: SO2, O2, пары воды (пирит был влажный!) и мельчайшие частицы огарка (оксида железа). Такой печной газ необходимо очистить от примесей твёрдых частиц огарка и паров воды.
Очистка печного газа от твёрдых частичек огарка проводят в два этапа - в циклоне (используется центробежная сила, твёрдые частички огарка ударяются о стенки циклона и ссыпаются вниз) и в электрофильтрах (используется электростатическое притяжение.
Осушку печного газа проводят в сушильной башне - снизу вверх поднимается печной газ, а сверху вниз льётся концентрированная серная кислота. На выходе из сушильной башни печной газ представляет собой смесь оксида серы SO2 и кислорода О2.
2. Окисление SO2 в SO3кислородом.
Протекает в контактном аппарате.
Уравнение реакции этой стадии:
2SO2 + O2![]() 2SO3 + Q
2SO3 + Q
Сложность второй стадии заключается в том, что процесс окисления одного оксида в другой является обратимым. Поэтому необходимо выбрать оптимальные условия протекания прямой реакции (получения SO3):
а) температура 400-5000С
б) давление
3. Получение H2SO4
nSO3 + H2SO4![]() H2SO4·nSO3
H2SO4·nSO3
Образовавшийся олеум сливают в металлические резервуары и отправляют на склад. Затем олеумом заполняют цистерны, формируют железнодорожные составы и отправляют потребителю.
Сырьё, используемое для производства серной кислоты
1.
Самородная сера S
2.
Пирит (серный колчедан) FeS2
3.
Сероводород H2S
4.
Сульфиды цветных металлов ZnS, Cu2S
3-ий уровень
Учитель
Ученик
Работа в группах:
-
Подумайте и ответьте на вопросы:
-
Образовавшийся оксид железа Fe2O3 (огарок) в производстве серной кислоты не используют, что с ним происходит, представляет ли он химическую опасность для окружающей среды?
-
А почему на стадии производства оксид серы SO3 не поглощают водой? Ведь можно было бы оксид серы растворить в воде:
SO3 + H2O![]() H2SO4.
H2SO4.
-
Какие экологические проблемы возникают при производстве серной кислоты?
-
Какие меры предосторожности необходимо соблюдать при работе с кислотами.
(Предполагаемые ответы)
а) Огарок собирают и отправляют на металлургический комбинат, на котором из оксида железа получают металл железо и его сплавы с углеродом - сталь (2% углерода С в сплаве) и чугун (4% углерода С в сплаве).
Таким образом выполняется принцип химического производства - безотходность производства.
b) дело в том, что если для поглощения оксида серы использовать воду, образуется серная кислота в виде тумана, состоящего из мельчайших капелек серной кислоты (оксид серы растворяется в воде с выделением большого количества теплоты, серная кислота настолько разогревается, что закипает и превращается в пар). Для того, чтобы не образовывалось сернокислотного тумана, используют 98%-ную концентрированную серную кислоту. Два процента воды - это так мало, что нагревание жидкости будет слабым и неопасным. Оксид серы очень хорошо растворяется в такой кислоте, образуя олеум: H2SO4·nSO3.
с) 1. Аэрозоль серной кислоты может образовываться в атмосфере в результате выбросов химических и металлургических производств, содержащих оксиды S, и выпадать в виде кислотных дождей. Кислотные осадки во многих районах мира настолько повысили кислотность озер, что жизнь их обитателей оказалась под угрозой. Борьба с этим явлением до сих пор сводилась к внесению в воду извести. Однако ее применение имеет целый ряд недостатков.
2. Известь - вещество едкое, может вызвать ожоги у рабочих, занимающихся ее внесением, у рыб и растений, а также гибель микроорганизмов; растворение извести и ее нейтрализация приводит к местному разогреву воды, что вызывает кислородное обеднение воды; существенно повышается жесткость воды.
3. Кроме самих соединений серы экологические проблемы могут вызывать и соединения, находящиеся в составе серосодержащих руд. Например, селен, который входит в состав серосодержащих руд и выделяется в атмосферу при обжиге пирита. Селен может заменять серу в аминокислотах (метионине, цистеине, цистине) и включаться в обмен веществ. Избыток селена в растениях (до 5•10-6 %) вызывает облысение овец и болезни их копыт, выпадение перьев у птиц, нарушение координации движений у животных.
4-ый уровень
Учитель
Ученик
Сформулируйте ответы на предложенные вопросы, подумайте и предложите как может столкнуться с подобными ситуациями не только рабочий на сернокислотном предприятии, но и обычный житель местности, где расположен завод, предложите выход и решение проблемы.
Отвечает спикер от группы
5-ый уровень
Учитель
Ученик
Решите задачу, объясните чем условия задачи могут быть полезны в производстве
1 вариант:
Какой объем 0,2 М раствора серной кислоты (H2SO4) требуется для нейтрализации 2,8 миллилитров 2 М гидроксида бария (Ba(OH)2)?
2 вариант:
Для образования средней соли к 40 миллилитрам раствора серной кислоты (H2SO4) с плотностью 1,025 г/мл добавили 43,2 миллилитра 7,4-процентного раствора гидроксида калия (KOH) с плотностью 1,06г/мл. Рассчитайте массовую долю серной кислоты в растворе
1 вариант:
Решение задачи
Напомню, что под реакцией нейтрализации (от лат. neuter - ни тот, ни другой) понимают взаимодействие кислот с основаниями, в результате которого образуются соли и вода.
Запишем уравнение реакции серная кислота нейтрализация нейтрализации гидроксида бария (Ba(OH)2) серной кислотой (H2SO4):
![]()
Напомню, что под молярной концентрацией понимают количество (число моль) данного вещества, содержащегося в единице объема раствора. Молярную концентрацию выражают в моль/л или используют сокращение «M».
![]()
По формуле вычислим,сколько моль содержится в 0,0028 л гидроксида бария (Ba(OH)2):
![]()
Получаем:
n (Ba(OH)2) = 2 ⋅ 0,0028 = 0,0056 (моль).
Из уравнения реакции серная кислота нейтрализация видно, что на нейтрализацию 0,0056 моль 2 М гидроксида бария (Ba(OH)2) надо 0,0056 моль 0,2 М серной кислоты (H2SO4).
Найдем объем 0,2 М раствора серной кислоты (H2SO4), составим пропорцию:
в 1 л раствора серной кислоты должно содержаться 0,2 моль H2SO4
в х л раствора серной кислоты должно содержаться 0,0056 моль H2SO4
Откуда:
![]()
Объем 0,2 М раствора серной кислоты (H2SO4) равен 28 миллилитров. Серная кислота нейтрализация
Ответ:
объем раствора серной кислоты 28 миллилитров.
2 вариант:
Решение задачи
Запишем уравнение реакции образования средней соли:
![]()
Рассчитаем массу раствора гидроксида калия (KOH) по формуле, устанавливающей связь между массой и объемом:
![]()
Получаем:
m (раствора KOH) = 43,2 ∙ 1,06 = 45,79 (г).
Массовая доля серной кислоты. Используя формулу нахождения массовой доли растворенного вещества:
![]()
выразим массу вещества:
![]()
Получаем:
m (вещества KOH) = 45,79 ∙ 0,074 = 3,39 (г).
Если раствор 7,4-процентный, то массовая доля гидроксида калия (KOH) в нем 0,074.
Массовая доля серной кислоты. Учитывая, что молярные массы гидроксида калия (KOH) и серной кислоты (H2SO4) соответственно равны 56 г/моль и 98 г/моль (смотри ), по уравнению реакции образования средней соли рассчитаем, сколько грамм серной кислоты (H2SO4) нужно для нейтрализации 3,39 г гидроксида калия (KOH):
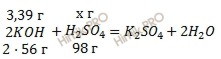
на реакцию нейтрализации 112 г KOH нужно 98 г H2SO4
на реакцию нейтрализации 3,39 г KOH нужно х г H2SO4
Откуда:
![]()
Рассчитаем массу раствора серной кислоты (H2SO4) по формуле, устанавливающей связь между массой и объемом:
![]()
Получаем:
m (раствора H2SO4) = 40 ∙ 1,025 = 41 (г).
Массовая доля растворенного вещества в растворе - это отношение массы растворенного вещества к массе раствора. Выражается в долях единицы или в %.
Рассчитаем массовую долю серной кислоты в растворе:
![]()
Получаем, массовая доля серной кислоты равна:
w (H2SO4) = 2,97 / 41 = 0,072 или 7,2%
Ответ:
массовая доля серной кислоты равна 7,2 %.