- Учителю
- Опорный конспект для подготовки к ЕГЭ VI А группа элементов
Опорный конспект для подготовки к ЕГЭ VI А группа элементов
VI а группа - халькогены - nS2nP4
-
8O - H2+1O-2 , H2O2-1 ; O+2F2-1

16S - 2;O +2; +4; +6 НеМе О - самый распространенный хими-
34Se - 2;O +2; +4; +6 св-ва ческий эл-т на Земле. O2 и O3; ромби-
52Te - 2;O +2; +4; +6 уб-ют ческая, моноклинная S8, аморфный Se,
84Po - 2;O +2; +4; +6 ЭО ум-ся серый Se, неск-ко аллотропный видоизм.
-
O3 -озон, сильный окислитель - Г, З, Ц
O3 = O + O2. Вдыхание O3 в больших количествах вредно.
-
Сера. В природе FeS2, FeCuS2, MgS, Na2SO4 . 10H2O, CaSO4 . 2H2O
Встречается не только в виде соединений, но и в свободном виде.
пирит халькопирит мирабилит гипс
S нерастворима в H2O, но хорошо растворима в CS2 (сероуглероде)
-
с
 Ме - сульфиды 2Na+S Na2S Fe + S = FeS
Ме - сульфиды 2Na+S Na2S Fe + S = FeS
-
c НеМе O2, F2, Cl2, Br2 (с N2 не взаимодействует, нитрид образуется косвенно)
S +
O2 SO2 H2 + S =H2S
+
O2 SO2 H2 + S =H2S
-
c кислотами:
S + 4HNO3 = SO2 + 4NO2 + 2H2O S + 2H2SO4 = 3SO2 + 2H2O
конц.конц.
-
с щелочами:
 3S +
6NaOH 2Na2S + Na2SO3 +
3H2O
3S +
6NaOH 2Na2S + Na2SO3 +
3H2O
Получение FeS2 = FeS + S
-
Сероводород - H2S - Ц, З тухлых яиц, Яд, растворимый в H2O
Сильный восстановитель и слабая кислота:
H 2S
+ 6HNO3 SO2 + 6NO2 +
4H2O
2S
+ 6HNO3 SO2 + 6NO2 +
4H2O
-
c Ме:
 2H2S
+ 2Na 2NaHS + H2
2H2S
+ 2Na 2NaHS + H2
-
c основными оксидами:
H 2S
+ ZnO ZnS + H2O
2S
+ ZnO ZnS + H2O
-
с солями
H
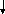
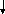 2S
+ Cu(NO3)2 CuS + 2HNO3, PbS
2S
+ Cu(NO3)2 CuS + 2HNO3, PbS
черный
5H2S + 2KMnO4 + 3H2SO4 = 5S + 2MnSO4 + K2SO4 + 8H2O
Окисление в водном растворе или при недостатке O2:
2H2S + O2 = 2H2O +2S
2H2S + 3O2(изб.) = 2SO2 + 2H2O
Окисляется галогенами в водном растворе:
 H2S
+ 4Cl2 + 4H2O H2SO4 +
8HCl
H2S
+ 4Cl2 + 4H2O H2SO4 +
8HCl
H2S + J2 = 2HJ + S
-
Оксид S(IV) - SO2 - сернистый газ - Г, Ц, резкий З, кислотный оксид.
H2SO3 - слабая кислота, 2 ряда солей: SO3-2 - сульфиты, HSO3- - гидросульфиты. SO2 вытесняет слабые кислоты из солей: SO2 + Na2CO3 = CO2 + Na2SO3.
Г идросульфит-ион
и SO2 вытесняются более сильными кислотами:
Na2CO3 + CH3COOH NaHSO3
+ NaCH3COO
идросульфит-ион
и SO2 вытесняются более сильными кислотами:
Na2CO3 + CH3COOH NaHSO3
+ NaCH3COO
SO2 - вещество с 2-ой окислительно-восстановительной природой, с преобладающей восстановительной функцией.
S O2
+ J2 + 2H2O 2HJ + H2SO4
O2
+ J2 + 2H2O 2HJ + H2SO4
S O2
+ 2HNO3 (конц.) 2NO2 +
H2SO4
O2
+ 2HNO3 (конц.) 2NO2 +
H2SO4
2 SO2
+ O2 2SO3 ( t, кат.)
SO2
+ O2 2SO3 ( t, кат.)
SO2 + O3 = SO3 + O2 (при комн. t)
2 K2SO3
+ O2 2K2SO4 (во влажном воздухе)
K2SO3
+ O2 2K2SO4 (во влажном воздухе)
4K2SO3 (t = 600o) = 3K2SO4 + K2S
О кислитель
SO2 + 2H2S 3S + 2H2O (при комн. t)
кислитель
SO2 + 2H2S 3S + 2H2O (при комн. t)
SO2 + C (t) = S + CO2
Качественные реакции на SO2:
-
Обесцвечивание подкисленным раствором KMnO4:
5 SO2
+ 2KMnO4 + 2H2O (H+) 2MnO4
+2H2SO4 +K2SO4
SO2
+ 2KMnO4 + 2H2O (H+) 2MnO4
+2H2SO4 +K2SO4
-
Помутнение известковой воды:
C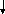
 a(OH)2(изб.)
+ SO2 CaSO3 + H2O
a(OH)2(изб.)
+ SO2 CaSO3 + H2O
-
SO3; H2SO4, соли сульфаты (щелочные Ме и NH3 образуют гидросульфаты)
Р аствор
SO3 в H2SO4(конц.) Олеум
аствор
SO3 в H2SO4(конц.) Олеум
H2SO4 - Ц, сиропообразная Ж,
H2SO4 реагирует с Ме, до Н в ЭХР
Fe + H2SO4 = FeSO4 + H2
H2SO4 (конц.) - сильный окислитель, восстанавливается до S+4 или S-2, реже до S, часто выделяется смесь продуктов, например в реакции с Zn - SO2, H2S и S, но основной продукт - H2S; 4Zn + 5H2SO4 = 4ZnSO4 + H2S + 4H2O
H2SO4 (конц.) на холоде не реагирует с Al, Fe, Cr, при t с Cu, Ag, Hg
C
 u +
2H2SO4 (t) CuSO4 + SO2
+ 2H2O
u +
2H2SO4 (t) CuSO4 + SO2
+ 2H2O
2 Fe +
6H2SO4 (t)
Fe2(SO4)3 + 3SO2 +
6H2O
Fe +
6H2SO4 (t)
Fe2(SO4)3 + 3SO2 +
6H2O
H2SO4(конц.)окисляет НеМе, графит (С), Р, S
2 H2SO4(конц.)
+ C 2SO2 + CO2 + 2H2O
H2SO4(конц.)
+ C 2SO2 + CO2 + 2H2O
H2SO4(конц.) + 2P = 3SO2 + 2H3PO4
 2H2SO4(конц.)
+ S 3SO2 + 2H2O
2H2SO4(конц.)
+ S 3SO2 + 2H2O
H 2SO4(конц.)
реагирует со сложными веществами:
2SO4(конц.)
реагирует со сложными веществами:
H 2SO4(конц.)
+8HJ 4J2 + H2S + 4H2O
2SO4(конц.)
+8HJ 4J2 + H2S + 4H2O
H
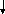
 2SO4(конц.)
+ HBr = Br2 + SO2 + 2H2O
2SO4(конц.)
+ HBr = Br2 + SO2 + 2H2O
H 2SO4(конц.)
+ H2S S + SO2 + 2H2O
2SO4(конц.)
+ H2S S + SO2 + 2H2O
С H2SO4(конц.) органические вещества обугливаются:
6H2SO4(конц.) + C6H12O6 = 6C + 6H2SO4 + H2O
Сульфаты окислительными свойствами не обладают, при t окисляют вещества
Na2SO4 + 4C(изб.)(t) = Na2S + 4CO
Качественная реакция на H2SO4 и растворимые соли:
S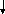 O42-
+ Ba2+ = BaSO4 (белый)
O42-
+ Ba2+ = BaSO4 (белый)