- Учителю
- Заттарды қоспадан бөлу және тазарту.
Заттарды қоспадан бөлу және тазарту.
I тарау . ХИМИЯЛЫҚ АЛҒАШҚЫ ҰҒЫМДАР
Күні
САБАҚТЫҢ ТАҚЫРЫБЫ. Химия пәні. Заттар және олардың физикалық қасиеттері.
САБАҚТЫҢ МАҚСАТЫ.
Білімділік: Химия пәні туралы алғашқы ұғым беру, заттардың қасиеттерін , таза зат және қоспа ұғымдарын түсіндіру.
Дамытушылық: Заттарды анықтауға және олардың қасиеттерін сипаттай білуге үйрету.
Тәрбиелік: ұқыптылыққа, тазалыққа тәрбиелеу
Сабақтың түрі: танысу сабағы.
Сабақтың әдіс - тәсілдері: сұрақ-жауап
ҚҰРАЛ-ЖАБДЫҚТАР. Химияның маңызын көрсететін көрнекі құралдар,үйде және зертханада /лабараторияда/ қолданылатын әр түрлі заттан тұратын бірдей денелерді көрсету. Мысалы, шыныдан, фосфордан, металдан жасалған стакандар немесе алюминийден, темірден, мыстан жасалған сым, қасық, т.б. Пәнаралық байланыс: физика, биология
ТІРЕК БІЛІМ МЕН БІЛІКТЕР. Дене, зат және заттың қасиеті туралы түсініктер.
Оқушыларды жаңа пәнмен таныстыру. Оқушылардың химияның алғашқы сабағына үлкен қызығушылықпен келетін жөн. Химия кабинетінің жабдықталуы, жаңа нән, жаңа мұғалім баланың көңіл күйіне ерекше әсер етеді. Сондықтан да алғашқы сабақты мазмұнды, қызықты етіп өткізу керек.. Алғашқы сабақтан бастап оқушыларды зертханада жұмыс істеу ережелермен таныстырған жөн. Оларға кабинетте кітаппен ғана емес,зертханалық құралдармен жұмыс істеу тапсырылатынын ескертудіңмәні зор. Сол себепті кұралдар мен оқу жабдықтарын дұрыс пайдалану қажеттігі айтылады. Сабақ оқу кезінде негізгі құрал оқулық болғандықтан мұғалім оның мазмұнымен, құрылымымен таныстырады.
Жаңа сабақты түсіндіру. Бұл сабақта оқушылар химия ғылымының алғашқы ұғымдарымен танысады, оларды салыстыра білуге үйретеді.Алғашқысабақта оқушылардың жаңа пәнге деген қызығушылығын арттырудың зор маңызы бар. Сол себепті мұғалім төмендегі сұрақтардың мәнін ашуы керек .1.Жаратылыстану ғылымдарының ішіндегі химияның рөлі
.2. Күнделікті өмірдегі, шаруашылық саласындағы химияның басқа пәндермен байланысты.
.3. Еліміздің шаруашылығын дамытудағы химияның рөлі.
Одан кейін физика курсынан таныс зат , дене ұғымдарын оқушлардын есіне түсіру керек:
а/ денелер деп нені айтады?
ә/ денелерге қандай қасиеттер тән /пішіні, мөлшері, массасы, түсі, дәмі, исі, тығыздығы, қаттылығы, т.б./?
Мұғалім заттың алуын түрлілігіне, жаңадан алынып жатқан заттардың қасиеттеріне, айырмашылығы мен ұқсастығына тоқталады. Сонан соң заттрдың касиеттеріне қарай әр түрлі болатындығын түсіндіреді, яғни оқушыларды бір заттың басқа затпен салыстырғанда ұқсастығы мен ерекшелігі неде екенін ажырата білуге үйретеді. Сол сияқты оқушыларды зат және физикалық дене ұғымдарын ажырата білуге үйреткен жөн. Осы екі ұғымды ажырата білу білігін қалыптастыру үшін төмендегі тапсырманы орындатамыз. Келтірілген тізімде заттар және физикалық денелер берілген: су, сызғыш, сода, қант, алюминий, стақан, қасық.
Осы тізімнен заттарды іріктеп жаз/ I нұсқа/. Физикалық денелерді іріктеп жаз/II нұсқа/.
Оқушылар заттың физикалық қасиетімен танысқанда жай заттың қасиетімен танысу ережесін еске түсіреді, әсіресе сандық айырмашылығына баса көңіл аударады.Себебі, химия пәні дәл есептеуді қажет ететін пәннің бірі. Сандық қасиеттерді анықтауға арналған кейбір құралдармен /ареометр,термометр/ таныстырады. Зертханалық тәжірибелерді өткізеді. Оқулықтағы сипаттау тапсырмаларын алғаш мұғалім жасап көрсетеді кейін оқушылар ондай тапсырманы өздігінен орындауы керек. Заттың қасиетін төмендегі кестені толтыра отырып сипаттаса оқушылардың ісінде көбірек сақталады.
Салыстыру
белгілері
Заттың
темір
қасиеті
күкірт
Жинақтап
қорытындылау
1 Агрегаттық
күйі
2 Түсі
3 жылтырлығы
4 Иісі
5Қаттылығы
6 Иілгіштігі
7 Электр өткізгіштігі
8 Жылу өткізгіштігі
9 Суда ерігіштігі
10 Тығыздығы
Үйге тапсырма беру: Кіріспе, §1 ж/е 1-жаттығу
Күні
Сабақтардың тақырыбы: Таза заттар және қоспалар.Заттарды қоспадан бөлу және тазарту.
Оқыту мақсаты: а) Заттар және олардың қасиеттері туралы түсінікті бекіту үшін заттар және қоспаларға түсінік беру. ә) Қоспаларды айыра білу, қоспаларды жіктеу, қоспадағы әр заттың өзіне тән қасиеттерінің сақталатынын тәжірибелер арқылы оқушылардың логикалық ойларын дамыту. Б) ұжымдық жұмысқа, жауапкершілікке тәрбиелеу.
Реактивтер мен құралдар: Көрсетілім столда қоспадағы заттарды бөлуге керекті химиялық ыдыстар: стақандар, сүзгі, сүзгі қағаз, цилиндр,бөлгіш ыдыс,лаб/тұрғы. Реактивтер: ас тұзы, құм,темір үгіндісі, күкірт ұнтағы,т.б. Электрондық оқулық, кесте.
Сабақтың түрі: топпен жұмыс.
Сабақтың әдіс-тәсілдері: сұрақ-жауап, іздендіру.
Пәнаралық байланыс: физика, биология.
Сабақ барысы: Ұйымдастыру кезеңі.
Үй тапсырмасын тексеру мақсатында оқушыларға өздік жұмыс беру.
-
Бір заттан жасалатын нәрселерге мысалдар келтір.
2. Оттек, көмір қышқыл газы және судың қасиеттерін сипаттау. Химиялық диктант жүргізу: Оқушылар алюминийге қатысты физикалық қасиеттеріне сай сөздерді жазады. Мұғалім оқиды: сұйық, қатты, магнитке тартылады,балқымайды,түссіз,иісі бар,морт, иіссіз, жылтыры бар, күмістей ақ, судан ауыр, балқиды.
-
Таза зат дегеніміз не?
-
Ауа таза затқа жата ма? Неліктен?
( сүт, теңіз суы,қара топырақ )
Жаңа сабақ тақырыбы тақтаға жазылады: Таза заттар және қоспалар. Заттарды қоспадан бөлу және тазарту.
Қоспалар екі түрге бөлінеді: әртекті және біртекті қоспалар.
Анықтамасы беріліп мысалдар келтіріледі.
Заттарды әртекті және біртекті қоспалардан бөлу әдістерін тақтаға жазып, көрсетілім столында көрнекі көрсету:
-
Әртекті қоспадан заттарды бөлу: тұндыру, сүзу, магнитке тарту;
-
Біртекті қоспадан заттарды бөлу: қайта кристалдандыру (суалту), дистилдеу,т.б.
Жаңа материалды бекіту мақсатында сұрақтар қойылады және оқулық пен жаттығулар мен есептер жинағы бойынша тапсырмалар беру:
-
Табиғи қоспаларға мысал келтіріңдер.
-
Біртекті қоспаларды бөлу әдістері қандай? Мысал келтір.
-
Әртекті қоспаларды бөлу әдістері қандай? Мысал келтір.
-
Қоспада таза заттың қасиеті сақтала ма?
Есептер мен жаттығулар жинағы бойынша тапсырмалар беру:
1 - 12,1 - 13,1 - 14, 1- 15, 1 -16,1-17 жаттығуды дәптерге орындау. Қосымша ойлануға күрделірек жаттығулар беру: 1-20,1-21,1-22.
Үйге тапсырма беру: §2.3. 10 бет. 1-10 жаттығулар (ауызша).
Күні
Сабақтардың тақырыбы: Заттарды қоспадан бөлу және тазарту.
Оқыту мақсаты: а) Заттар және олардың қасиеттері туралы түсінікті бекіту үшін заттар және қоспаларға түсінік беру. ә) Қоспаларды айыра білу, қоспаларды жіктеу, қоспадағы әр заттың өзіне тән қасиеттерінің сақталатынын тәжірибелер арқылы оқушылардың логикалық ойларын дамыту. Б) ұжымдық жұмысқа, жауапкершілікке тәрбиелеу.
Реактивтер мен құралдар: Көрсетілім столда қоспадағы заттарды бөлуге керекті химиялық ыдыстар: стақандар, сүзгі, сүзгі қағаз, цилиндр,бөлгіш ыдыс,лаб/тұрғы. Реактивтер: ас тұзы, құм,темір үгіндісі, күкірт ұнтағы,т.б. Электрондық оқулық, кесте.
Сабақтың түрі: топпен жұмыс.
Сабақтың әдіс-тәсілдері: сұрақ-жауап, іздендіру.
Пәнаралық байланыс: физика, биология.
Сабақ барысы: Ұйымдастыру кезеңі.
Үй тапсырмасын тексеру мақсатында оқушыларға өздік жұмыс беру.
-
Бір заттан жасалатын нәрселерге мысалдар келтір.
2. Оттек, көмір қышқыл газы және судың қасиеттерін сипаттау. Химиялық диктант жүргізу: Оқушылар алюминийге қатысты физикалық қасиеттеріне сай сөздерді жазады. Мұғалім оқиды: сұйық, қатты, магнитке тартылады,балқымайды,түссіз,иісі бар,морт, иіссіз, жылтыры бар, күмістей ақ, судан ауыр, балқиды.
-
Таза зат дегеніміз не?
-
Ауа таза затқа жата ма? Неліктен?
( сүт, теңіз суы,қара топырақ )
Жаңа сабақ тақырыбы тақтаға жазылады: Таза заттар және қоспалар. Заттарды қоспадан бөлу және тазарту.
Қоспалар екі түрге бөлінеді: әртекті және біртекті қоспалар.
Анықтамасы беріліп мысалдар келтіріледі.
Заттарды әртекті және біртекті қоспалардан бөлу әдістерін тақтаға жазып, көрсетілім столында көрнекі көрсету:
-
Әртекті қоспадан заттарды бөлу: тұндыру, сүзу, магнитке тарту;
-
Біртекті қоспадан заттарды бөлу: қайта кристалдандыру (суалту), дистилдеу,т.б.
Жаңа материалды бекіту мақсатында сұрақтар қойылады және оқулық пен жаттығулар мен есептер жинағы бойынша тапсырмалар беру:
-
Табиғи қоспаларға мысал келтіріңдер.
-
Біртекті қоспаларды бөлу әдістері қандай? Мысал келтір.
-
Әртекті қоспаларды бөлу әдістері қандай? Мысал келтір.
-
Қоспада таза заттың қасиеті сақтала ма?
Есептер мен жаттығулар жинағы бойынша тапсырмалар беру:
1 - 12,1 - 13,1 - 14, 1- 15, 1 -16,1-17 жаттығуды дәптерге орындау. Қосымша ойлануға күрделірек жаттығулар беру: 1-20,1-21,1-22.
Үйге тапсырма беру: §3. 10 бет. 1-10 жаттығулар (ауызша).
Күні
Сабақтардың тақырыбы: Физикалық және химиялық құбылыстар. Химиялық реакциялардың белгілері.
Сабақтың мақсаты:
Білімділік; Химиялық құбылыстың физикалық құбылыстан айырмашылығын түсіндіру, химиялық реакцияның алуан түрлілігімен таныстыру, химиялық реакцияның басталуы мен жүру барысының жағдайын және химиялық реакцияның негізгі белгілерін бақылауға үйрету.
Дамытушылық: құбылыстардың айырмашылығы мен ұқсастығын айыра отырып ойларын дамыту.
Тәрбиелік: өз еркімен жұмыс жасауға, ой ын жеткізе білуге тәрбиелеу.
Сабақтың түрі: аралас сабақ.
Сабақтың әдіс-тәсілдері: жеке тапсырма беру, іздендіру.
Пәнаралық байланыс: физика, биология.
Құрал - жабдықтар: Мыс пластинкасы, магний лентасы, мәрмәрдің немесе бордың түйірлері, тұз қышқылының ерітіндісі, қант түйірлері, мыс сульфатының ерітіндісі, парафин, сынауықтар, шыны түтіктер, қысқыш, спиртшам, тигель, электрондық оқулық.
Тірек білім мен біліктер: Физикалық құбылыс, зертханалық құралдармен жұмыс істей білу.
Сабақтың барысы: Оқушылардың білім мен біліктерін тексеру үшін таза заттар мен қоспаларды ажырата білуге арналған төмендегі тапсырмаларды беруге болады.
1. Келтірілген тізімнен заттар мен қоспаларды жеке бөліп жазыңдар:ауа,темір,ас тұзы,сүт.
2. Өзің білетін қоспаларды бөлудің әдістерін қолданып, судан мына заттарды қалай бөлуге болатындығын көрсет: а/қант: ә/ бор: б/ бензин: в/ ас тұзы. Қандай қасиеттеріне сүйеніп, бұл заттарды судан бөлдің?
3. Төмендегі келтірілген әдістермен қандай қоспаларды бөлуге болатындығына мысал келтір : а/ сүзу: ә/ суалту: б/ тұндыру.
Жаңа материалды оқыту:Оқушылардың физика курсынан алған біліміне сүйене отырып, физикалық құбылыс кезінде заттың пішіні мен агрегаттық күйінің өзгеретінін еске түсіре келіп, химиялық құбылыс туралы түсінік беру. Осыған орай химиялық құбылыс заттар қасиетінің өте күрделі өзгерістері екендігін оқушыларға таныстыру. Сабақты табиғаттағы заттардың түрлі өзгерістерін еске түсіре отырып, әңгімелеуден бастаймыз. Оқушыларға мынадай сұрақтар береміз:
1. Табиғатта жүретін қандай өзгерістерді білесің?
2. Табиғаттағы өзің бақылаған заттар өзгерісіне мысал келтір.
3. Заттардағы байқалатын өзгерістердің барлығы бірдей ме?
Физикалық және химиялық құбылыстарды өзара салыстыру арқылы жақсы нәтижеге жетуге болады. Бұл үшін оқушылар шыны түтікті ию, қантты ұнтақтау, еріту және жағу, парафинді балқыту тәжірибелерін жасайды. Тәжірибе нәтижесінде оқушылар заттың қасиетін өзгермегенін, жаңа зат түзілмегенін көріп қорытындылайды. Ал қанатты жағу кезінде оқушылар назарын жаңа зат - көмір мен су түзілгеніне аударамыз. Осыдан кейін магнийді, парафинді жағу, мыс пластикасын күйдіру тәжірибесі жүргізіледі. Оқушылар жаңа заттардың түзілуіне назар аударады. Сонымен құбылыстар екіге бөлінеді - физикалық және химиялық деген қорытынды жасалады. Оқушыларды оқулықпен жұмыс істеуге және оқулықтан анықтаманы таба білуді дағдыландыру үшін оқулықтан физикалық және химиялық құбылыстардың анықтамасын табуды тапсыру керек. Химиялық құбылыстың химиялық реакция деп аталатындығын, химиялық реакциялардын өз белгілері бола- тындығы айтылып, әр түрлі белгілері бар реакциялар жасап көрсетіледі: ерітінділерде тұнба түзілу
( мысалы, BaSO4 ,AgCl,т.б) газ бөліну(H2, O2, NH3, CO2, т.б.), батареяда тоқтың пайда болуы, соның әсерінен электр шамының жануы химиялық құбылыс екендігі түсіндіріледі. Оқушылардың назарын ең басты қорытындыға аудару керек: химиялық реакцияның ең негізгі белгісі жаңа заттардың түзілуі.Содан соң реакцияның жүру жағдайлары қарастырылады.
Жаңа материалды бекіту үшін оқушылар төмендегі сұраққа жауап береді.
1. Мына құбылыстардың қайсысы химиялық құбылысқа жатады: а)қар қиыршықтары- ның түзілуі; ә) қанттың көмірленуі.
Одан соң сыныпта оқушыларға мына тапсырмаларды орындатамыз. Төменде келтірілген мысалдардан а) физикалық: ә) химиялық құбылысты бөліп жаз: парафиннің балқуы, жаңқаның көмірленуі, сүттің ашуы, темірдің таттануы, ағашта қыраудың пайда болуы , электр шамы қылының қызаруы, қанттың көмірленуі, қанттың суда еруі.
Үйге тапсырма беру. §4,5. 16-бет, 1-8 жаттығулар,17-бет 1-7 жаттығулар.
Күні
Сабақтардың тақырыбы: №3 практикалық жұмыс. Ластанған тотияйынды тазарту және қайта кристалдау.
Оқыту мақсаты: Лабораториялық құралдар және химиялық заттармен жұмыс істей білуді одан әрі жалғастыру мақсатында болып жатқан құбылыстар мен заттардың түстеріне көңіл аудару. Дәптерге істеген жұмысты қорытындылап жаза білу дағдысын қалыптастыру. Тәжірибе жасау кезінде оқушылар бақылағанын қорытындылап жазу үшін өткен практикалық жұмысты еске түсіреді.
Реактивтер мен құралдар: Ластанған тотияйын. Химиялық стақан,шыны таяқша,лабораториялық тұрғы,сүзгі қағаз,1-2 сынауық, суы бар ыдыс, құйғы.
Сабақтың түрі: өздігімен жұмыс жасау
Сабақтың әдіс-тәсілдері: сұрақ-жауап
Жұмыстың орындалуы: Үй жұмысын тексереді.Қауіпсіздік техникасының ережелерін қайталап сұрайды.2-практикалық жұмысты оқушылар оқулықпен жұмыс жасау арқылы орындайды. Ластанған мыс купоросын тазартудыіске асыруда оқушылардың ұсыныстарын талдап болған соң мүмкіндік болса әр партаға жұмысты орындаудың алгоритімін қойған дұрыс. Практикалық жұмысты ұйымдастырудың тиімді әдіс, мұғалімнің шығармашылық әрекетіне байланысты. Дегенмен, қарапайым алгоритм үлгісін ұсынып көрелік:
-
Сүзгі қағазды даярлап, оны құйғышқа сулап орналастырыңдар.
-
Стақанға лас купоросты салып су құйып шайқаңдар.
-
Шыны таяқша арқылы тұз ерітіндісін сүзгіден өткізіп сүзіңдер.
-
Кәрлен табақшаға сүзіндіні құйып,спирт шамды баяулатып қыздырыңдар.
-
Алынған кристалдың түсіне көңіл аударыңдар.
-
Тәжірибеден байқағандарыңды жазып, қорытындылаңдар.
-
Орындаған жұмыстың суретін дәптерге салыңдар.
Оқушылар өз бетінше жұмысты орындаудың ретін жоспарлауы қажет. Қоспаны тазартудың әдістерін естеріне түсіру арқылы сүзу, қайта кристалдау әрекеттерін орындай білуді үйренеді.
Оқытушының басшылығымен тәжірибеден байқағанын қорытындылай отырып, өзі істеген практикалық жұмысты дәптеріне жазады.
Алдымен жұмыстың тақырыбын, мақсатын,құралдар мен реактивтерін жазып,одан кейін төмендегідей кесте сызады:
Жұмыстың тақырыпшалары.
Жұмыс барысы.
Қорытынды.
а) ластанған тұзды дистилденген суда еріту.
Лас тұздың ерітіндісін алдым.
ә)сүзгі дайындау.
Суреті, оған түсінік
Сүзгіш қағаздан түрлі мөлшерде гі шұқыраққа лайықтап сүзгі дайындадым
б) лас тұз ерітіндісінен таза ерітінді алу.
Суреті, оған түсінік
Сүзу арқылы таза ерітінді
алдым.
в) таза ерітіндіден құрғақ тұз алу.
Суреті, оған түсінік
Суын буландырып ерітіндіден тұз алдым.
Жұмыс соңында мына сұрақтарға жауап береді:
-
Қандай қоспаларды сүзу арқылы бөледі?
-
Құрғақ тұзды ерітіндіден қалай бөліп алуға болады?
Үйге тапсырма беру:§ 4 (3,4,5)
Күні
Сабақтың тақырыбы: Атомдар және молекулалар Жай зат, күрделі заттар.
Сабақтың мақсаты: Білімділік: Химиялық элемент,жай және күрделі зат ұғымдары негізінде атом туралы түсінікті қалыптастыру. Дамытушылық: осы ұғымдардың қолданылуын үйрете отырып дамыту. Тәрбиелік: Өз еркімен жұмыс жасауға, ойын жеткізе білуге тәрбиелеу.
Құрал - жабдықтар: H2 , O2 және су молекулаларының үлгілері, жай және күрделі заттар- дың үлгілері, суды электролиздеуге арналған құрал , металдар және бейметалдар.
Сабақтың түрі: аралас сабақ
Сабақтың әдіс-тәсілдері: сұрақ-жауап арқылы
Тірек білім мен біліктер: таза зат, атом, қоспаларды бөлу әдістерін білу.
Тірек білім мен біліктерді тексеру: Бірінші оқушыға тапсырма:химиялық және физикалық құбылыстарға анықтама бер, екі мысал келтір.
Сабақ барысы: Ұйымдастыру кезеңі.
Екінші оқушыға тапсырма; а) стакандағы бор түйіршігіне (немесе әктасына) сірке қышқылының ерітіндісін құй; ә) стакандағы бор түйіршігіне су құй. Қай ыдыста химиялық реакция жүрді? Реакция жүргендігін қандай белгілеріне қарап білуге болады?
Сыныптағы басқа оқушыларға төмендегі тапсырма беріледі: Мына құбылыстардың қайсысы физикалық және химиялық құбылыстарға жатады: қалайының балқуы, ағаштың жануы, судың қатуы, судың мұзға айналуы? Одан соң оқушылар мына сұрақтарға жауап беру керек :
1. Химиялық реакциялардың жүруіне қандай жағдайлар керек?
2. Заттардың еруі химиялық реакциялардың жүру жағдайларын неліктен жақсартады?
Жаңа материалды оқыту: Оқушыларға сұрақ қоя отырып, физика курсынан атом және малекула туралы алған білімін жаңғыртамыз.
1. Температура өзгерген кезде дененің көлемі неліктен ұлғайяды немесе кішірейеді?
2.Заттарды құрайтын бөлшектер қалай аталады ?
Оқушылар осы сұрақтарға жауап бере отырып, заттардың белгілі бір ара қашықтықта болатын бөлшектерден тұратындығын,сол ара қашықтықтың өзгеруіне байланысты дене көлемінің өзгеретінін еске алады. Бөлшектердің ара қашықтығы өскен сайын дененің көлемі ұлғаяды, бөлшек- тердің ара қашықтығы жақындаған сайын дененің көлемі кішірейеді.
Екінші сұраққа жауап бере отырып, оқушылар заттарды құрайтын бөлшектердің молекула екенін және молекулалар атомдарға ыдырайтындығын анықтайды.
Оқушыларға оқулықтан атомның анықтамасын табуды және сөздікке жазуды ұсынамыз. Мұғалім атомдардың белгілі бір саны бар екендігін түсіндіреді. Айналамыздағы өлі және тірі табиғат атомның азғана санды түрлерінен тұратындығын түсіндіреді. Атомдар бір-бірімен әр түрлі болып қосыласады.. Алфавиттегі әріптердің жүз мындаған сөздерді құрайтындығы сияқты атомдардан әр түрлі малекулалар немесе күрделі заттардыңкристалдары құралады. Химиялық реакция атомдардың нақты бар екенінің дәлелдемесі болады. Онда бастапқы заттар құрамына кіретін атомдардан жаңа заттарды дәл сондай атомдары түзіледі. Мұғалім атомдардың бір ғана түрінен жай, ал әр түрлі атомдардан күрделі заттар түзілетіндігін түсіндіреді (H2, O2, және су молекулаларының үлгілері мысалында) және суды электр тоғымен айыру тәжірибесін көрсетеді. Содан соң оқушыларға тапсырма беріледі. Оқулықтағы тексті пайдалана отырып, жай және күрделі заттың анықтамасын табу және қайталап оқу.
Оқулықтың 10 суретінде темір сульфидінің түзілу сызбанұсқасына мұқият қараңдар. Күкірт пен темірдің қосылу реакциясына атом және молекулалардың өзгеруін ескере отырып, түсініктеме беріңдер. Күкірт пен темір қоспасын темір сульфидінен қалай ажыратуға болады? Күкірттің темірмен қосылуын көрнекі көрсеткен соң, мұғалім күрделі зат пен қоспаның өзіне тән белгілерін айтып, оқушылармен бірге оны төмендегі кестеге түсіреді.
Өзіне тән белгілері
Күрделі зат немесе қоспа
1.Физикалық әдістермен айыруға болады.
2.Физикалық әдістермен айыруға болмайды
3.Бастапқы заттардың қасиеттері сақтал майды
4. Сандық құрамы барлық уақытта тұрақты.
5. Сандық құрам өзгермелі болуы да мүмкін.
Жаңа материалды бекіту: Оқушылардың жай және күрделі заттардың құрамына қарай ажырата білуін нығайту мақсатымен тапысырма береміз. (Бір топқа екі оқушыдан). Тапсырманы кодоскоп арқылы көрсетуге немесе алдын ала тақтаға жазып қоюға болады. Төмендегі көрсетілген заттардан бірінші оқушы жай заттардың, екінші оқушы күрделі заттарың аттарын жазады: алюминий, мыс оксиді, су , көмір қышқыл газы, оттегі, темір, темір сульфиді, азот, темір оксиді, күміс. Бір-бірінің жұмыстарын тексереді, жіберілген қателерін бір біріне түсіндіреді.
Үйге тапсырма беру: § 6. 1-12 жаттығулар, жұмыс дәптері.
Күні
Сабақтың тақырыбы: Химиялық элементтер,олардың таңбалары.
Сабақ мақсаты: Білімділік: Оқушыларға атом түріндегі химиялық элемент туралы алғашқы ұғымды түсіндіру. Дамытушылық: химиялық элементтердің таңбасын жазуды, салыстырмалы атомдық массаларын есептеуге және салыстыруды үйрету.Тәрбиелік: Өз еркімен жұмыс жасауға, ойын жеткізе білуге, ұқыптылыққа тәрбиелеу.
Құрал-жабдықтар: Тәжірибе үстелінде мынадай жай ( мыс,күкірт, фосфор, мырыш ) және күрделі заттар ( мыс оксиді, су, мыс купорасы), заттар малекуласының үлгілері, металдар жинақтамасы, химиялық элементтердің таралу диаграммасы қойылады.
Сабақтың түрі: аралас сабақ
Сабақтың әдіс-тәсілдері: топпен жұмыс.
Пәнаралық байланыс: физика, биология
Тірек білім мен біліктер:: атом және атомдық масса.
Тірек білім мен біліктерді тексеру: Оқушыға жай және күрделі зат ұғымдарын ажырата білуі үшін төмендегі тапсырманы береміз.
1. Оқулықтан жай және күрделі заттқа берілген анықтаманы тауып, өз бетіңше қайталап айт.
2. Тақтада берілген төмендегі заттардың ішінен жай, және күрделі заттардың аттарын көшіріп жаз: алюминий, мыс оксиді, су, көмір қышқыл газы, оттегі, темір, темір сульфиді,сынап оксиді, азот.
Жаңа материалды оқыту: Оқушылардың судың және көмір қышқыл газының модельдері арқылы олардың құрамын қайталап талдап, бүкіл заттардың құрамын модел арқылы көрсету қолайсыз екенін түсіндіреміз. Одан кейін химиялық символиканың шығуының қысқаша тарихымен таныстырып, 3-4 элементтің таңбасын жазамыз. Оқушыларға мынадай тапсырма береміз: оқулықта берілген 2- кестемен зейін қойып таныс. Дәптрге а) металдың ә) бейметалдың таңбасын жаз және атауға жаттық. Оқушыларға химиялық элемент атомдардың белгілі бір түрі екендігін атап етіп, қазіргі кезде109 атомның түрі немесе элементтің түрі бар дейміз.Оқушылар назарын химиялық элементтің атом түрі ретінде жай заттарды құрайтынын, сонымен бірге күрделі босқа элементтермен бірге күрделі заттың құрамына ене алатындығын көрсетеміз .
Химиялық элемент, жай зат және күрделі зат ұғымдарын ажырата білуі үшін оқушыларға мынадай жаттығу орындатамыз.
Төмендегі сөйлемдердің қайсысында темір және зат ретінде, ал қайсысында темір элемент ретінде күрделі зат құрамында айтылады: а) темір сульфиді - бұл темір мен күкірттен құралған химиялық қосылыс: ә) таттың құрамында темір болады:б) сым темірден жасалады:в) темір ылғал ауада таттанады:
Жаңа материалды бекіту:
1.Тапсырманы орында: Оқулықтан 12-жаттығуды орындау.
2.Химиялық элемент және жай зат деген ұғымдарды ажырата білу үшін төмендегі тапсырманы орындатамыз. Мына сөйлемдердің қайсысында мыс жай зат, қайсысында химиялық элемент ретінде айтылады:а) мыс купорасының құрамында мыс болады: ә)сым мыс тан жасалған: б) мыс оксидінің құрамында мыс болады:в) мыс электр тогын жақсы өткізеді.
3. Мына элементтерді ата:
1 нұсқа: H, ........... AІ................ Na, .................. N
2 нұсқа: S, ........... Zn,.............. O, .................. Mg
3 нұсқа: Ca, CІ, Fe, P
1.Магнийдің үш атомынан және азоттың екі атомынан тұратын қосылыстың формуласын жазыңыз. Осы қосылыстың салыстырмалық молекулалық массасын есептеп шығарыңыз.
2.Мына жазбадан нені көреміз: 5H2, 6С, 5S, P2O5, Cu, 2H2?
3.Бинарлы қосылыстың формуласын құрыңыз: темірдің екі атомына, оттегінің үш атомы сәйкес келеді.
4.Химиялық таңбаларды пайдаланып формулаларды жазыңыз: мыстың екі атомы; хлорсутектің үш молекуласы; судың бес молекуласы; азоттың екі атомынан тұратын бір молекуласы.
Үйге тапсырма беру. 8сыныпта өткенді қайталау. §1 1-10 жаттығу. .
Күні
Сабақтың тақырыбы: Химиялық элементтердің салыстырмалы атомдық массалары.
Сабақ мақсаты: Оқушыларға химиялық элементтердің салыстырмалы атомдық массаларын есептеуге және салыстыруды үйрету.
Көрнекіліктер: Д.И.Менделеевтің периодтық кестесі. Оқулықтан 2-кестені қолдану.Электрондық оқулық. Сабақтың түрі: аралас сабақ. Әдісі-тәсілдері: сұрақ-жауап, жүйемен жұмыс.
Тірек білім мен біліктер: атом, салыстырмалы атомдық масса, химиялық элемент, массаның атомдық бірлігі.
Сабақ барысы: Ұйымдастыру кезеңі.
Оқушылардың білім мен біліктерін тексеру үшін тапсырмалар беру: Химиялық диктант жүргізу. Оқушыларға біршама элементтердің латынша айтылуын айтамын, ал олар дәптерге таңбаларын жазады:плюмбум,аурум,силициум,цинк,гидраргирум,купрум,гидрогениум, оксигени- ум, ферум,карбонеум,нитрогениум,станнум,аргентум т.б. Содан соң кейбір элементтердің оқылуын айтамын: эн,це,эс,о,аш,пэ,мыс,т.б
-
Химиялық элементтердің таңбасын латынша белгілеуді ұсынған қай ғалым?
-
Химиялық элемент ұғымын алғаш химияға енгізген ғалым?
-
Химиялық элемент дегеніміз не?
-
Молекула және атом дегеніміз не?
-
Химиялық элементтерді неше топқа бөлеміз?
Жаңа материалды оқыту: Салыстырмалық атомдық масса. Vl сыныптың физика курсынан масса ұғымы белгілі екенін ескеріп, оларды мынадай сұраққа жауап беруін сұраймыз.
Атомдардың массасын граммен не килограммен өлшеуге бола ма?
Атомдардың массасы өте кіші болғанымен олардың сандық мәні дәлдікпен анықталған. Мысалы ең жеңіл атом атом сутегінің атомдық массасы:
mа (H)=1.66*10-24 г немесе 1,66*10-27кг Оттегінің массасы одан 16 есе ауыр:
mа (O)=2.66*10-23 г немесе 2,66*10-26 кг-ға тең.
Мынадай сандарды пайдалану ыңғайсыз. Сондықтан атомдық массаны өлшеу үшін арнайы өлшем бірлігі, массаның атомдық бірлігі (м.а. б) қолданылады .
Массаның атомдық бірлігі (м.а. б.) бұл көміртегінің 1/12 атомдық массасына тең. Көміртегі атомның массасы:
2,0*10-26г немесе2,0*10-26кг,ал мұның 1/12 бөлігі
20*10-26kг =1.66*10-27кг =1,66*10-24г.
Осы мәндір м.а.б. деп аламыз. Бір атомдық масса бірлігіне тең сандық мәнді салыстырмалы атомдық масса деп анықтама беріледі. Салыстырмалы атомдық масса өлшемсіз шама екенін және оны (индексі ағылшын тілінде relative- "салыстырмалы " деген мағына береді ).
Мысалы оттегі үшін:
Ar=2.66*10-23 = 16
0.66*10-23
массасының атомдық бірлігімен (м.а.б.) алынған атомдар массасынан салыстырмалы атомдық массаның өлшемсіз шамасын ажырата білу керек.
мысалы; mа (H)=1м.а.б. Аr (H) =1
та (O)=16 м.а.б. Ar (O ) =16
та (S)=32 м.a.б. Ar (S) =32
Демек сутегі атомның массасы көміртегі атомның массасына 1/12 бөлігіне тең екенін, ал оттегі ал оттегі атомның массасы 16 есе, күкірт 32 есе бұл масадан ауыр екенін көрсетеді.
Жаңа материалды қорытындылау:
1. Мыс атомының оттегінен,күкірттен,сутегінен қанша есе ауыр екенін есепте.
2. Неге атомдық массаны салыстырмалы ұғымда айтады? Жауабын математикалық жолмен көрсетіңіз.
3. Магний атомының массасы көміртегі атомының массасынан неше есе артық?
4. Оттегі атомы массасынан салыстырмалы атомдық массасы көп болатын үш элементті (Д.И.Менделеевтің периодтық жүйесі таблицасынан) көрсетіңіз.
5. Қандай мақсатта химияға «салыстырмалы атомдық масса» ұғымы енгізілген?
6. Салыстырмалы молекулалық масса дегеніміз не? Осы анықтаманы айқындайтын формуланы жазыңыз.
7. Салыстырмалы атомдық массалары 8 санынан кем болатын элементтерді атаңыз.
Үйге тапсырма беру. §8 1-10 жаттығу.
Күні
Сабақтың тақырыбы: Химиялық формулалар. Заттың салыстырмалы молекулалық массасы.
Сабақ мақсаты:
Білімділік: Оқушыларға заттың құрамын химиялық формуламен жазуға болатынын дәлелдеу.Ол заттың құрамына қандай элемент, оның қанша атомы өзара қандай қатынаста кіретінін түсіндіру. Дамытушылық: Заттың химиялық формуласы арқылы, оның салыстырмалы молекулалық массасы есептеуге оқушыларды машықтандыру, есептер шығара отырып ойларын дамыту.
Тәрбиелік: Өз еркімен жұмыс жасауға, ойын жеткізе білуге тәрбиелеу.
Сабақ көрнекілігі: Химиялық элементтер таңбасы жазылған кесте.Электрондық оқулық.
Сабақтың түрі: ізендіру, аралас сабақ.
Сабақтың әдіс-тәсілдері: деңгейлеп оқыту.
Сабақ барысы: Химиялық элемент жайлы түсінікті нақтылап, олардың әрқайсысына тән белгілерін, жай және күрделі зат жайлы түсініктерін тексеру мақсатымен 10 минуттық тексеру жұмысы жүргізіледі.
1-тапсырма. Аттарына сәйкес келетін химиялық элемент таңбасын танып білу. (Мұғалім элемент аты жазылған карточканы көрсетіп , жаппай немесе жеке айтқызады).
2-тапсырма. Элемент таңбасына қарай отырып, атын ата ( енді мұғалім элемент атомының символын көрсетеді, оқушылар оның аталуын табады).
3- тапсырма. Бірнеше элемент символы көрсетіледі.Оқушылар оқулықтағы кестені пйдалана отырып, олардың салыстырмалы атомдық массаларын табады.
Жаңа материалды оқыту: Химиялық формуланын көмегімен жай және күрделі заттардын құрамын қалай білу керек екеніне тоқталамын.
Химиялық формула - заттың құрамын химиялық элемент таңбалары және индекстер көмегімен шартты түрде бейнелеу.
Заттың салыстырмалы молекулалық массасы, берілген зат молекуласының массасы көміртек атомы массасының 1/12 бөлігінен неше есе ауыр екенін білдіреді.
Химиялық формула арқылы салыстырмалы молекулалық массасын табамыз:
Мr (H2O) = (2•1)+16=18
Заттың формуласы бойынша мыналарды білуге болады:
-
Жай немесе күрделі зат.(бір немесе бірнеше атом түрлерінен құралғандығын)
-
Сапалық құрамы (яғни атомдардың қандай түрлерінен құралған)
-
Сандық құрамы (яғни әр атом түрінің қаншасы кіреді)
-
Салыстырмалы молекулалық массасы (яғни берілген молекула массасы м.а.б-нен неше есе көп)
-
Элементтердің массалық қатынастары.
Төмендегі мысалдардан формула алдына қойылатын коэффиценттің және индекстің мәнін түсіндіреміз - 3O2, 4H20, 3P2O5, H2, 5H, 4H2.
Жаңа материалды қорытындылау:
Тапсырмалар мен сұрақтар беру.
-
Жай зат азоттың N2 және күрделі зат көмір қышқылының H2CO3 салыстырмалы молекулалық масса сын есептеп шығарыңыз.
-
Кальций фосфатының Са3(РО4)2 салыстырмалы молекулалық массасын есептеп шығарыңыз.
-
Химиялық формула дегеніміз не?
-
Заттың салыстырмалы молекулалық массасы дегеніміз не?
-
Формулада индекс нені көрсетеді?
-
Формулада коэффициент нені көрсетеді?
-
Мына заттардың химиялық формуласын жазыңдар: сутек атомы,сутек молекуласы,оттектің екі атомы,оттектің молекуласы,сутектің екі молекуласы.
-
Мынадай заттардың химиялық формулаларын оқыңдар: азот қышқылы HNO3, күйдіргіш калий KOH, калий перманганаты KMnO4, тотияйын CuSO4, NaHCO3.
Үйге тапсырма беру. §9. 1-10 жаттығу. Темірболатова.
Бағалау.
Күні
Сабақтың тақырыбы: Химиялық формула бойынша есептеулер.
Сабақтың тақырыбы:
Білімділік: Заттың сандық және сапалық құрамын білдіретін химиялық формула жайлы білімді қалыптастыру.
Дамытушылық: Заттың Мr,күрделі зат құрамындағы элементтің массалық үлесін табуды есептер шығара отырып үйрету және логикалық ойларын дамыту.
Тәрбиелік: Өз еркімен жұмыс жасауға, ойын жеткізе білуге тәрбиелеу.
Сабақтың түрі: аралас сабақ.
Әдіс-тәсілдері: есептер шығару.
Сабақ барысы: Ұйымдастыру кезеңі.
Сабақты үй жұмысын тексеруден бастау.
-
Төменде берілген заттарда элемент жайлы айтыла ма: а)оттек демалу үшін қажет; ә)оттек судың құрамына кіреді;
-
Оттек, натрий, күкірт, сутек, калий, көміртек элементтерінің таңбаларын жазып, оны оқып беріңдер.
-
Таблицаны толтыру:
-
Формулалар
4H2
3CH4
3FeCI3
2H3PO4
Коэффициенттер
Индекстер
Әр атомның жалпы саны.
Жаңа сабақ тақырыбы тақтаға жазылады: Оқушыларға белгілі заттардың химиялық формуласын және сол арқылы салыстырмалы молекулалық массасын, күрделі заттағы әр элементтің массалық үлесін табуға есептер шығарып үйрету.
1. Заттың формуласы бойынша салыстырмалы молекулалық массасын есептеу.
Мr(H2O) = 2Ar(H) + 1Ar(O)= 2•1+16=18
2. Күрделі зат құрамындағы элементтердің массалық қатынастарын есептеу.
1-есеп: Алюминий гидроксидіндегі А1(ОН)3 алюминий, оттек және сутек атомдары массаларының қатынасын есептеңдер.Шешуі: Әр элементтің атом санын оның салыстырмалы атомдық массасына көбейтіп алюминий, от- тек, сутек массаларының қатынастарын тауып, сосын қысқартамыз:
m(А1) ׃ m(О) : m(Н) = Ar(А1) : 3Аг(O) : 3Ar(Н) = 27 : 48 : 3 = 9׃16:1 =15
Жауабы: Алюминий гидроксидінің қүрамындағы алюминий, оттек, сутек атомдары массаларының қатынасы: m(AI) : m (H) : m(O) = 9 : 16 : 1.
3. Күрделі зат құрамындағы элементтердің массалық үлестерін есептеу
2-есеп: Алюминий гидроксиді А1(ОН)3 құрамындағы элементтердің массалық үлестерін есептеңдер. Есепті екі тәсілмен шығаруға болады:
1) массалық үлестің дайын формуласын пайдалану;
2) пропорция арқылы.
2) Оттектің массалық үлесін у деп пропорция қүрамыз:
78 - 100 %,
3 •16 - у ![]()
3) Сутектің массалық үлесін z десек: 78 - 100 %,
3 • 1- z ![]()
Жауабы. ω(АІ) = 34,6%, ω(0) = 61,5%, ω(Н) = 3,9%.
Жаңа материалды бекіту мақсатында жаттығулар мен есептер жинағы бойынша есептер беріліп шығарылады.
Үйге тапсырма беру:§ 10. 1-63,1-64,1-65,1-77,1-111,1-112, 1-110. Есептер жинағы
Бағалау.
Күні
Сабақтың тақырыбы: Химиялық элементтердің валенттілігі.
Сабақтың мақсаты: Білімділік: Валенттілік туралы түсінік беру. Екі элементтен тұратын заттың берілген формуласы бойынша валенттіліктерін анықтауға үйрету. Дамытушылық: Валенттілік құра отырып ойларын тереңдетіп дамыту. Тәрбиелік: Ұжымдық жұмысқа, таза жазуға тәрбиелеу.
Құрал − жабдықтар: Химиялық таңбалар және элементтердің салыстырмалы атомдық массасы берілген кесте. Сабақтың түрі: аралас сабақ. Әдіс-тәсілі: өзіндік жұмыс.
Тірек білім мен біліктер: Элементтердің химиялық таңбасын білу, салыстырмалы молекулалық массаны анықтау, индекс, коэффициент, ең кіші ортақ еселік.
Білім мен біліктерін тексеру: Оқушылардың салыстырмалы молекулалық массаны есептеу біліктерін химиялық формула туралы түсініктерін тексеру және бекіту мақсатында құрастырылған 10−15 минутқа есептелген өзіндік жұмыс ұсынылады.
1 - нұсқа.
1.Химиялық таңбалар арқылы өрнекте: оттегінің бес молекуласы; оттегінің екі жеке атомы; оттегінің бір молекуласы; екі молекула оттегі;
2.Na2CO3 химиялық формуласы нені көрсетеді?
2 - нұсқа.
1.Төмендегі белгілер нені көрсетеді: 5Н; Н2; 7Н2;
2.HNO3 химиялық формуласы нені көрсетеді?
3 - нұсқа
1.Химиялық таңбалар арқылы жазып өрнекте: күкірттің бес атомы; сутегінің бір ,молекуласы; судың үш молекуласы; сутегінің үш молекуласы;
2.Н3РО4 химиялық формуласы нені көрсетеді?
4 - нұсқа
1.Төмендегі химиялық формулалар нені көрсетеді? 3О2; 5О; О;
2.Күкірт қышқылының химиялық формуласы - Н2SO4. Осы формула бойынша ,,,,,,,,,,,,қышқылдың сандық және сапалық құрамын көрсет.
Жаңа материалды оқыту:
1. Оқушыларды бейметалдардың сутекті қосылыстарының мысалында атом валенттілік терінің жаңа қасиеттерімен таныстыру. HBr, H2S, PH3, SH4, CH4, H2O, NH3. Валенттілікке анықтама бергеннен кейін, жоғарыда көрсетілген заттардың формулалары жазылып, оқушыларды бромның, күкірттің, фосфордың, кремнийдің, көміртегінің, оттегінің және азоттың валенттіліктерін осы элементтер мен қосылған сутегі атомдарының жалпы саны бойынша анықтауға жаттықтыру жұмысы жүргізіледі.
2. Егер бір элементтің валенттілігі белгілі болса екінші элементтің валенттілігін табуға болатындығын Al2O3 мысалымен түсіндіреміз.
Оның алгоритмі ұсынылады. (мұғалім бұл алгоритмді кесте түрінде тақтаға іліп қоюына болады)
1. Қосылыстың формуласы жазылады: Al2 O3 ; ІІ
2. Қосылыстағы оттегі атомының валенттігі белгілі, оны рим санымен үстіне жазу: Al2O3 ;
3. Оттектің валенттігін оның индексіне көбейтіп, алюминийдің индексіне бөлу:
ІІ * 3 = 6; 6 : 2 = III; ІІІ ІІ
4. Қосылыстағы алюминийдің валенттігі үшке тең, оны рим санымен үстіне жазу: Al2O3;
Тұрақты және ауыспалы валенттілік туралы түсінік беріледі. Оқушыларға дәптеріне тұрақты валенттілік сақтайтын элементтерді жаздырамыз.
I - валентті Na, K, Ag, H; IІ - валентті Mg, Ca, Ba, Zn, O; III - валентті Al
Элементтердің ауыспалы валенттілік көрсететіндігін дәлелдейміз. FeCl2, FeCl3, SO2, SO3, PbO2, CO, CO2 қосылыстарын мысалға ала отырып, бұл заттардың аталуындағы ерекшелікті түсіндіреміз. Мысалы, көміртегі (II) оксиді, көміртегі (IV) оксиді.
Жаңа материалды бекіту: Формуласы бойынша химиялық элементтердің валентілі гін табуды үйрету мақсатында төмендегі жаттығулар орындатамыз. Төмендегі сутегі мен оттегінің үстіне рим цифры арқылы валенттілігі қойылған, қосылыстағы қалған элементтердің валенттілігін рим цифрымен жазып көрсетіңдер.
І нұсқа: H2, MgO, Al2O3, HCl, P2O5,
ІІ нұсқа: SiH4, Na2O, BaO, Ag2O, H2O,
ІІІ нұсқа: N2O5, NH3, MnO2, ZnO, N2O,
Егер бұл жұмысты оқушылар сабақта үлгере алмаса, үйде аяқтау тапсырылады.
Үйге тапсырма беру: §11. (1-10) Жұмыс дәптері.
Күні
Сабақтың тақырыбы: Элементтердің валенттіліктері бойынша химиялық қосылыстардың формуласын құру.
Сабақтың мақсаты: Білімділік: Белгілі валенттілігі бойынша екі элементтен тұратын заттың формуласын құрастыруға үйрету. Дамытушылық: Химиялық қосылыстардың формуласын құруға есептер шығара отырып ойларын терең дамыту. Тәрбиелік: Өз еркімен жұмыс жасауға, ойын жеткізе білуге тәрбиелеу.
Құрал − жабдықтар: Химиялық таңбалар және элементтердің салыстырмалы атомдық массасы берілген кесте.
Сабақтың түрі: жеке жұмыстар.
Сабақтың әдіс-тәсілдері: өз еріктерімен жұмыс жасау.
Тірек білім мен біліктер: Элементтердің химиялық таңбасын білу,салыстырмалы молекулалық массаны анықтау, индекс, коэффициент, ең кіші ортақ еселік.
Оқушылардан валенттіліктің анықтамасын және бір, екі, үш т.б. валентілік, ауыспалы валенттік көрсететін элементтерді сұраймын. Содан соң оқушыларға химиялық элементтердің валенттілігін формуласы бойынша анықтау білігін бекіту мақсатында төмендегі жұмысты орындатамыз.
Төменде екі элементтен тұратын формулалар берілген, формулаларды көшіріп, осы қосылыстағы әрбір элементтің валенттілігін көрсетіп жаз.
І нұсқа: I) SiH4, HCl, H2S; 2) MgO, H2O, N2O3,
ІІ нұсқа: 1) PH3, HI, H2O; 2) N2O5,Na2O, CaO,
IІІ нұсқа: I) HBr, CH4, NH3; 2) Cu2O, BaO, NO2,
Мұнан кейін екі химиялық элементтен тұратын қосылыстың формуласын валенттілігі бойынша құрастыру алгоритмін ұсынамыз:
1. Элементтердің таңбаларын жазу: FeO; CІO; III II VII II
2. Әрбір элемент белгісінің үстіне валенттігін қою: Fe O; Cl O;
3. Валенттік мәндерінің ең кіші ортақ еселігін табу: 3*2=6 7*2=14
4. Қосылыстағы элементтер атомдарының қатынастарын табу: 6:3=2 14:7=2
6:2=3 14:2=7
5. Элементтердің индекстерін жазу: Fe2 O3 ; Cl2 O7 ;
6. Қосылыстың формуласын жазу: Fe2O3, Cl2O7
Оқушыларды осы алгоритм бойынша валенттілігі белгілі қосылыстардың формулаларын құрастыра білуге дағдыландыру үшін тапсырмаларды орындатамыз.
Мына элементтердің оттегімен қосылыстарының формуласын құрастырыңдар
І нұсқа: Na, Cl (V), S(VI), Mg, ІІ нұсқа: Zn, H, Ba, S (IV),
IІІ нұсқа: N (V), AI, C (IV), P (V), IV нұсқа: Ag, Mn (IV), Fe (III), Ca.
1.Төмендегі формулалардан бір,екі,үш,төрт,бес, валентті элементтерді бөліп жазыңдар:
Na2O, HCI, CI2O5, PH3, Fe2O3; CrO3, MgO, ZnO, SiO2, As2O5.
2.Натрийдің, магнийдің оттегімен, сутегінің хлормен (І), азотпен (ІІІ), қосылыстарының формулаларын жазыңдар.
3.Мына металдардың хлормен (І) қосылыстарының формуласын жазыңдар: алюминий; калий; мыс;
4.Натрийдің: күкіртпен (ІІ); азотпен (ІІІ), хлормен (І) қосылыстарының формулаларын жазыңдар.
5.Рим саны арқылы элементтердің валенттігің көрсетіңдер.
а) хлоридтерде, егер хлор бір валентті болса: AICI3, BaCI2, KCI;
ә) сульфидтерде, егер күкірт екі валентті болса: Na2S, ZnS, Cr2O3;
б) иодидтерде, егер иод бір валентті болса: AIJ3, CaJ2, KJ,
6.Темір - ауыспалы валенттілік көрсететін химиялық элемент. Темірдің (ІІ),(ІІІ) оттегімен, күкіртпен (ІІ), хлормен (І) қосылыстарының формуласын жазыңдар.
7.Азот оттегімен қосылысында бірден беске дейін валенттілік көрсете алады. Азот оксидтерінің формулаларын жазыңдар.
8.Марганец оттегімен қосылыстарында 2,3,4,6,7 валенттілік көрсетеді. Марганец оксидте- рінің формулаларын жазыңдар.
9.Хлор оттегімен мынадай қосылыстар түзеді: СІО3, СІ2О, СІ2О7, СІО2. Әрбір қосылыстағы хлордың валенттігің есептеңдер және ең жоғары валенттігін анықтаңдар.
Үйге тапсырма беру: §12. (1-7) .
Күні
Сабақтың тақырыбы: Химияның стехиометриялық заңдары.
Сабақтың мақсаты: Білімділік: Атомдардың бір-бірімен белгілі қатынаста қосылатынын, оның анықтамасын, мазмұнын айтып беру. Дамытушылық: Оқушының өз ойын түсіндіріп,тақырыптың мәнін аша білуге дағдыландыру.Тәрбиелік: Өз еркімен жұмыс жасауға, ойын жеткізе білуге тәрбиелеу.
Құрал-жабдықтар: Күкірт ұнтағы, келі, прабирка, штатив, магний, суы бар ыдыс,химиялық элементтер таңбасы жазылған кесте.
Тірек білім мен біліктер: Атом, малекула, масса, физика курсынан атом- малекулалық ілімінің негізгі қағидалары.
Сабақ барысы: Ұйымдастыру кезеңі.
Оқушылардың білім мен біліктерін тексеру үшін тапсырмалар беру:
-
Валенттілік деген не?
-
Валенттіліктің түрі қандай болады?
-
Бинарлы қосылыс деген не?
-
Молекула және атом деген не?
-
Оксид деген не?
Мысалы: Молекуласында екі атом фосфор және бес атом оттек тұрса, ондағы фосфордың валенттігін табыңдар.
Жаңа материалды оқыту: Оқушыларға бірнеше сұрақтар қойылады.
-
Неге темір сульфидін алатын тәжірибені жасағанда массасы 4г күкірт пен массасы 7г темір өлшеп алады?
-
Неге 9г темір алмайды?
Атом, малекула деген ұғымдарды пайдалана отырып, темір сульфидінің бір молекуласы түзілу үшін темірдің бір атомы мен күкірттің бір атомы әрекеттесетініне көңіл аударады. Демек темір сульфиді түзілу үшін кез келген массасын алғанда темір мен күкірттің бірдей атом саны қатысады. Егер Ar/Fe/=56, Ar/S/=32, онда олардың массаларының қатынасы мынадай: 56:32=7:4
Массасы 7г темірде болатын атом саны, массасы 4г күкіртте де болады. Темір сульфидін қандай әдіспен алса, оның құрамы бірдей. Темірдің (Fe) 7 массалық бөлігіне, күкірттің (S) 4 массалық бөлігі сәйкес келеді. Массасы, суда 8 массалық бөлік оттегіне 1 массалық бөлік сутегі келеді.
Атом - малекулалық ілім тұрғысынан алғанда заттың құрам тұрақтылық заңы былай түсіндіріледі: химиялық элемент атомдары бір-бірімен әрекеттескенде кез келген мөлшерде емес, түрақты бөліктері ғана әрекеттесіп, жаңа зат түзеді.
Бұл заңды 1806 жылы француз ғалымы Ж.Л.Пруст ашқан. Оқушыларға оқулықтан құрам тұрақтылық занының ережесін табу тапсырылады. Заттың (сапалық және сандық) құрам тұрақтылығына басқа да мысалдар келтіріледі. Химиялық формуланын көмегімен жай және күрделі заттардын құрамын қалай білу керек екеніне тоқталады.
Жаңа материалды бекіту:
1. Төменде екі элементтен тұратын формулалар берілген, формулаларды көшіріп, осы қосылыстағы әрбір элементтің валенттілігін көрсетіп жазыңдар:
I нұсқа: CaCl2 , ZnS , N2O3.
II нұсқа: Cu2S , NO2 , ZnO
III нұсқа: H2S , SO2 , CuO
2. Қосылыстың сандық және сапалық құрамын біле отырып, формуласын құрыңдар және ондағы элементтердің валенттіліктерін анықтаңдар:
а) бір атом күкірт пен үш атом оттегі;
ә) екі атом азот пен бес атом оттегі;
б) екі атом сутегі, бір атом көміртегі, үш атом оттегі;
3. Егер мыс пен оттегінің массалық қатынасы бірінші жағдайда 4:1, ал екінші жағдайда 8:1 болса, онда мыс оксидтерінің тиісті формуласын құрыңыз,
4. Формуласы СаСО3, кальций карбонатындағы элементтердің массалық қатынастарын анықтаңыз. 5. Күкірттің әр түрлі SO2 және SO3 оксидтеріндегі күкірт және оттегі элементтерінің массалық қатынасын есептеңіз.
Үйге тапсырма беру. §13 1-8 жаттығулар.
Бағалау.
Күні
Сабақтың тақырыбы: Химиялық реакция теңдеулері .
Сабақтың мақсаты: Білімділік: Химиялық реакция теңдеулерін жазу, коэффициент қою,жазылған реакция теңдеулерін білу икемділіктерін қалыптастыру. Дамытушылық: реакция теңдеулерін теңестіре отырып логикалық ойларын дамыту. Тәрбиелік: Өз еркімен жұмыс жасауға, ойын жеткізе білуге тәрбиелеу.
Құрал-жабдықтар: Кестеге жазылған алгоритм, элементтердің валенттілігі көрсетіл- ген кесте.
Тірек білім мен біліктер: Заттың құрам тұрақтылық қағидасы, зат массасының сақталу заңы, химиялық формулаларды құрастыру.
Білім мен біліктерін тексеру: Заттың құрам тұрақтылығы жөніндегі қағида, қоспа мен химиялық қосылыстарды ажыратуға, химиялық қосылыс құрамын формула арқылы көрсетуге мүмкіндік туғызды.
1. Зат массасының сақталу заңының маңызы неде ?
Бұл сұраққа оқушылар өткен сабақта алған біліміне сүйене отырып жауап береді.
Мұғалім оқушылардың пікір алысуын, ойлау іс-әрекетін басқара отырып, тек зат масса- сының сақталу заңының ашылуы нәтижесінде химиялық формулаларды теңдеу ретінде көрсетуге мүмкіндік туды деген қорытындыға келтіру керек .
Осыдан кейін мұғалім оқушыларды сабақ мақсатымен таныстырып өтіп, жаңа материалды түсіндіруге кіріседі:
Судың айырылу реакциясын мысалға ала отырып теңдеудің сол жағы мен оң жағындағы формулаларды, қойылатын таңбаларды, индекстерді жазып көрсеткеннен кейін мұғалім химиялық реакция теңдеуінің коэффициенті деген жаңа ұғымды түсіндіреді. Оқушы коэффициенттің не үшін керектігін білу қажет. Осы мақсатта оқушыларға мынадай сұрақ беріледі:
1. Химиялық реакциялардың мәні неде?
Мұғалімнің оқушыларды химиялық реакцияның мәні бастапқы заттардың атомдары өзара қайта топтасып, жаңадан байланысуында деген тұжырым жасауына бағдарлау керек. Осыған сүйене отырып, мұғалім реакцияны коэффициент арқылы теңестіруді көрсетеді. Химиялық теңдеу коэффициенті жөніндегі білімін бекіту мақсатымен оқушыларға бірнеше теңдеуді теңестіру тапсырылады .
1/ ? AL + S = AL2S3
2/ ? Ca + O2 = ? CaO
3/ ? Fe + O2 = ? Fe2O3
Химиялық теңдеуді қалай оқуға болатындығын мұғалім көрсеткеннен кейін тақтадағы реакция теңдеулерін оқушыларға оқытады .
Жалпы бұдан былай қарай әрбір жазылған формуланы , химиялық теңдеуді ауызша оқытып отыру қажет, яғни оқушыларды химиялық тілмен сөйлей білуге дағдыландыра білген жөн . Оқушыларға химиялық теңдеулер дегеніміз не? деген сұрақ қойылады. Әрине оқушылардың жауабы толық дұрыс болмауы мүмкін . Бірақ бұл сұрақтың қойылуы оқушыларды ойландырып, сабақ барысында алған білімін қорытындылай білуге үйретеді.
Содан кейін мұғалім химиялық теңдеудің алгебралық теңдеуден айырмашылығына тоқталып өтеді .
Оқушылар химиялық теңдеулерді құру ережесін оқулықтан оқып , танысқаннан кейін төмендегі алгоритмді құрады. Ол үшін мұғалім алгоритмнің әрбір жолын өзінің қойған сұрағына жауап алғаннан кейін тақтаға жазып отырады немесе алгоритм кесте түрінде жазылған болса, мұғалім есепті шығару жолдарын қайталағаннан кейін таныстырып шығады. (Оқулықтан қарауға болады.)
Жаңа материалды бекіту:
1.Мына реакция теңдеулерінің коэффициенттерін қойыңыз:
а) N2 + H2 NH3 ә) CO + O2 CO2
б) Al + Cl2 AlCl3 в) KOH + H2SO4 K2SO4 + H2O
г) MnO2 + H2 Mn + H2O
2.Реакция нәтижесінде шыққан заттардың формуласын валенттігі бойынша құрыңыз, және реакция теңдеулерінің коэффициенттері қойып теңестіріңіз:
III II II II V II
а) Al + S Al S ә) Ba + O2 Ba O б) P + S P S
Үйге тапсырма беру: §114. (1-8) Жұмыс дәптері.
Күні
Сабақтың тақырыбы: Зат массасының сақталу заңы.
Сабақтың мақсаты: Білімділік: Оқушыларды зат массасының сақталу заңының мәнін ұғып, қарапайым мысалдар арқылы ойларын дамыту. Тәрбиелік: Өз еркімен жұмыс жасауға, ойын жеткізе білуге тәрбиелеу.
Құрал - жабдықтар. Темір, күкірт, мыс ұнтақтары, спиртшам, сынауықтар, тұрғы, зертханалық таразы.
Тірек, білім мен біліктер: Құрам тұрақтылық заңы, зат массасы, қоспалар, химиялық қосылыстар, химиялық реакция заттың салыстырмалы молекулалық массасын, зат массасын есептеу, химиялық қосылыстардың формуласын құрастыра білу.
Сабақ барысы: Зат массасының сақталу заңын дұрыс түсініп, игеруін қамтамасыз ету мақсатымен оқушыларды жаңа ұғымды қабылдауға дайындау. Ол үшін оқушыларға көп сұрақтар қойылады.
-
Қоспа мен химиялық қосылыстың айырмашылығы неде?
-
Заттың химиялық формуласының маңызы мен қажеттігі неде?
Сұрақтарға жауап беру барысында оқушылардың өзара пікір алысуына көмектесе отырып, жаңа материалды қабылдауға қажетті ұғымдарды естеріне түсіру.
а) Алыну әдісіне қарамастан химиялық қосылыстардың құрамы тұрақты;
ә) Химиялық реакция кезінде атомдар сақталады.
б) Реакция нәтижесінде түзілетін өнімдер бастапқы алынған зат құрамындағы атомдардан құралады деген қорытындыға келу.
Осы қорытындыларға сүйене отырып, химияның негізгі заңдарының бірі - зат массасының сақталу заңын түсіндіремін. Сабақ мақсатымен таныстырамын.
1.Реакция кезінде атомдар сақталса, реакцияға түскен барлық атомдардың массасы сақтала ма?
Осы тұста оқушыларға белгілі темір сульфидін алу реакциясын көрсетуге болады. Заттардың құрам тұрақтылық қағидасына сай 7 г темір, 4 г күкірт өлшеп алу керек. Бастапқы заттарды өлшеймін, реакция аяқталғаннан кейін түзілген өнімді өлшеймін. Сонда түзілген өнімнің массасы 11 г, ал бастапқы алған заттардың жалпы массасы да 11 г-ға тең болады. (КК) Тәжірибені талдау нәтижесінде оқушылар химиялық реакцияда түзілген өнімдердің массасы бастапқы заттардың жалпы массасына тең болады деген қорытындыға келеді.
Іс жүзінде көпшілік жағдайда бұл ой дұрыс емес сияқты болып көрінеді. Неге?
Алдын ала өлшеніп алынған темір ұнтағы не мыс ұнтағы қыздырылады. Бастапқы заттың түсінің өзгергеніне оқушылар назарын аудара отырып, химиялық реакцияның жүріп жатқанын айтамын.Түзілген өнім өлшенеді. Бастапқы және реакция нәтижесінде түзілген өнімнің массалары тең емес екеніне оқушылардың көзі жетеді. Оқушылар үшін туған бұл қарама- қайшылықты М.В.Ломоносовтың жүргізген тәжірибесін айтып, түсіндіремін. Осыдан кейін оқушыларды зат массасының сақталу заңының қазіргі анықтамасымен таныстырып, дәптерлеріне жазғызамын.
Енді зат массасының сақталу заңының маңызына тоқталайық .
Біріншіден, бұл заң табиғатта заттардың жоқтан пайда болмайтынын немесе мүлдем жойылмайтындығын, яғни материяның мәңгі екендігін дәлелдейді. Осы арқылы оқушыларда материалистік көзқарас қалыптасады, дүние танымдары кеңейеді.
Екіншіден, бұл заң химиялық реакцияның мәнін ашады, яғни бастапқы заттардың құрамындағы атомдар реакция нәтижесінде түзілетін заттардың құрамына кіреді. Бастапқы заттардың атомдары өзара қайта топтасып, жаңадан байланысуының нәтижесінде жаңа заттар түзіледі.
Үшіншіден, бұл заң химиялық реакция теңдеуін жазуға, сол теңдеу көмегімен есептеу лер жүргізуге мүмкіндік туғызды. Демек ,бастапқы заттардың біреуінің массасы белгілі болса реакцияға түскен басқа заттардың не түзілген заттардың массасын есептеп шығаруға болады.
Мысалы: 12г күкіртті темір ұнтағымен қыздыру нәтижесінде 33г темір сульфиді түзілді.Қанша грамм темір реакцияға қатысты?
Берілгені: m(FeS) = 33г Шешуі: 33г - 12г = 21г Жауабы: m(Fe) = 21г
m(S) = 12г
Т/к: m(Fe) = ?
-
Массасы 24г мыс сульфиді түзілу үшін 16г мыс алынған. Ал күкірттің неше грамы керек?
-
Массасы 56г магний сульфидін алу үшін 32г күкірт жұмсалды. Ал магнийдің қанша грамы жұмсалады?
Сабақ соңында оқушыларға қойылатын бекіту сұрақтары:
-
Зат массасының сақталу заңын ашқан кім?
-
Зат массасының сақталу заңының анықтамасын айт.
-
Реакция нәтижесінде зат массасының сақталатынынқалай дәлелдеуге болады?
Үйге тапсырмаберу: § 15. (1-8) Жұмыс дәптері.
Күні
Сабақтың тақырыбы: Атом - молекулалық ілім.
Сабақтың мақсаты: Білімділік: Оқушылардың атом және молекула жайлы білімін бір жүйеге келтіру ол ұғымдарды жинақтай білу. Дамытушылық: Заттар жайлы ұғымды түсіну ғылымда атом - молекулалық ілімнің рөлін көрсету.Тәрбиелік: Өз еркімен жұмыс жасауға, ойын жеткізе білуге тәрбиелеу.
Құрал - жабдықтар: М.В.Ломоносовтың, Д.Дальтонның портреттері.
Тірек білім мен біліктер. Атом молекулалық негізгі қағидалары.
Сабақтың барысы: Сабақтың бас кезінде жалпы жаттығу жұмысын өткізу. Оның мақсаты оқушылардың валенттілікке сүйеніп заттың формуласын құра білуін тексеру.
1 - нұсқа
1.Мына элементтердің: Mn(VII), Cr(VI), Na(I) оттегімен түзетін қосылысының формуласын құр.
2.Мына элементтердің: K(I), AI(III), Pb(II)фтормен F(I) түзетін қосылыстарының формуласын құр.
2 - нұсқа
1.Мына элементтердің: Hg(II), Ba(II), Ag(I) хлормен CI(I) түзетін қосылысының формуласын құр.
2.Мына элементтердің: Fe(II), K(I), Cr(III) күкіртпен S(II) түзетін қосылыстарының формуласын құр.
3 - нұсқа
1.Мына элементтердің: Cu(I), Fe(III), Ca(II) оттегімен түзетін қосылысының формуласын құр.
2.Мына элементтердің: Na(I), Zn(II), AI(III) хлормен CI(I) түзетін қосылыстарының формуласын құр.
4 - нұсқа
1. Мына элементтердің: AI(III), Ag(I), Pb(II) күкіртпен S(II) түзетін қосылысының формуласын құр.
2. Мына элементтердің: P(V), S(VI), Zn(II) оттегімен түзетін қосылысының формуласын құр.
Жаңа материалды оқыту. Жаңа материалды оқыту мынадай жоспармен жүргізіледі:
-
Мұғалімнің ежелгі грек ғалымдарының атом туралы көз қарастары және атом деген атау қалай берілгендігі туралы хабары.
-
М.В.Ломоносов атом - молекулалық ілімінің негізгі бағыттары, оны ағылшын ғалымы Джон Дальтон дамытуы және сол кездегі белгілі болған элементтердің атомдық массасын табуға арналған жұмыстар.
-
Карлсруэ (1860) қаласында өткен халықаралық химиктер съезінде атом молекулалық ілімді түпкілікті бекіту және атомның бөлінбейтіндігі туралы көз қарасты өзгерту, молекула және атом ұғымдарының анықтамаларын қабылдау;
-
Атом - молекулалық теория негіздерінің жаңа көзқарастарынан алған қағидалары.
-
Физикалық және химиялық құбылыстарды атом - молекулалық көзқарас тұрғысынан түсіндіру (диффузия,физикалық және химиялық құбылыстар).
Мұғалім қазіргі күнге дейін маңызы зор атом - молекулалық ілімнің химиядағы негізгі теория екенін түсіндіре бастайды. Атом - молекулалық ілімді алғаш химияға пайдаланып, оны әр қарай дамытқан ғалым М.В.Ломоносов еді. Ілімнің негізгі қағидалары төмендегідей:
1.Барлық заттар «корпускуладан» тұрады.(молекулшаны Ломоносов солай деп атаған)
2.Молекулалар элементтен тұрады. (атомды Ломоносов солай деп атаған)
3. Бөлшектер - молекула және атом үнемі қозғалыста болады.
4.Жай заттың молекулалары бірдей атомдардан, ал күрделі заттың молекулалары әр түрлі атомдардан тұрады. Одан ары қарай заңды оқып үйрену жоғарыда берілген жоспармен жүргізіледі.
Жаңа материалды бекіту. Жаңадан оқып үйренген тақырыпты есте сақтау үшін оқушылар төмендегідей сұрақтарға жауап береді:
а) атом - молекулалық ілімнің негізгі мәнін түсіндір;
ә) тәжірибелер нәтижесіне сүйене отырып, газдар мен сұйықтық молекуласындағы қозғалысты түсіндір.
б) атом - молекулалық теория тұрғысынан физикалық және химиялық құбылыстардың мәнін түсіндір;
в) тәжірибелер нәтижесіне сүйене отырып, газдар мен сұйықтың молекуласындағы қозғалысты түсіндір;
Егер уақыт жетсе сабақ соңында заттың құрамын анықтауға және валенттілікті біле отырып, заттың формуласын құруға төмендегідей тексеру жұмыстарын өткізуге болады.
1.Берілген жалпы оттегі қосылыстарының ішінен сәйкес келетіндерін таңдап ал. Егер фосфор (V), хлор (VII) валентті болса: R2O, R2O5, R2O7, RO, R2O3;
2.Берілген формулалардың WO3; Cr2O3; N2O5; Ag2O; Fe2O3; ішінен оттегі қосылыстарын таңдап ал. а) элемент бір валентті болса; б) элемент үш валентті болса;
3.Формуласы берілген: NO; H2S; FeCI3; AICI3; AI2O3; Mn2O7; Fe2O3; NaCI; N2O5; заттардың сәйкес аттарын тап: азот (V) оксиді; алюминий оксиді, темір (III) хлориді; күкірт (VI) оксиді; темір (III) оксиді; алюминий хлориді;
Үйге тапсырма беру: §16. (1-9) Жұмыс дәптері.
Күні
Сабақтың тақырыбы: Зат мольшері, Моль, Авогадро саны, Молярлық (мольдік) масса.
Сабақтың мақсаты: Білімділік: Зат мөлшерінің өлшем бірлігі - моль туралы, Авогадро саны жөнінде ұғым қалыптастыру. Заттың берілген өлшемі бойынша құрылымдық бөлшектердің санын анықтауға үйрену. Дамытушылық: Молярлық масса ұғымын, заттың молярлық массасын есептеп шығару білігін қалыптастыру. Масса, зат мөлшерінің өлшем бірлігі, молярлық масса деген ұғымдарды өзара байланыстыра отырып, есеп шығаруға үйрету. Молярлық және салыстырмалы молекулалық массалар сандық мәні бойынша тең болатындығын түсіндіру.Тәрбиелік: Өз еркімен жұмыс жасауға, ойын жеткізе білуге тәрбиелеу.
Сабақтың түрі: аралас сабақ. Пән/қ байланыс: физика, биология.
Құрал жабдықтар: зат мөлшері бір моль болатын металлдармен бейметаллдар үлгілері (күкірттің, темір ұнтағының, мырыштың, )
Тірек біліммен біліктер: Зат мөлшері, заттың салыстырмалы молекулалық массасы, зат мөлшерінің өлшем бірлігі, заттың салыстырмалы молекулалық массасын есептеу.
Жаңа материалды оқыту. Мұғалім өткен сабақтан байланыстыру мақсатымен оқушыларға бірнеше сұрақ қояды:
1. Заттың құрам тұрақтылығы дегеніміз не?
2. Темір сульфидінде темір мен күкірттің тұрақты масса қатынасы қанда?
Оқушыларға ұнтақтар 4 г. күкіртте күкірттің қанша атомы болса, 7 г. темірде темірдің сонша атомы болатынын түсіндіреді. Демек, әрбір темір атомы күкірттің бір атомымен қосылысады деген тағы бір тұжырымды оқушы өз бетімен жасайды.
Бұрын алған білімін еске түсіріп, талдау нәтижесінде жасаған қорытындыларына сүйене отырып, мұғалім заттардың атомдары мен молекулаларының қажетті санын алу іс жүзіне мүмкін еместігін айтады. Сондықтан химияда «зат мөлшері» деген физикалық шама қолданылады.
Ал зат мөлшері сол заттың құрылымдық бөлшектерінің санымен анықталады, яғни атом, молекула немесе басқа бөлшектер саны. Зат мөлшерінің өлшем бірлігі - моль. Моль-берілген заттың құрылымдық бөлшектері 12г көміртегіндегі атом санына сәйкес келетін зат мөлшері. ν (ню) әрпімен белгіленеді, құрылымдық бөлшектер саны Na әрпімен белгіленеді.
Заттың керекті мөлшерін қалай өлшеп алуға болады?
Осы жерде молярлық массаны пайдаланатындығын айтып, оқушыларды сабақтың мақсатымен таныстыру. Зат мөлшерін моль арқылы өрнектеген сияқты молярлық масса зат массасын грам арқылы көрсетеді. Демек, мұғалім «Заттың молярлық массасы М зат массасының зат мөлшеріне қатынасына тең шама» деген анықтаманы айтып, оқушылардың дәптеріне жазғызады.
Молярлық масса г/мольмен, яғни граммен алынған мольмен өрнектеледі: М=m / ν Мысалы: 1) M(H2)= 2 г/моль; 2) M(O2) =32 г/моль; 3) M(H2O) =18 г/моль
Оқушылардың өздігінен шығаруына берілетін есептер:
-
Массасы 112г темір неше моль болады?
-
Массаса 132г көміртегі(IV) оксиді неше моль болады?
-
Массасы 272г мырыш хлориді неше моль болады?
-
Мөлшері 0,3 моль көміртегі(IV) оксидінің массасын есептеп шығарыңдар;
-
Мөлшері 0,2 моль мыс (ІІ) оксидінің массасын есептеп шығарыңдар;
-
Мөлшері 0,5 моль судың массасын есептеп шығарыңдар;
Оқушылардың шығарған есептерін тексеріп, қателерін түзеткеннен кейін, жаңа тақырып бойынша қорытынды жасалады.
Сабақ соңында төмендегі сұрақтар көмегімен оқушыларда жаңадан қалыптастырылған ұғымдарды бекітуге болады:
-
Заттың молярлық массасы дегеніміз не?
-
Заттың молярлық массасының өлшем бірлігі не?
-
Қай формуланың көмегімен заттың молярлық массасын, массасын, мөлшерін анықтауға болады? Зат мөлшерінің өлшем бірлігі не?
-
Зат мөлшері қалай белгіленеді?
-
a) ν (C) = 4 моль деген жазу нені білдіреді?
б) ν (H2O)=2 моль деген жазу нені білдіреді?
-
Үш молекула су қанша моль болады?
Үйге тапсырма. § 17. (5-6)
Күні
Сабақтардың тақырыбы: Химиялық реакцияның типтері
Сабақтың мақсаты: Білімділік: Қосылу, орын басу, айырылу және алмасу реакциялары жөніндегі ұғым, оларды химиялық теңдеулері бойынша ажырата білу білігін қалыптастыру.
Дамытушылық: Химиялық реакцияның типтері бойынша есептер шығара отырып ойларын тереңдете дамыту.
Тәрбиелік: Өз еркімен жұмыс жасауға, ойын жеткізе білуге тәрбиелеу.
Құрал- жабдықтар: Суды айыруға қажетті құрал, сынауықтар, спиртшам, мыс, мырыш, темір, мыс (II) хлоридінің ерітіндісі.
Сабақтың түрі: аралас сабақ.
Сабақтың әдіс - тәсілі: есептер шығару, оқулықпен жұмыс.
Тірек білім мен біліктері: Зат массасының сақталу заңы , валенттілік , жай және күрделі заттар жөніндегі білім; заттың химиялық формуласын, химиялық теңдеуді құрастыра білу біліктері .
Сабақ барысы: Зат массасының сақталу заңына сүйеніп, химиялық реакцияларды бастапқы және алынған заттардың белгілері бойынша бірнеше түрге бөлуге болады. Солардың бірі қосылу, айырылуы, орынбасу және алмасу реакциялары. Мұғалім оқушыларға реакцияның химиялық теңдеуін жазуды тапсырады.
Бұл сабақта химиялық реакцияның төрт түрі - қосылу, айырылуы, орынбасу және алмасу реакциялары. талданады . Мұғалім мысал ретінде мысты ауада қыздырып көрсетеді. Оқушылар реакцияға тек мыс қатысты деп қателесуі мүмкін. Сондықтан сұрақ қойылады: реакцияға мыстан басқа тағы қандай зат қатысады?
Реакцияға мыстан басқа ауадағы оттегі қатысатынын анықтап алғаннан кейін оның теңдеуін оқушылар мұғалімнің басқаруымен жазады. Ол үшін мыстың валенттілігін, оттегі молекуласында қанша атом бар екенін еске түсіреді. Келесі мысалды тәжірибе жасап , түсіндіруге болады . Көрнекі көрсету: мыс хлоридінің ерітіндісіне мырыш түйіршіктері салынады. Мұғалім реакция өнімі түзілу үшін элемент атомдары бірінің орнын бірі басатынын тәжірибе нәтижесінен көрсетеді. Одан әрі мұғалім реакцияға түскен және нәтижесінде түзілген заттар санының тұрғысынан жоғарыдағы екі теңдеуді салыстыра отырып, оқушыларды орын басу реакциясының анықтамасымен таныстырады, дәптерге жазғызады. Одан әрі мыс (ІІ) оксиді мен тұз қышқылы әрекеттестіріледі. Реакция нәти- жесіндегі өзгерістер түсіндіріледі. Тақтаға жазылған теңдеулерді оқушылардың өздері теңестіреді: 2Cu + O2 = 2CuO А + В = АВ
2H2O = 2H2 + O2 АВ = А + В
СuCI2 + Zn = ZnCI2 + Cu АВ + С = СВ + А
CuO + 2HCI = CuCI2 + H2O АВ + СД = СВ + АД
Оқушыларға оқулықтағы (50бет) реакция типтеріне мысалды дәптерлеріне жазып алуды тапсыру.
Үйге тапсырма беру: §18. 6-9 жаттығулар.
Күні
Сабақтардың тақырыбы: Химиялық реакцияның типтері
Сабақтың мақсаты: Білімділік: Қосылу, орын басу, айырылу және алмасу реакциялары жөніндегі ұғым, оларды химиялық теңдеулері бойынша ажырата білу білігін қалыптастыру.
Дамытушылық: Химиялық реакцияның типтері бойынша есептер шығара отырып ойларын тереңдете дамыту.
Тәрбиелік: Өз еркімен жұмыс жасауға, ойын жеткізе білуге тәрбиелеу.
Құрал- жабдықтар: Суды айыруға қажетті құрал, сынауықтар, спиртшам, мыс, мырыш, темір, мыс (II) хлоридінің ерітіндісі.
Сабақтың түрі: аралас сабақ.
Сабақтың әдіс - тәсілі: есептер шығару, оқулықпен жұмыс.
Тірек білім мен біліктері: Зат массасының сақталу заңы , валенттілік , жай және күрделі заттар жөніндегі білім; заттың химиялық формуласын, химиялық теңдеуді құрастыра білу біліктері .
Сабақ барысы: Зат массасының сақталу заңына сүйеніп, химиялық реакцияларды бастапқы және алынған заттардың белгілері бойынша бірнеше түрге бөлуге болады. Солардың бірі қосылу, айырылуы, орынбасу және алмасу реакциялары. Мұғалім оқушыларға реакцияның химиялық теңдеуін жазуды тапсырады.
Бұл сабақта химиялық реакцияның төрт түрі - қосылу, айырылуы, орынбасу және алмасу реакциялары. талданады . Мұғалім мысал ретінде мысты ауада қыздырып көрсетеді. Оқушылар реакцияға тек мыс қатысты деп қателесуі мүмкін. Сондықтан сұрақ қойылады: реакцияға мыстан басқа тағы қандай зат қатысады?
Сабақты бекіту мақсатында оқушыларға химиялық реакция типтерін анықтай білуге, және теңдеулерді коэффициент қойып теңестіруге өздік тапсырмалар беру:
1-нұсқа. 2-нұсқа
1.Төмендегі реакция теңдеулерін теңестіріп таяқша орнына теңдік белгісін қойыңдар:
а) Mg + O2 - MgO а) Fe + O2 - Fe2O3
ә) Ag2O- Ag + O2 ә) P + O2 -P2O5
б) N2O5 + H2O - HNO3 б) KCIO3 - KCI + O2
в) AI + S - AI2S3 в) ZnO - Zn + O2
г) CuO + AI - AI2O3 + Cu г) Fe3O4 + AI - AI2O3 + Fe
д) CH4 + O2 - CO2 + H2O д) Na + H2O - NaOH + H2
2. Реакция теңдеулеріне тиісті коэффициент қойып, қай типке жататынын анықтаңдар:
а) МgCO3 = MgO + CO2 а) KCIO3 = KCI + O2
ә) Mg + HCI = MgCI2 + H2 ә) AI + HCI = AICI3 + H2
б) Na + O2 = Na2O б) N2 + H2 = NH3
в) KOH + H2SO4 = K2SO4 + H2O в) AI2O3 + HBr = AIBr3 + H2O
3.Мына оксидтердің айырылу реакциясының теңдеулерін құрыңдар:
а) Hg2O = ? + ? a) CuO = ? + ?
ә) HgCI2 + Cu = ? + ? ә) FeS + HCI = ? + ?
б) MgO + HCI = ? + ? б) CuO + H2 = ? + ?
Үйге тапсырма беру: §18. Темірболатова есептер жинағы
Күні
Сабақтардың тақырыбы: Химиялық реакция теңдеулері бойынша есептеулер.
Сабақтың мақсаты: Білімділік: Химиялық реакция типтері мен реакция теңдеулерін теңестіру ұғымдарын қалыптастыруды одан әрі жалғастыру. Дамытушылық: Реакция теңдеулері бойынша сандық есептер шығаруды үйрену.Тәрбиелік: ұқыптылыққа, өз еркімен жұмыс жасауға тәрбиелеу. Сабақтың түрі: аралас сабақ. Сабақтың әдіс-тәсілдері: деңгейлеп оқыту.
Тірек білім мен біліктер: Зат мөлшері, заттың салыстырмалы молекулалық массасы, зат мөлшерінің өлшем бірлігі, заттың салыстырмалы молекулалық массасын есептеу.
Сабақ барысы: Өзіндік жұмыс орындау арқылы реакция теңдеулерін теңестіруді еске түсіру, оны орындатуғатүрлі тәсілдерді ұсыну:
1-тапсырма: Төмендегі реакция теңдеулерін теңестіріңдер.
-
1-нұсқа
2-нұсқа
3-нұсқа
Ca + CI2 =
Na + O2 =
P + O2 =
AI + CI2 =
K + S =
Zn + O2 =
Ca + S =
AI + S =
H2 + O2 =
Жаңа сабақ: Зат массасының сақталу заңын қайталай отырып, реакция теңдеулеріне сүйеніп сан есептерін орындау заңды іске асырудың бір жолы екеніноқушылар есіне салу.
Оның практикалық мәні зор. Ең алдымен оңайырақ теңдеулерді пайдаланып, есеп шығаруды дағдыландырады. Одан әрі күрделірек есептерді беруге болады.
Оқушыларға теңдеуге сүйеніп зат мөлшерін, содан соң массасын табуға арналған есепті талдап, кітаппен жұмыс жасауды ұсынуға болады.
Есеп: 1 моль магний реакцияға түсу үшін қанша моль оттек қажет және қанша магний оксидінің зат мөлшері түзілетінін есептеңдер.
Берілгені: Мұндағы басты мақсат реакция теңдеуіне сүйеніп, есептеулер жасау.
ν(Mg)=1моль
Т/к: ν(О2)-? 1 моль х моль у моль
ν(MgO)-? 2Mg + O2 = 2MgO
2 моль 1 моль 2 моль
Енді есепті ауызша шығаруға болады. Жауап: 1 моль магний жану үшін 0,5 моль оттек қажет болса, 1 моль MgO түзіледі. Енді оның массасын табу үшін m=Mν формуласын пайдаланып, m(O2)= 32г/моль • 0,5 моль=16г; m(MgO)= 40г/моль • 1моль = 40 г.
Есептерді екінші сабақта жалғастыру.
Химиялық реакция теңдеулерін жаза білу және ол бойынша есептер шығаруды қорытын- дылап жүйеге келтіру.
Сабақты бекіту мақсатында шығарылатын есептер:
-
8г мыс(ІІ) оксидін алу үшін қанша грамм мыс реакцияға түседі?
-
Нәтижесінде 4 моль сутек алу үшін қанша грам суды айыруға болады?
-
Массасы 6,5г цинк оттекпен әрекеттессе цинк оксидінің қанша зат мөлшерін алуға болады?
-
1 моль алюминий күкіртпен реакцияға түсу үшін қанша күкірт қажет және түзілген алюминий сульфидінің массасын есептеңдер?
-
Оттегінде 54г алюминий жанған кезде, алынған алюминий оксидінің массасы қандай?
-
Массасы 360г алюминий сульфидін алу үшін, оған жұмсалған алюминий мен күкірттің массасын есептеп шығар.
-
8г мыс(ІІ) оксидінен мысты жеке бөліп алу үшін, қанша грамм сутегі жұмсалады?
-
8г сутегі жанғанда түзілетін судың массасы және зат мөлшері қанша?
-
Реакцияға 16г оттегі түскенде судың қандай зат мөлшері шығады?
-
Реакциядан 9г су түзіледі. Реакцияға түскен оттегінің массасын және зат мөлшерін табыңдар.
Үйге тапсырма беру: §19 Есептер жинағы.
Күні
Сабақтың тақырыбы: Бастапқы химиялық ұғымдар тақырыбы бойынша бақылау жұмысы №1.
Сабақтың мақсаты: Оқушылардың осы тақырып бойынша алған білімде- рін жүйелеу, алған білімдерін тексеру барысында үш нұсқада бақылау жұмы сын жүргізу.
Сабақ барысы:Ұйымдастыру кезеңі. Бақылау жұмысын екі нұсқада жүргізу:
1 нұсқа
-
Мына қосылыстардағы элементтердің валенттілігін анықтаңдар:
III I V II VI II I II VI II
NH3, P2O5, CrO3, H2S, SO3
-
Массасы 6,5 г мырыш оттекпен әрекеттессе мырыш оксидінің қанша зат мөлшерін алуға болады?
Бер: 2Zn + O2 = 2ZnO
m (Zn)=6,5 г. Ш: М(ZnO) = 65+16=81 г/моль
т/к: υ (ZnO)-? υ= ![]() =
= ![]() = 0,08 моль (ZnO)
= 0,08 моль (ZnO)
-
Төмендегі химиялық реакция теңдеулерін теңестіріп, типін анықтаңдар.
а) 2 Fe(OH)3 = Fe2O3 + 3H2O айырылу реакциясы
ә) 2 Na + CI2 = 2NaCI қосылу реакциясы
б) 4 Na + 4H2O = 4 NaOH + 2H2 орынбасу реакциясы
-
Төмендегі қосылыстардың формуласын құрыңдар:
а) кальций мен хлор;
ә) азот (V) пен оттек;
б) алюминий (III) мен оттек;
в) натрий мен күкірт (II);
Ж: CaCI2, N2O5, AI2O3, Na2S.
-
Мыс (II) оксидіндегі элементтердің массалық үлестерін есептеңдер.
Бер: CuO Шешуі: Ar (Cu) = 64
т/к: ω (Cu)% - ? Ar (O) = 16
ω (O)% - ? Mr (CuO) = 64+16=80
ω (Cu)%= ![]() =
= ![]() = 80%
= 80%
ω (O)% = ![]() =
= ![]() = 20
= 20
2 нұсқа
-
Мына қосылыстардағы элементтердің валенттілігін анықтаңдар.
VI II III II I I III I IV I
SO3, P2O3, NaCI, Fe(OH)3, CH4
-
0,8 кг мыс (II) оксидінде неше моль бар?
Бер: m(CuO) = 0,8 г. M(CuO) = 80 г/моль = 0,080 кг/ моль
т/к: υ (CuO) - ?
υ= ![]() =
= ![]() = 10 моль (CuO)
= 10 моль (CuO)
3. Төмендегі химиялық реакция теңдеулерін теңестіріп, типін анықтаңдар.
а) 2Mg + O2 = 2MgO қосылу реакциясы
ә) AI + 2HCI = AICI2 + H2 орынбасу реакциясы
б) 2KMnO4 = K2MnO4 + MnO2 + O2 айырылу реакциясы
4. Төмендегі қосылыстардың формуласын құрыңдар:
а) калий мен хлор;
ә) азот (VI) пен оттек;
б) алюминий мен оттек;
в) күкірт (II) пен оттек;
Ж: КCI, NO3, AIO, SO.
5. Кальций оксидіндегі элементтердің массалық үлесін есептеңдер.
Бер: CaO Шешуі: Ar(Ca) = 40
Ar(O) = 16
т/к: ω![]() (Ca)%-? Mr (CaO) = 56
(Ca)%-? Mr (CaO) = 56
ω (O)% - ?
ω (Ca)%=![]() =
= ![]() =71,5%
=71,5%
ω (O)% =![]() =
= ![]() =28,5%
=28,5%
1-нұсқа:
-
Мына қосылыстардағы элементтердің валенттігін анықтаңдар:
NH3, P2O5 , CrO3 , H2S , ,SO3;
2. Мыс (І) және мыс(ІІ)оксидтерінің құрамындағы мыстың массалық үлестерін пайызбен есептеңдер.
-
Төмендерілген химиялық реакция теңдеулерін теңестіріп, типтерін анықтаңдар:
а) AgCI = Ag +CI2; ә) K + O2 = K2O; б) Fe + HCI = FeCI2 + H2;
4. 7H, 3CaO, 5H2 белгілері нені көрсетеді?
5. Массасы 6г магний жанғанда қанша грамм магний оксиді түзілетінін есептеңдер.
2-нұсқа:
1. Төмендегі қосылыстардың: а) кальций мен хлор; ә) азот(V) пен ,оттек; б) алюминий мен ,оттек; в) натрий мен күкірт (ІІ) формуласын құрыңдар.
2. Мына әктастың CaCO3 құрамындағы әр химиялық элементтің ,массалық үлесін табың дар.
3. Төмендерілген химиялық реакция теңдеулерін теңестіріп, типтерін ,анықтаңдар:
а) Fe(OH)3=Fe2O3 + H2O; ә) Na + CI2 = NaCI; б) Na+H2O = NaOH + H2;
4. Бір атом темір мен үш атом хлордан, екі атом алюминий мен үшатом оттектен, бір ,атом фосфор мен бес атом хлордан тұратын күрделі заттардың молекулалық формуласын құрыңдар.
5. Массасы 6,2г фосфор жану үшін қанша моль оттек газы О2 қажет болатынын есептеңдер.
3-нұсқа:
1. Валенттіктері 1-ден 7-ге дейін өсу ретімен орналасқан мына: Na,Mg, AI, Si, P, S, CI ,,элементтердің оттекпен қосылысының формуласын құрыңдар.
2. Ас содасының құрамы 27,38% Na, 1,19%H, 14,29%C және 57,14% оттектен тұрады. Осы заттың молекулалық формуласын табыңдар.
3. Төмендерілген химиялық реакция теңдеулерін теңестіріп, типтерін анықтаңдар: а) Mg + O2 = MgO; б) Ai + HCI = AICI3 + H2;
4. Мына атомдар санын мольмен өрнектеңдер: а) 12,24•1023 атом кальций; ә)3,01•1023 ат,ом оттек; б) 6,02 •1023 атом көміртек;
5. Массасы 4,4г азот (І) оксиді бар. Осы заттың: а) мөлшерін; ә) молекула санын есептеңдер.
Үйге тапсырма беру: Қайталау.
Күні
Сабақтың тақырыбы: «Бастапқы химиялық ұғымдар» тақырыбын қорытындылау.
Сабақтың мақсаты: Білімділік: Осы тарау бойынша алған білімдерін тереңдету. Дамытушылық: Химиялық формула, теңдеу құру дағдыларын, есеп шығару химиялық тәжірибе жасау біліктерін дамыту. Осының бәрін атом - молекулалық ілім тұрғысынан дәлелдеу.
Тәрбиелік мақсаты: ғылымға, пәнге қызығуға тәрбиелеу.
Құрал- жабдықтар: Химиялық және физикалық құбылыстарға тәжірибелер, керекті химиялық ыдыстар және реактивтер.Сабақтың түрі: дәстүрлі емес. Сабақтың әдіс-тәсілдері:топпен жұмыс, деңгейлік тапсырмалар.
Сабақ барысы: Ұйымдастыру кезеңі. Оқушыларға ойын сабағының жоспары хабарланады. Тақтаға жазылады.
Сабақ девизі: «Пысықтау оқу - анасы». 1.Бақытты сәт - ойыны.
2. Деңгейлік есептер 3. Қызықты тәжірибелер.
4. Полиглот - ыдысы. 5.Тестілермен жұмыс.
Оқушыларды 2 ұғымдық топқа бөлетін. Топ басшысы осы ұжымның ұпайын есептеп отырады. Оған кесте алдын ала беріледі. 1-кезең. Сұрақтар (Дұрыс жауап берген оқушыға жетон беріледі)
1 ұжымдық топқа қойылатын сұрақтар.
1.Физикалық денелерді құрайтын нәрсе? (Зат) 2. Құрамына кіретін заттардың бөлшектері микрос коп арқылы да көрінбейтін қоспа қалай аталады? (Біртекті) 3. Шынының балқуы қай құбылысқа жата ды? (Физ.) 4. Бөлінбейтін ең кішкентай бөлшектер. (Атомдар) 5. Атомдарының әр түрінен түзілген заттар...(күрделі) 6.Оттектің салыстырмалы атомдық массасы.(16) 7.Мыстың латынша атауы. (купрум) 8. Плюмбум - (қорғасын) 9. О әрпімен белгіленетін элемент.(оттегі) 10.Таңбалар және формулалар арқылы шартты түрде жазылған реакциялар (Химиялық теңдеулер)
2-ұжымдық топқа қойылатын сұрақтар.
1. Заттардың агрегаттық күйлері.(Қатты,сұйық,газ)
2. Құрамына кіретін заттардң бөлшектерін жай көзбен көруге болатын қоспалар қалай аталады?(Әр текті)
3. Темірдің тот басуы қандай құбылысқа жатады?(хим.)
4. Атом-молекулалық ілімді жасаған орыс ғалым.(Ломоносов)
5. «Эн» таңбасы (Азот)
6. Кремнийдің латынша аты?(силициум)
7. Сутегінің таңбасы.(Н)
8. Химиялық теңдеуді теңестіру үшін қойылатын сандар?(Коэфф-р)
9. Феррум...(темір)
10. Азоттың салыстырмалы атомдық массасы.(14)
2-кезең. Деңгейлік есептер шығару. Тапсырма жауаптары тақтаға жазылады. 1-2 ұжымдық топтарға таратылып беріледі.
3-кезең. Демонстрациялық тәжірибелер: Оқушылар өздері орындайды.
а)Тұз бен құмның қоспасы берілген тұз бен құмды бөліп алу керек.Бұл қандай қоспа? Қоспалардың тағы қандай түрлерін білесің. (1 ұжым тобына)
ә)Темір мен күкірт қоспасы берілген. Бұл қандай қоспа? Күрделі зат пен қоспаның айырмашылығы неде?
4-кезең. Үй тапсырманы тексеру үшін «Полиглот» ойыны ойналады. Сұрақтарда кездесетін элементтер дің атын қазақ, орыс, латын тілінде айту керек. Дұрыс жауапқа 10 ұпай, жартылай 5 ұпай. Қай ұжым дық топ жылдам, білімділігін көрстеді.
1.Сұйық металл (Нg, сынап,ртуть-гидраргирум)
2. Ауаның негізгі құрам бөлігі? (О-оттек-кислород-оксигениум)
3.Қай элементтің жетіспеуі тіс ауруына ұшыратады? (Ғ-фтор-фтор-фторум)
4. Ой және өмір элементі. (Р-фосфор-фосфор-фосфорус)
5. Қай элемент бактериялырды өлтіріп, денсаулығымызды қорғайды?(ll, хлор-хлор-хлорум)
6. Ақыл арымас, алтын шірімес. (Аи-алтын-золото-аурум).
7. Темірді қызған кезінде соқ (Ғе-темір- феррум-железо).
5-кезең.Тестілермен жұмыс. Екі ұжымдық топқа тест кітапшасы бойынша деңгейлік тапсырма беріледі.Екі ұжымдық топ бір-бірін тексереді. 9 жұмыс. (тест) 1-2-3 деңгейде орындау Хим. фор-лар бой. есептеулер. Сабақ соңында топ басшыларыұпай санын санап, оқушыларды бағалайды.Қай топтың білімі басым болғанын анықтау. Сабақты қорытындылау.
Оқушылардың аты жөні
1 кезең
2 кезең
3 кезең
4 кезең
5 кезең
Қорытынды ұпай саны
1.
2.
Үйге тапсырма: Қайталау.
8-сынып Бақылау жұмысы
1-нұсқа:
-
Мына қосылыстардағы элементтердің валенттігін анықтаңдар: NH3, P2O5 , CrO3 , H2S , ,SO3;
2. Мына фосфор қышқылының (H3PO4) құрамындағы әр химиялық элементтің массалық үлесін
есептеп шығар.
3. Төмендегі берілген химиялық реакция теңдеулерін теңестіріп, типтерін анықтаңдар:
а) AgCI = Ag +CI2; ә) K + O2 = K2O; б) Fe + HCI = FeCI2 + H2;
4. Массасы 6 грамм магний жанғанда түзілген магний оксидінің (MgO) массасын және зат мөлшерін
есептеп шығар.
2-нұсқа:
1. Төмендегі қосылыстардың формуласын құрыңдар: а) кальций мен хлор(І); ә) азот (V) пен ,оттек;
б) алюминий мен ,оттек;, в) натрий мен ,күкірт (ІІ).
2. Мына әктастың (CaCO3 ) құрамындағы әр химиялық элементтің ,массалық үлесін есептеп шығар.
3. Төменде берілген химиялық реакция теңдеулерін теңестіріп, типтерін анықтаңдар:
а) Fe(OH)3=Fe2O3 + H2O; ә) Na + CI2 = NaCI; б) Na+H2O = NaOH + H2;
4. Массасы 6,2 грамм фосфор жанғанда түзілген фосфор (V) оксидінің (P2O5) массасын және зат
мөлшерін есептеп шығар.
3-нұсқа:
1. Валенттіктері 1-ден 7-ге дейін өсу ретімен орналасқан мына: Na,,Mg, AI, Si, P, S, CI ,,элементтердің ,,,,,,,,оттекпен ,қосылысының формуласын құрыңдар.
2. Ас содасының құрамы 27,38% Na, 1,19%H, 14,29%C және 57,14% оттектен тұрады. Осы заттың ,,,,,,,,молекулалық формуласын табыңдар.
3. Төмендерілген химиялық реакция теңдеулерін теңестіріп, типтерін анықтаңдар:
а) Mg + O2 = MgO; б) Ai + HCI = AICI3 + H2;
4. Мына атомдар санын мольмен өрнектеңдер: а) 12,24•1023 атом ,кальций; ә)3,01•1023 атом оттек;
,,,,,,,,б) 6,02 •1023 атом көміртек;
5. Массасы 4,4г азот (І) оксиді бар. Осы заттың: а) мөлшерін; ә) молекула санын есептеңдер.
8-сынып Бақылау жұмысы
1-нұсқа:
-
Мына қосылыстардағы элементтердің валенттігін анықтаңдар: NH3, P2O5 , CrO3 , H2S , ,SO3;
2. Мыс (І) және мыс(ІІ)оксидтерінің құрамындағы мыстың массалық үлестерін пайызбен есептеңдер.
3. Төмендерілген химиялық реакция теңдеулерін теңестіріп, типтерін анықтаңдар:
а) AgCI = Ag +CI2; ә) K + O2 = K2O; б) Fe + HCI = FeCI2 + H2;
4. 7H, 3CaO, 5H2 белгілері нені көрсетеді?
5. Массасы 6г магний жанғанда қанша грамм магний оксиді түзілетінін есептеңдер.
2-нұсқа:
1. Төмендегі қосылыстардың: а) кальций мен хлор; ә) азот(V) пен ,оттек; б) алюминий мен ,оттек;
,,,,,,, в) натрий мен ,,,,,,,күкірт (ІІ) формуласын құрыңдар.
2. Мына әктастың CaCO3 құрамындағы әр химиялық элементтің ,массалық үлесін табыңдар.
3. Төмендерілген химиялық реакция теңдеулерін теңестіріп, типтерін анықтаңдар:
а) Fe(OH)3=Fe2O3 + H2O; ә) Na + CI2 = NaCI; б) Na+H2O = NaOH + H2;
4. Бір атом темір мен үш атом хлордан, екі атом алюминий мен үш ,атом оттектен, бір ,атом ,,,,,,,,фосфор мен бес ,атом хлордан тұратын күрделі заттардың молекулалық формуласын құрыңдар.
5. Массасы 6,2г фосфор жану үшін қанша моль оттек газы О2 қажет болатынын есептеңдер.
3-нұсқа:
1. Валенттіктері 1-ден 7-ге дейін өсу ретімен орналасқан мына: Na,,Mg, AI, Si, P, S, CI ,,элементтердің ,,,,,,,,оттекпен ,қосылысының формуласын құрыңдар.
2. Ас содасының құрамы 27,38% Na, 1,19%H, 14,29%C және 57,14% оттектен тұрады. Осы заттың ,,,,,,,,молекулалық формуласын табыңдар.
3. Төмендерілген химиялық реакция теңдеулерін теңестіріп, типтерін анықтаңдар:
а) Mg + O2 = MgO; б) Ai + HCI = AICI3 + H2;
4. Мына атомдар санын мольмен өрнектеңдер: а) 12,24•1023 атом ,кальций; ә)3,01•1023 атом оттек;
,,,,,,,,б) 6,02 •1023 атом көміртек;
5. Массасы 4,4г азот (І) оксиді бар. Осы заттың: а) мөлшерін; ә) молекула санын есептеңдер.
Сабақты бекіту мақсатында шығарылатын есептер:
-
8г мыс(ІІ) оксидін алу үшін қанша грамм мыс реакцияға түседі?
-
Нәтижесінде 4 моль сутек алу үшін қанша грам суды айыруға болады?
-
Массасы 6,5г цинк оттекпен әрекеттессе цинк оксидінің қанша зат мөлшерін алуға болады?
-
1 моль алюминий күкіртпен реакцияға түсу үшін қанша күкірт қажет және түзілген алюминий сульфидінің массасын есептеңдер?
-
Оттегінде 54г алюминий жанған кезде, алынған алюминий оксидінің массасы қандай?
-
Массасы 360г алюминий сульфидін алу үшін, оған жұмсалған алюминий мен күкірттің массасын есептеп шығар.
-
8г мыс(ІІ) оксидінен мысты жеке бөліп алу үшін, қанша грамм сутегі жұмсалады?
-
8г сутегі жанғанда түзілетін судың массасы және зат мөлшері қанша?
-
Реакцияға 16г оттегі түскенде судың қандай зат мөлшері шығады?
-
Реакциядан 9г су түзіледі. Реакцияға түскен оттегінің массасын және зат мөлшерін табыңдар.
Сабақты бекіту мақсатында шығарылатын есептер:
1) 8г мыс(ІІ) оксидін алу үшін қанша грамм мыс реакцияға түседі?
2) Нәтижесінде 4 моль сутек алу үшін қанша грам суды айыруға болады?
3) Массасы 6,5г цинк оттекпен әрекеттессе цинк оксидінің қанша зат мөлшерін алуға болады?
4) 1 моль алюминий күкіртпен реакцияға түсу үшін қанша күкірт қажет және түзілген алюминий сульфидінің массасын есептеңдер?
5) Оттегінде 54г алюминий жанған кезде, алынған алюминий оксидінің массасы қандай?
6) Массасы 360г алюминий сульфидін алу үшін, оған жұмсалған алюминий мен күкірттің массасын есептеп шығар.
7) 8г мыс(ІІ) оксидінен мысты жеке бөліп алу үшін, қанша грамм сутегі жұмсалады?
8) 8г сутегі жанғанда түзілетін судың массасы және зат мөлшері қанша?
9) Реакцияға 16г оттегі түскенде судың қандай зат мөлшері шығады?
10) Реакциядан 9г су түзіледі. Реакцияға түскен оттегінің массасын және зат мөлшерін табыңдар.
Сабақты бекіту мақсатында шығарылатын есептер:
1) 8г мыс(ІІ) оксидін алу үшін қанша грамм мыс реакцияға түседі?
2) Нәтижесінде 4 моль сутек алу үшін қанша грам суды айыруға болады?
3) Массасы 6,5г цинк оттекпен әрекеттессе цинк оксидінің қанша зат мөлшерін алуға болады?
4) 1 моль алюминий күкіртпен реакцияға түсу үшін қанша күкірт қажет және түзілген алюминий сульфидінің массасын есептеңдер?
5) Оттегінде 54г алюминий жанған кезде, алынған алюминий оксидінің массасы қандай?
6) Массасы 360г алюминий сульфидін алу үшін, оған жұмсалған алюминий мен күкірттің массасын есептеп шығар.
7) 8г мыс(ІІ) оксидінен мысты жеке бөліп алу үшін, қанша грамм сутегі жұмсалады?
8) 8г сутегі жанғанда түзілетін судың массасы және зат мөлшері қанша?
9) Реакцияға 16г оттегі түскенде судың қандай зат мөлшері шығады?
10) Реакциядан 9г су түзіледі. Реакцияға түскен оттегінің массасын және зат мөлшерін табыңдар.
Күні
II тарау. ОТТЕК. ОКСИДТЕР. ЖАНУ.
№1 сабақтың тақырыбы:. Оттек. Оттектің табиғатта кездесуі.
Сабақтың мақсаты: Білімділік: Химиялық элементпен және жай затпен таныстыруды жоспарлау.Дамытушылық: Өз еріктерімен ізденіп ойларын дамыту. Тәрбиелік: жеке жұмыс жасауға тәрбиелеу.
Құрал-жабдықтар. "Элементтердің табиғатта таралуы".
Тірек білім мен біліктер: Элемент, жай зат, химиялық элемент пен жай зат ұғымдары ның айырмашылығы. Физикалық және химиялық құбылыс.
Сабақтың түрі: аралас сабақ, іздену, өз еріктерімен жұмыс.
Сабақтың әдіс-тәсілдері: жаңа сабақты игеру, оқулықпен жұмыс
Сабақтың барысы: Өмірде маңызы бар кейбір заттармен таныстыру оттегімен басталады. Оттегіні оқып үйрену үшін оны әрі элемент, әрі жай зат ретінде қарастыру қажет. Химиялық элемент пен жай ұғымдарының арасында айырмашылық бар екені айтылады. Төмендегі берілген жоспарда бұл айырмашылық айқын көрінеді.
Химиялық элементке сипаттама беру жоспары:
1. Химиялық таңбасы.
2. Салыстырмалы атомдық массасы.
3. Табиғатта кездесуі.
Жай заттарға сипаттама беру жоспары:
1. Химиялық формуласы.
2.Салыстырмалы молекулалық массасы.
3.Физикалық қасиеті.
4.Химиялық қасиеті.
5.Қолданылуы.
6.Зертханада және өндірісте алу жолдары.
Осы келтірілген жоспарға сүйене отырып, оқушы өздігінен оттегіне сипаттама береді. Кейін де элементтерге, жай заттарға сипаттама бергенде осы жоспарды қолдануға болады.
Сабақты пысықтау мақсатында оқулықтан тапсырмалар беріледі.
Үйге тапсырма беру: § 20. 1-7 жаттығулар.
Күні
Ссабақтың тақырыбы: Оттегінің физикалық қасиеттері, зертханада және өндірісте алу.
Сабақтың мақсаты: Білімділік:Оқушыларды оттегінің қасиеттерімен таныстыру. Дамытушылық: зертханада алу әдістерін көрсету.Тәрбиелік: Жек жұмыс жасауға, қорытындылауға тәрбиелеу.
Құрал-жабдықтар: Цилиндрлер, шыны пластинка, заттарды жандыратын қасықша, сіріңке, шыра, кестелер: "Газды жинау", Калий хлораты (Бертолле тұзы) , сутегі асқын оксиді, калий перман- ганаты, күкірт қышқылы, оттегін алуға және жинауға арналған құралдар, шырпы, газометр, сіріңке, газ жанарғысы.Электрондық оқулық
Сабақтың түрі. Аралас сабақ.
Сабақтың әдіс-тәсілдері: жаңа сабақты игеру, сұрақ - жауап.
Тірек білім мен біліктер: Газдарды жинау әдістері, катализатор.
Сабақ барысында оттегінің қолданылуын, табиғатта таралуын қайталау мақсатында бірнеше сұрақтарға жауап алынады.
1.Қандай қасиеттеріне байланысты газ және сұйық күйінде қолданылады?
2Қандай қасиетіне сүйеніп оттегін суды және ауаны ығыстыру арқылы алады?
Жаңа сабақты көрнекі тәжірибелер көрсетуден бастау. Оттегін оңай ыдырайтын заттардан алуға болатыны айтылады. Оттегін алу тәжірибе арқылы көрсетіледі. Тәжірибе мына тәртіппен жүргізіледі:
2KMnO4 → K2MnO4 + MnO2 + O2↑
Оқушыларды тәжірибе жүргізген кезде дұрыс бақылауға, нәтижесін қорытындылауға үйрету керек. Осындай бақылау жүргізуді үйрету үшін газометрге оттегі толтырылады да, оқушыларға "Оттегінің қандай қасиетін бақыладыңдар?"-деген сұрақ қойылады. Одан әрі оттегін ыдыстағы ауаны ығыстыру арқылы жинауды және сынауықтағы суды ығыстыру арқылы жинауды көрсету.
Жиналған оттегінде шала жанған шырпыны апарғанда, оның жарық жалын шығарып жанатынын оқушыларға қөрсету арқылы «оттегі жануды қолдайтын газ» екенін түсіндіремін. Ауадағы оттегіне қарағанда, таза оттегінде заттар өте жақсы және тез жанатыны айтылады.
Оқушылар заттардың физикалық қасиетіне сипаттама беруді біледі.
а)сынауықтағы сутегі асқын оксидін катализатор(өршіткі) салып қыздыру;
ә) марганец (IY) оксидін сынауықта қыздыру;
б)қоспа дайындау H2O2+MnO2, оттегін алу, тәжірибе нәтижесі қорытын- дыланып, катализаторға анықтама беріледі. Катализаторды бөліп алып, массасы өзгермегенін көрсету керек. Бертолле тұзынан да оттегін алғанда өршіткі қолданылады.
Қорытынды ретінде мынадай сұрақтар беріледі:
1. Оттегін басқа қандай заттардан алуға болады?
2. Неліктен оттегі газы суды ығыстыру арқылы жиналады?
3. Неліктен оттегі газы ауаны ығыстыру арқылы жиналады?
Үйге тапсырма беру: § 21. 1-8 жаттығулар.
Күні
Сабақтың тақырыбы. Оттектің химиялық қасиеттері. Жану.
Сабақтың мақсаты. Оттектің химиялық қасиеттерімен таныстыру. Жану, баяу тотығу реакцияларымен таныстыру.
Құрал-жабдықтар. Күкірт, фосфор, көмір, құм, фосфор (V) оксиді, әк суы, болаттан жасалған қалам, оттегі толтырылған газометр.
Тірек білім мен біліктер. Жану оксидтер, жай зат, күрделі зат, химиялық реакция теңдеуін құру білігі, реакцияларды салыстыру, валенттік бойынша оксидтердің формуласын құру.
Сабақ барысы: Өткен сабақты қайталау мақсатында оқушыларға тапсырма беруге болады.. 1. Валенттілік бойынша оксидтердің формуласын құрып, аттарын атау.
Мысалы: мырыш (II), күкірт (IY,YI), мыс Cu(I,II),хром Cr (III,YI), фосфор Р (III,Y), магний Mg (II), т.б.
Жаңа сабақты түсіндіру. Бұл сабақта алғаш рет оттегінің химиялық қасиетімен танысады, яғни заттың химиялық қасиетін айтқанда, бір заттың екінші затқа айналғандығы жағдайларына - температураның, қысымның өзгеруіне көңіл бөлуі керек.
Оттегінің химиялық қасиеттерімен демонстрациялық тәжірибелер жүргізу арқылы таныстырады. Оларды орындаған кезде мұғалім реакцияны жүру жағдайына, реакцияның ерекшелігіне тоқталады. Әсіресе барлық реакцияға тән, ортақ жолдарын ескертеді: реакция жылу немесе жарық бөле жүре ме, әлде тотығу арқылы оксид түзе ме?, т.б. Оттегінің химиялық қасиетін қарастырғанда салыстыра білу тәсілінің маңызына тоқталып кеткен жөн. Фосфор, көмір, күкірт, темір және күрделі заттардың таза оттегінде жану жағдайларына көңіл бөлінеді де, салыстыра отырып қорытынды жасалады.
Мысалы: фосфордың оттегінде жануын талқылаған кезде, алған затты (фосфорды) аздап қана қыздыру керектігі айтылады, яғни бұл бірінші шартты белгі - зат жану үшін оны қыздыру керек. Екінші шартты белгі - қыздырылған фосфор оттегімен жанасуы керек.
Басқа тәжірибелерде де мұғалім жану процесінде осы екі шартты белгі орындалу керектігін түсіндіріп отырады. Тәжірибе нәтижесінде оқушылар жай заттардың жану реакция сы қосылу реакциясына жатады деген қорытындыға келуі қажет.
Сабақты пысықтау мақсатында тапсырмалар беру:
, 1. 1. Төмендегі заттармен оттегінің арасындағы реакция теңдеулерін жазыңдар: а) темір (III); ә) күкірт (IY); б) көмір (IY); в) (Y). Реакция нәтижесінде түзілген күрделі заттың атын ата; химиялық реакция типін көрсет, реакция жүру жағдайын атаңдар.
Осындай тапсырманы карточкамен оқушыларға жеке-жеке берүге болады.
Мысалы: 1) мыс (Cu) оттегінде жанғанда мыс (II) оксиді (CuO);
2) кремний (Si) оттегімен әрекеттескенде кремний (IY) оксиді (SiO2 );
3) металл (Ca) оттегінде жанғанда кальций оксиді (CaO);
4) магний ауада жанғанда - магний оксиді;
5) натрий ауада жанғанда ақ ұнтақ-натрий оксиді Na2O түзіледі;
6) сутегі(H)мен оттегінің қоспасын жандырғанда қопарылыс береді де,су пайда болады.
Бұл тапсырмаларға жауап беру барысында оқушылар оттегінің химиялық қасиетін еске түсіреді, реакция жүру жағдайларын, шартты белгілерін айтады. Қосылу реакциясының мәнін түсінуге реакция теңдеуін жазуға, валенттілігін, коэффициенттерін дұрыс қоюға дағдыланды. Бұл тапсырмалар өткен сабақпен қалыптастырылғалы отырған жаңа ұғымдарды байланыс тырады.
Үйге тапсырма беру. §22. 5-9 жаттығулар.
Күні
№4 Сарамандық жұмыс
Сабақтың тақырыбы: «Оттегін алу және оның қасиеттері»
Жұмыстың мақсаты: оқушылардың оттегін алу және оның химиялық, физикалық қасиеттері туралы білімдерін бекітіп, ауаны, суды ығыстыру арқылы газ жинау іскерлігін қалыптастыру.
Жұмысқа қажетті құралдар мен реактивтер: пробирка бекітетін қалақшасы бар темір штатив, спиртшам, газ жүретін түтігі бар тығын, 5 пробирка, оның үшеуі тығынмен тығыз жабылған шыра, кішкене мақта, ортасына дейін суы бар кішігірім конус, ұшына көмір бекітілетін жіңішке сым, 0,5 г калий перманганаты, әк суы.
Жұмыс барысы: Алдымен оқушылар оқулықта көрсетілгендей оттегін алатын құрал жинап, оның ауа жібермейтіндігін тексеру керек. Сынауыққа калий перманганатын салып, қыздырған кезде газ жүретін түтікке кетпес үшін, алдына бос қылып мақта қою керек. Газ жүретін түтіктің үшін оттегі жинайтын /стақан, сынауық/ ыдыстың түбіне дейін жеткіземіз. Оттегі аудан сәл ауыр болғандықтан, біртіндеп ауаны ыдыстан ығыстырады. Оттегі ыдысқа толғанын білу үшін тұтанған шыраны ыдыс аузына жақындатқанда шыра лып етіп жанады. Оттегінің суда ерігіштігі нашар болғандықтан оны суды ығыстыру арқылы да жинауға болады. Ол үшін 25-суреттегідей құрал жинап қолданамыз. Сеңгелге суға толған екі сынауыққа салып қоямыз.Калий пермаганты салынған сынауықты сәл қыздырып, газ жүретін түтіктегі ауа шыққаннан кейін оны су астындағы сынауыққа кіргізіп, сынауықтың түбін жоғары қаратып ұстаймыз. Оттегі суды ығыстырып, сынауыққа жиналады. Су астында сынауықтың аузын тығынмен жауып, сеңгелден аламыз. Қыздыруды тоқтатпай түтікті судан алу керек, себебі, су калий перманганаты салынған сынауыққа дейін кетіп, қызған сынауық сынуы мүмкін. Сымға бекітілген көмірді спиртшамды қыздырып оттегі бар сынауыққа кіргізгенде, ол жарқырап жанады. Байқалған құбылыстарды оқушылардың табиғаттану пәнінен алған білмдермен ұштастыруға болады. Төмендегідей сұрақ беріп, алған білімдерін бекіткен дұрыс:
а) оттегінің қандай физикалық қасиеттерін байқадыңдар?
ә) қандай химиялық қасиеттерімен таныстыңдар? б)оттегін ауаны және суды ығыстыру арқылы жинау себебін түсіндір.
Ескерту: оттегін сутегі асқын оксидімен де алуға болады.
Сарамандық жұмыс төмендегі жоспармен өту керек.
І. Жұмысты жүргізуге берілетін оқытушының нұсқауы.
ІІ. Оқушылардың сарамандық жұмысты жүргізуі:
а) оттегі алуға арналған құралды жинау
ә) құқралдың ауа өткізбейтіндігін тексеру
б) оттегінің жиналғанын дәлелдеу (жаңа жанған шырамен)
в) көмірдің оттегімен әрекеттесуі
Ш. Жұмысты жазбаша қорытындылау.
Үйге тапсырма беру: Қайталау.
Күні
Сабақтың тақырыбы. Оксидтер. Олардың аталуы. Тотығу.
Сабақтың мақсаты.
Білімділік: Оксидтермен, жану ұғымымен таныстыру.
Дамытушылық: Оксидтердің формуласын құрастырып, аттарын дұрыс атауға дағдыландыру.
Тәрбиелік: ғылымға, пәнге қызығуға тәрбиелеу.
Құрал-жабдықтар. Оқушылар үстелінде: оксидтердің үлгілері - мыс(II) оксиді, магний оксиді.
Тірек білім мен біліктер. Жану оксидтер, жай зат, күрделі зат, химиялық реакция теңдеуін құру білігі, реакцияларды салыстыру, валенттік бойынша оксидтердің формуласын құру.
Сабақ барысы: Өткен сабақты қайталау мақсатында оқушыларға тапсырма беруге болады:. 1. Неліктен оттегі газы суды ығыстыру арқылы жиналады?
-
Неліктен оттегі газы ауаны ығыстыру арқылы жиналады?
-
Зертханада оттегін қандай приборда сақтайды?
-
Оттегін зертханада қандай заттардан алады?
-
Өнеркәсіпте оттегін қалай алады?
-
Калий перманганатынан алу реакция теңдеуін жаз.
-
Калий хлоратынан алу реакция теңдеуін жаз.
-
Өршіткі дегеніміз не? ,
Сұрақтар талданғаннан кейін "Оксидтер үлгілері мен танысу" деген зертханалық жұмыс жүргізіледі, кесте толтырылады. Содан соң, оксидтер құрамына көңіл бөлу керек.
Оксидтердің екі түрлі ерекшелігі бар: сандық және сапалық құрамы.
Біріншіден, оксидтер тек екі элементтен тұрады, бұл сандық құрамы.
Екіншіден, құрамында оттегінің болуы бұл сапалық құрамы, яғни барлық оксидтердің құрамында екі элементтің біреуі оттегі болатынын оқушы нақты білу қажет. Сөйтіп, оксидтерге анықтама беріледі. Оксидтердің күрделі заттарға жататынын осы жерде тоқталып кеткен жөн.Мұғалім мына ұғымдардың оксид, оксидтер класы, күрделі зат байланы сына көңіл бөледі. Әр түрлі оксидтер жиыны оксидтер класын құрайды. Ал оксидтер класы басқа кластармен қосылып, күрделі заттар жиынтығы екені айтылады.
Оксидтер класын, оның құрам ерекшелігін жақсы түсінуі үшін оқушылардың өздігінен жұмыс істеуін ұйымдастыруға болады.
Мысалы: төменде берілген формулалардан оксидтерді теріп жазыңдар: HCl, NaOH, CaO, ZnO, SО2 , HСІ, NaOH, H2S , K2 O, Fe2 O3 , ZnS.
Тотығу реакциясына жай заттардың оттегімен қосылуы жататынын айта келіп, күрделі заттар да тотығатынын, бірақ олар реакцияның басқа типіне жататынына көңіл бөлген жөн. Күрделі заттар жанғанда реакция жүру ерекшелігіне, заттар түсінің, иісінің өзгеруіне қарап, алынған заттардың құрамын тұжырымдайды.
Мысалы: а) бұзылған жұмыртқаның иісі баргаз (H2S) жанғанда реакцмя нәтижесінде күкірт (IY) оксиді мен судың түзілуі. Осы реакцияның ерекшелігі қандай? ә) сынап сульфидінің қара ұнтағы тотыққанда екі зат алынды. Олар қызғылт түсті зат пен өткір иісті газ. Бұл қай заттар? Реакция теңдеуін жаз.
Тапсырманы орындау барысында оқушы әр уақытта реакцияларды салыстыра білуге, түсіндіруге, тұжырымдауға, қорытынды жүргізуге үйрену керек.
Сабақты бекіту мақсатында мынадай тапсырмалар береміз:
1. Силанның SiH және сынап сульфидінің HgS тотығу реакциясының теңдеуін жазу.
2. Валенттілік бойынша оксидтердің формуласын құрып, аттарын атау.
Мысалы: мырыш (II), күкірт (IY,YI), мыс Cu(I,II),хром Cr (III,YI), фосфор Р (III,Y), магний Mg (II), т.б.
Үйге тапсырма. §23. 1,4,5-жаттығулар.
Күні
Сабақтың тақырыбы: Оттегінің табиғаттағы айналымы. Оттегінің қолданылуы.
Сабақтың мақсаты: Оттегінің табиғаттағы айналымы мен қолданылуы, тірі табиғаттағы және өндірістегі маңызын түсіндіру.
Құрал-жабдықтар: "Оттегі" кинофильмі, "Элементтердің табиғатта таралуы", "Оттегінің қолданылуы" деген кестелер. Электрондық оқулық.
Сабақтың түрі: аралас сабақ.
Сабақтың әдіс-тәсілдері: есептер шығару, сұраққа жауап.
Пәнаралық байланыс: биология, география
Тірек білім мен біліктер: Оттегінің қасиеттері, реакция теңдеуін жаза білу, массалық үлесін табу.
Сабақ барысы: Ұйымдастыру кезеңі.
Оксидтердің құрамын қайталау мақсатында төмендегі тапсырмаларды орындатамыз. Мұнда оқушыларда валенттілік, күрделі зат, оксидтердің класқа бөліну ұғымдарын дамыту кезделген.
1.Берілген формулалардың оксидтердітеріп жазып, аттарын атаңдар.
H2SO4 , Al2O3 , NaOH, K2SO4 , SiO2 , CH4 , MgO
NaCl, SO2 , KNO3 ,Fe2O3 , SiO2 ,SiH4 , KOH.
H2SO3 , KCl, H2O, CH4 , P2O5 , NaOH, ZnO.
CO2 , Na2SO4 , KNO3,CaO, HCl, Cu, KOH.
2. Мына сызбанұсқа бойынша реакция теңдеулерін жазыңдар:
1-нұсқа 2-нұсқа
Mg→MgO Zn→ZnO
N2 →N2О5 Al→Al2O3
Na→Na2O H2→H2O
Күрделі заттың құрамындағы жай заттың массалық үлесін табуға бірнеше есеп беруге болады. Бұл тапсырма оқушының алған білімін қалыптастыруға, бекітуге көмегін тигізеді.
1. Кварцтағы SiO2 кремнийдің массалық үлесін тап.
2. Мырыш оксидіндегі ZnO оттегінің массалық үлесін тап.
Бұл сабақта мұғалім оқушылардың алған білімін жинақтап, оттегінің табиғатта таралуы мен маңызына тоқталады. Оттегінің химиялық элементтердің ішіндегі өмір, тіршілік үшін маңызы зор екенін айту керек. Жай зат ретінде оттегі демалу және процестеріне, ал күрделі зат ретінде судың құрамында кездесуі - тіршілік кезі.
Осы орайда халық шаруашылығындағы қолданылуына да тоқталады.
Оқушыға оттегінің мысалында қоршаған ортаның бір-бірімен байланыстылығы айтылады. Бұл сабақта кинофильм көруге болады. Фильмнен алған әсерін білу мақсатында және қорытынды жүргізу үшін төмендегідей сұрақтар қоюға болады.
1.Оттегі табиғатта қандай түрде кездеседі?
2.Оттегінің қандай химиялық қасиеттерімен таныстыңдар?
Сызбанұсқа бойынша оттегінің қолданылуын, табиғатта таралуын талқылау ,,,,,,,,,,,,керек. Оттегінің техникада өте көп қолданылатыны тоқталады.
Үйге тапсырма беру: 24, 2, 4-жаттығулар.
Күні
Сабақтың тақырыбы. Озон. Оттектің аллотропиялық түр өзгерісі. Озонның табиғатта таралуы.
Сабақтың мақсаты. Білімділік: Оттектің аллотропиялық түр өзгерісі - озонның физикалық қасиеттерін сипаттау, тұрақсыз қосылыс, тез ыдырап, оттекке айналуын және күшті тотықтырғыш екенін түсіндіру. Дамытушылық: табиғатта таралуын, пайдалы жақтарын айту, логикалық ойларын дамыту. Тәрбиелік: ғылымға, пәнге қызығуға тәрбиелеу.
Құрал-жабдықтар: "Элементтердің табиғатта таралуы" кесте, оттек пен озон молекулаларының модельдері, озонатор приборын көрсету.
Сабақтың түрі: аралас сабақ.
Сабақтың әдіс-тәсілдері: түсіндіру.
Сабақ барысы: Ұйымдастыру кезеңі.
Оттектің табиғаттағы айналымы мен қолданылуы тақырыбын қайталау мақсатында сұрақтар беру:
-
Табиғаттағы оттектің айналуын айтып беріңдер.
-
Оттектің тірі организмдер үшін маңызы қандай?
-
Табиғатта оттек қалай түзіледі?
-
«Орман - планета өкпесі» деген сөз неге байланысты айтылған?
-
Оттектің пайдасы және бүлдіргіштік қасиеттерін айтып беріңдер.
-
Оттек қандай мақсаттарда қолданылады.
Жаңа сабақты түсіндіруді мынадай сұрақтан бастаған жөн.
1. Оттектің аллотропиялық түр өзгерісі - озон екенін және физикалық қасиет- терін сипаттаудан бастау.
Формуласы - О3 грекше «озо» - иісті газ деген ұғымды білдіреді.
↑,Т(көкшілдеу),И(өзіне тән ерекше),Н2О-да аз ериді, Т=-1120С, Т=-1930С, О2-ден 1,5 есе ауыр. Күшті тотықтырғыш, бояғыш заттарды түссіздендіреді, Оны қолдану арқылы ауыз су мен ағын судағы, бөлме ауасындағы бактерияны жояды.
Озон электр зарядтарының әсерінен табиғатта найзағай ойнағанда және ормандарда қылқанды ағаштардың шайыры тотыққан кезде найда болады.
Найзағай жаңбырдан соң шығатын ерекше иіс - озонға тән.
Тұрақсыз қосылыс: О3 → О2 + О О + О → О2
Аллотропиялық түр өзгерісі дегеніміз не? Анықтама беру.
О3 + 2КІ + Н2О = О2 ↑+ І2↓ + 2КОН Озоны бар ауаны калий иодиді ерітіндісіне жіберсе иод бос күйінде бөлінеді. Жаңбырдан соң ауада озон мөлшері 0,00001% болғанның өзінде ауаны тазартып, таза оттекпен демалуға мүмкіндік туады.
Озон шамамен 25км биіктікте жер бетіндегі ауа атмосферасын түгелдей қоршаған 2-3 мм қабатша түрінде болады. Атмосферадағы озон қабатының қызметі ерекше, ол Күннен келетін ультракүлгін сәулені жұтып, оның күйдіргіш әсерін азайтады.
Оқушы білімін бекіту мақсатымен төмендегідей сұрақтар қойылады:
-
Аллотропия, аллотропиялық түр өзгерісі дегеніміз не?
-
Не себепті оттекті тотығу процесінде, ал озонды бактерияны жою үшін пайдаланады?
-
Озонның түзілуі және оның табиғаттағы маңызы қандай?
-
Озонды лабораторияда қалай алуға болады?
Үйге тапсырма беру: §25. 6,7 жаттығу.
Күні
Сабақтың тақырыбы: Ауа және оның құрамы.
Сабақтың мақсаты:
Білімділік: Оқушыларға ауаның құрамы газдардың қоспасы екенін, оның сандық және сапалық құрамын айтып түсіндіру.
Дамытушылық: атмосферадағы ауаны қорғау маңызды шараларын аша отырып логикалық ойларын дамыту.
Тәрбиелік: ғылымға, пәнге қызығуға тәрбиелеу.
Құрал-жабдықтар: Фосфор,әк суы, май шам, ауа құрамын анықтайтын прибор,химиялық стақан, сіріңке, т.б.
Сабақтың түрі: аралас сабақ, топпен жұмыс.
Сабақтың әдіс-тәсілдері: сұрақ-жауап, түсіндіру.
Сабақ барысы: Сабақ алдында әңгіме өткізу:
-
Химиялық элемент оттегі табиғатта қандай түрде кездеседі?
-
Оттегі қандай химиялық қасиет көрсетеді?
-
Тотығу реакциясына қандай реакция типі жатады?
-
Ішінде ауа бар ыдысқа жанып тұрған парафинді енгізіп ыдысты жабатын болсақ не байқалады?
-
Ауа, оттегі,көмір қышқыл газы қай колбада бар екенін қалай анықтауға болады?
-
Тотығу реакциясы дегеніміз не?
-
күрделі заттар жанғанда не байқалады?
Жаңа сабақты түсіндіру:Ауа құрамын анықтайтын ерте кезден белгілі тәжірибені қайталайық. Іші ауамен толтырылған қалпақ 21-суреттегідей суға төңкеріледі. Фосфорды темір қасыққа салып жағып, қалпақтың ішіне орнатады. Фосфор жанып біткенше қалпақ ішіндегі су жайлап оның 1/5 бөлігіне дейін көтеріледі, өйткені фосформен әрекеттесетін барлық ауа емес, оның құрам бөлігі - оттек газы. Демек, ол көлемі бойынша ауаның 1/5 бөлігн алып тұр. Қалпақ астында қалған газ жануды қолдамайды, өзі жанбайды. Онда тірі организмдер тіршілік ете алмайды. Сондықтан қалған газ «азот» ( грекше тіршілік қолдамайды дегенді білдіреді) деп аталады.
Демонстрациялық тәжірибе жүргізу: Антуана Лавуазье тәжірибесі.
-
Зат таза оттегінде жақсы жанып, ауада неліктен нашар жанады?
-
Оттегі үлесіне ауаның қанша бөлігі сәйкес келетінін қалай білуге болады?
Тәжірибе қорытындысы: ауада оттегі 1/5 бөлігі болады, көлемі 21%,қалған бөлігі қоспа.
1874 жылы Генрих Кавендиш ауа құрамынан азот және оттегін бөліп алды.
1884 жылы В.Рамзай және Д.Рэлея асыл газдарды алды.
Жаңа сабақты қорытындылау білімдерін тексеру мақсатында сұрақтар беру:
-
Ауаның қоспа екенін қалай дәлелдеуге болады?
-
1литр және 0,5литр көлемді колбада қанша мл оттегі болады?
-
Неліктен жанған шырпы төмен қаратылса тез жанып,ал жоғары қаратылса сөніп қалады?
-
Баяу тотығу дегеніміз не?
Үйге тапсырма беру: §26. 1-6 жаттығу.
Күні
Сабақтың тақырыбы. Химиялық реакцияның жылу эффектісі.
Сабақтың мақсаты. Білімділік:Эндотермиялық, экзотермиялық реакциялар, жылу эффектісі ұғымдарын түсіндіру.Дамытушылық: Термохимиялық теңдеулерді құрастыру білігін қалыптастыру
Тәрбиелік: ғылымға, пәнге қызығуға тәрбиелеу.
Тірек білім мен біліктер. Химиялық реакция, зат массасының сақталу заңы, химиялық теңдеулер, энергияның сақталуы және жылу процестері жөніндегі ұғымдар, теңдеуді құрастыру, теңестіру.
Сабақ барысы: Жаңа сабақты түсіндіруді мынадай сұрақтан бастаған жөн.
1. Химиялық реакция деген не?
2. Химиялық реакцияның белгілерін атаңдар.
Бұл сұрақтарға жауап беру барысында оқушылар химиялық реакцияның жүргенін тек бастапқы заттардың түсінің, исінің өзгеруі, тұнбаның түсуі, газдың бөлінуі сияқты белгілермен қоса жылудың бөлінгені не сіңірілгені арқылы да білуге болатындығын еске түсіреді.
1. Жану дегеніміз не? Баяу тотығу деген не?
Бұл сұрақтардың жауабын талдау нәтижесінде оқушылар жану мен баяу тотығу процестері кезінде жылу бөлінеді деген қорытындыға келеді. Бұл қорытындыдан кейін экзотермиялық реакция ұғымы жөнінде түсінік береді, яғни жылу түрінде энергия бөле жүретін химиялық реакцияларды-экзотермиялық реакция дейміз. Егер химиялық реакция энергия бөле жүретін болса сол бөлінген энергияны тиімді пайдалануға болады. Айталық отынның жану кезінде бөлінген энергияны үйді жылытуға пайдаланады, ғарыштық ракетаның жану камерасындағы отыннан бөлінген жылу сол ракетаның жұмысына жұмсалады, т.б.
Мүмкіндік болса судың электр тоғымен айырылуын көрсетіп, реакцияның жылуды сіңіре жүретініне де оқушы назарын аударады. Сол сияқты әктастың айырылуы да жылуды сіңіре жүретін реакцияға жататыны айтады. Мұғалім өз ұйғаруы боцынша, зертхана жағдайына, уақыттың жетуіне байланысты бұл екі тәжірибенің екеуін көрсетіп түсіндіруіне болады. Қорыта айтқанда, бұл тәжірибелер көмегімен эндотермиялық реакциялар ұғымын қалыптастырады, яғни энергия сіңіре жүретін реакцияны эндотермиялық реакция дейміз. Бұндай реакциялардың жүруіне қажетті ең басты жағдай-энергия. Сондықтан энергия көзінің болуын қамтамасыз ету керек.
Экзотермиялық, эндотермиялық реакциялар түрін өзара салыстыра отырып, жылу эффектісі жөнінде түсінік беріледі. Демек, химиялық реакция көзіндегі бөлінетін не сіңірілетін жылу мөлшерін-жылу эффектісі дейміз. Олай болса химиялық теңдеулер арқылы бөлінген не сіңірілген жылу мөлшерін есептеуге болады. Осы тұста мұғалім оқушылардың физика курсынан алған білімін еске түсіріп, жылу мөлшерінің өлшем бірлігін, калориметрдің не екенін анықтайды. Сондықтан төөмендегідей сұрақтар қоюға болады.
1. Жылу мөлшерінің өлшем бірлігі не?
2. Жылу мөлшерін іс жүзінде қалай өлшейді?
Осындай тірек білімге сүйене отырып, төмендегі мысал арқылы термохимиялық теңдеулер жөнінде ұғым қалыптастырылады. 1 г көмірді жаққанда 34,17 кДж жылу бөлінеді. Ал 1 моль немесе 12 г көміртегін жаққанда 410 кДж бөлінеді.
Енді осы шама химиялық реакцияның оң жағына қосу (+) белгісі арқылы жазылады.
Мысалы: С + О2 = СО2 + 410кДж
Сонымен егер теңдеудің оң жағында қосу белгісі арқылы жылу мөлшері көрсетілген болса, ол экзотермиялық реакция екендігін көрсетеді. Ал егер реакция жылуды сіңіре жүрсе, онда химиялық теңдеудің оң жағына сіңірілген жылу мөлшері алу (-) белгісі арқылы көрсетіледі. ,,,,,,,,,,,, Мысалы: 2HgO = 2Hg + O2 - 180 кДж
Бұндай жылу эффектісі көрсетілген химиялық теңдеулер термохимиялық теңдеулер делінеді.
Мұғалім бұдан әрі химиялық энергия жөнінде, оның энергияның басқа түріне айналуын айта келіп, мысалдар келтіріледі. Бұл ұғымдарды физика курсындағы энергияның сақталуы және айналуы заңына сүйене отырып, түсіндіреді.
Оқушы білімін бекіту мақсатымен төмендегідей сұрақтар қойылады:
1. Қандай реакция экзотермиялық деп аталады?
2. Қандай реакция эндотермиялық деп аталады?
3. Жылу эффектісі деген не?
4. Термохимиялық теңдеудің ерекшелігі неде?
Үйге тапсырма беру: §27. 1-12 жаттығулар.§29 оқып үйрену.
Күні
Сабақтың тақырыбы: Оттек. Оксидтер. Жану тақырыбы бойынша бақылау жұмысы №2.
Сабақтың мақсаты: Оқушылардың осы тақырып бойынша алған білімде- рін жүйелеу, алған білімдерін тексеру барысында екі нұсқада бақылау жұмы сын жүргізу.
Сабақ барысы:Ұйымдастыру кезеңі. Бақылау жұмысын екі нұсқада жүргізу:
1 нұсқа
-
Мына қосылыстардың ішінен оксидтердің формулаларын теріп жазып, оларды атап элементтердің валенттіліктерін анықтаңдар.
HCI, CaO, Na2S, CO2, KCI, P2O5, H2S, SO2, H2SiO3, Fe2O3.
-
Мына реакция теңдеулерін аяқтап, теңестір.
C + O2=
S + O2 =
HgO =
Ag + O3=
-
Сынап (II) оксидіндегі оттектің массалық үлесін (%) есептеңдер.
-
Мына элементтердің: H, Na, Mg, AI, Ca оксидтерінің формуласын жазып, атауларын атаңдар.
-
Мына оксидтерді: MnO2, MnO3, NO, Mn2O7 халықаралық атаулары бойынша екі тәсілмен атаңдар.
2 нұсқа
1. Мына қосылыстардың ішінен оксидтердің формулаларын теріп жазып, оларды атап элементтердің валенттіліктерін анықтаңдар.
NaCI, FeO, K2S, CaO, KCI, Ag2O, H2S, SO2, H2SO3, NO.
-
Мына реакция теңдеулерін аяқтап, теңестір.
N2 + O2=
P + O2 =
CuS + O2 =
Cu + O2=
-
Магний (II) оксидіндегі оттектің массалық үлесін (%) есептеңдер.
-
Мына элементтердің: H, Si, Ag, Cu, Ca оксидтерінің формуласын жазып, атауларын атаңдар.
-
Мына оксидтерді: Cr2O3, CrO3, NO2, AI2O3 халықаралық атаулары бойынша екі тәсілмен атаңдар.
Үйге тапсырма: Қайталау.
Сабақтың тақырыбы.
Сутегінің химиялық қасиеттері және оның қолдануы
Сабақтың мақсаты. Оқушыларды сутегінің химиялық қасиеттерімен таныстыру. Тотықтырғыш, тотықсыздандырғыш ұғымдарын қалыптастыру. Экологиялық таза отынның маңызын айту.
Құрал -жабдықтар. Мыс/фольга/, мыс оксиді /ІІ/, қорғасын /ІІ/ оксиді, қорғасын, пробиркалар, Кипп аппараты, спиртшам, сіріңке, зертханалық штатив, оттегі толтырылған штатив, оттегі толтырылған газометр, резенке тығыны бар 150мл қалың кабатты колба, суы бар табақша, воронка. Оқушылардың үстелінде мыс /ІІ/ оксиді немесе қорғасын /ІІ/ оксиді, мырыш, тұз қышқылы / хлорсутегі/ газадар алуға арналған құрал, пробирка, спиртшам, сіріңке, пробирка ұстағыш.
Тірек білім мен біліктер. Сутегі оның физикалық қасиеті, химиялық реакция. Тотықсыздандырғыш.
Өткен сабақта алған білім біліктер тексеру үшін төмендегі тапсырма беріледі. 1. Магний мен тұз қышқылының арасындағы химиялық теңдеуін жаз. Суды ығыстыру арқылы сутегіні жина. 2. Мырыш пен күкірт қышқылын әрекеттестіріп, сутегі алындар. Химиялық реакция тендеуін жаз. 3. Ауаны ығыстыру арқылы сутегіні жина. 4. Сутегіні екі түрлі жолмен алып, реакция тендеулерін жаз. 5. Хлорсутегіндегі сутегінің массалық үлесін есепте.
Оқушылар мындай есепті шығарады: екі ыдыс сутегі мен оттегіне толтырылған. Осы газдардың физикалық қасиеттеріне сүйіне отырып, қай ыдыста қай газ екенін табындар?
Өткен сабақты пысықтағаннан кейін жаңа материалды оқытуға көшеді. Жаңа сабақты мындай тәртіппен өтіледі.
Тәжірибе: а/ сутегінің оттегінде жануы; ә/ Сутегінің тазаағанын тексеру; б/ Сутегінің ауада және оттегінде жануы; Судың түзілуі. Жасалған тәжірибелерден шығатын қортынды: Сутегі -жанғыш зат оттегімен қосып жандырғанда қопарылыс береді. Оқушыларға мынадай сұрақтар қойамыз: Сутегі күрделі заттың құрамында оттегімен әрекеттеседі ме ? Құрамында оттегі бар қандай күрделі заттарды білесіндер? Оқушылар столында мыс оксидінің /ІІ/ қара ұнтағы бар. Сутегімен әрекеттескенде қандай заттар түзілетінін табу үшін орын бсу реакциясын еске түсіру керек. Реакция нәтижесінде мыс бос күйінде бөлінеді . Бұл жерде -тотықтырғыш. Тотықтырғыш ұғымын түсіндіреміз. Тәжірибені жүргізу барысы айтылып түсіндірілгеннен кейін оқушылар зертханалық жұмыс жүргізіледі /оқулық, 113 -бет, 11 -жұмыс/. Реакция теңдеуін құрастырады. Мыс оксиді жоқ болса, темір /ІІ/ оксидін Ғе2О3 алуға болады. Темірдің пайда болуын магнитпен тексереді. Жаңа сабақты оқушылар сутегінің химиялық қасиетімен таныса отырып, мына байланыстарды түсінуі керек.
Металл оксиді + сутегі →металл + су
Бейметалл + сутегі →күрделі зат
Сутегінің қолданылуын түсіргенде мына рекция оқушылардың есіне түсіреді:
2Н2+О2= 2Н2О+ 571,6кДж
Сутегі жанғанда көп энегргия беріледі, осы қасиеті неге байланысты? Сутегін таза отын ретінде қолдануға болады. Сутегінің қолданылуы оның қасиетіне байланысты екенін ескере отырып, мынадай кестені ұсынуға болады.
Сутегінің қолданылуы мен қасиетінің арасындағы
байланыстық
Сутегінің қасиеті
Сутегінің қолданылуы
1.Өте жеңіл газ
2. Оттегінде жануы /жалынның температурасы 2500°C/
3.Бейметалдармен қосылуы /мысалы, хлор, азот/
4.Металдарды тотықсыздандыру: WO3+3Н2=W+3Н2О
Атмосфераны зерттеу үшін шарзондтар толтырылады
Металдарды қосу, отын ретінде ерекше құрылысты іштен жану двигательдерінде қолданылады
Қышқылдарды алу /мысалы, тұз қышқылы/, аммиакты /NH2/ және азот тыңайтқыштарын алу үшін
Кейбір металдарды алу үшін
Кестенің оң жағын кітаппен өздігіннен жұмыс істеу арқылы оқушылар өздері толтырылады. Мұғалім жазған жуаптарын тексереді.
Үйге тапсырма. §31. 3,4,6 -жаттығулар. Темір /ІІ/, алюминий АІ, литий /Lі/ металдармен тұз қышқылын арасындағы реакция теңдеулерін жазындар.
Сабақтың тақырыбы.
Қышқылдардың құрамы. Тұздар.
Сабақтың мақсаты. Оқушыларды жаңа қышқыл, тұз, индуктор ұғымдарымен таныстыру. Қышқыл қалдығының валеттілігін, тұздардың формуласын мен аттарын уйрету.
Құрал жабдықтар.Күкірт қышқылы, тұз қышқылы, фосфор қышқылы, азот қышқылы, т.б. мырыш, магний, сутегі. Оқушы үстелінде: 12 -зертханалық жұмысқа керекті реактивтер мен ыдыстар.
Тірек білім мен біліктер: валеттілік, қышқыл, тұз, оксид, қышқыл қалдығының валенттілігі, валенттілігі бойынша тұздарды жаза білу, негізгі қышқылдарды атау.
Сабақты әнгімелесу түрінде жүргізуге болады. Ол үшін мұғалім мынадай сұрақтар қойады:
1.Сендерге қандай жай заттар белгілі?
2.Қандай күрделі заттармен таныстыңдар?
3.Төмендегі заттар қандай кластарға жатады?
Na2O, CaO, AL2O3, H2O, CO2
/Формулаларды мұғалім тактаға жазады./
Сутегінің химиялық қасиетін қайталау мақсатында төмендегі тапсырмалаларды беруге болады.
-
Мына заттардың қайсысымен сутегі әрекеттесед:
О2, Н2О, СІ2, СиО, СО2, РвО?
Рекция теңдеуін жаз, реакцияның қай типіне жатқызасыздар?
2.Екі газ А және В берілген. А газы Б газында жанғанда бу пайда болады, оны суытқанда түссіз сұйықа айналады, осындай жағдай А газы қыздырылған мыс оксиді /ІІ/ арқылы өткізгенде /жібергенде/ де болды. А және Б газдарын тап. Жоғарыда құбылыстарды түсіндір, реакция тендеулерін жаз.
3. Мырыш пен тұз қышқылын әрекеттескенде алынған газды қатты қыздырған марганец /ІV/ оксиді арқылы өткіземіз. Қандай заттар түзіледі? Реакция тендеулерін жаз, реакцияның қай типіне жататынын көрсет. Қышқылдың құрамын оқып үйрету үшін кесте толтырамыз, онда бес бағна болады, қышқылдың формуласы /1./ қышқылдың аты /2./ қышқыл қалдығы /3/, тұздың осы қышқылы тән тиісті ата /4/, тұзға мысал, оның аты /5/.
Мұғалім мына қышқылдардың НСІ, Н2S, Н2SО4,НNО3
формулаларын жазады. Бұл заттарды оксидтерге жатқызуға бола ма? Бұл қышқылдардың құрамында қандай ұқсастық бар?
Қышқыл қалдығы ұғымын түсіну үшін сутегі бөліну реакциясын еске түсіру қажет. Мырыш тұз қышқылымен әрекеттескенде сутегі бөлінеді. Неліктен? Реакция теңдеуін бір оқушы тақтаға жазып, реакция нәтижесінде түзілген заттардың құрамын түсіндіреді. Оқушылар өздері қорытынды жасайды: металл қышқыл құрамындағы сутегін ығыстырып шығарады да, тұз түзеді. Тұз құрамына металл және қышқыл қалдығы кіреді. Мысалдар келтіріледі: Тұздың аты бойынша формуласын құрастр немесе берілген тұздың формуласы бойынша атын атаңдар: алюминий хлориді АІСІ3. Валенттілігі бойынша формуласын құрастыр. Сол сияқты темір сульфаты /ІІІ/ Ғе2/SO4/3, кальций нитраты Са/ Na3/2, барий карбанаты ВаСО3, натрий хлориді NaCI, т.б.
Мұғалім мынадай сұрақтар қояды. Құрамына қарап қандай күрделі заттарды қышқылдар, тұздар деп атаймыз? Қышқылдарды қандай қасиетіне сүйеніп жіктейміз? Оқушылар өздерінің тұжырымдарын айтады: екі қасиетіне сүйеніп, қышқылдарды екі топқа бөлеміз. Бірінші, сапалық жағы, құрамында оттегінің болу болмауы, екінші, сандық құрамы, қышқылдағы сутегінің саны . Кестені әрі қарай толтыра береміз. Қышқыл қалдығының төбесіне рим цифрмен валеттілігін қоямыз.
Мұғалім өзіндік жұмыс ретінде бірнеше тұздардың формуласын жазуды тапсырады: бірнеше қышқылдың натриймен, кальциймен формулаларын жаз, аттарын ата. Қышқылдардың индикаторға әсерін түсіндіру мақсатында зертханалық жұмыс жүргіземіз. Жұмыс нәтижесін кестеге түсіреміз.
Қышқылдардың қасиеттері
Қышқылдың аты және формуласы
Физикалық қасиеті, түрі, түсі
Ерігіштігі
Индикаторға әсері
Басқа қышқылдан айырмашылығы
Жаңа сабақты пысықтау мақсатында бірнеше тапсырмалар орындатамыз.
1.Төменде көрсетілген заттардың ішінен қышқылдардың, тұздардың формулаларын теріп жаз, қышқыл қалдықтарының астын сыз, валенттілігін көрсет:
СиО, НNO3, Mg, H2SO4, HCI, K2SO4,H2O, NaOH, KCI.
2.Көмір және кремний қышқылдарының формуласын құрастыр, олардың әрқайсысының қышқыл қалдықтарының валенттіліктері екіге тең.
3. Берілген қышқылдардың, қышқыл қалдығының валенттілігін табындар:
HNO3, H2SO3, HBr, H3PO4, H2CO3, KCI, H2SO4.
Үйге тапсырма. §32, 33. 1,3,4 -жаттығулар.
Сабақтың тақырыбы
Қышқылдардың химиялық қасиеті
Сабақтың мақсаты. Оқушылар қышқылдардың металдармен әрекеттесуімен танысады. Валенттілік ұғымын дамыту.
Құрал -жабдықтар: Концентрлі қышқылдар мен ерітінділері / күкірт, тұз қышқылы/, мырыш, магний.
Оқушылар үстелінде: №13жұмысқа тиісті реактивтер мен ыдыстар.
Тірек білім мен біліктер: Қышқылдар, тұздар, құрамы, қышқылдың индикаторға әсері. Металдардың активтік қатары.
Қышқылдардың құрамы туралы білімін қайталау үшін мынадай тапсырма беруге болады. 1. Қышқылдарға, тұздарға қандай заттар жатады? 2.Тығыны бар екі пробиркада концентрлі хлорсутегі және күкірт қышқылы бар. Оларды қалай айыруға болады? 3.Екі стаканның қайсысында су, қайсысында қышқыл бар екенін қалай айырамыз? 4. Тәжірибе арқылы тұз қышқылының құрамына сутегі элементі бар екенін дәлелде. 5. Азот және фосфор қышқылдарының формуласын жаз, егер азот қышқылының қалдығы NO3 -бір валентті, ал фосфор қышқылының қалдығы -РО4 -үш валентті болса. 6. Қышқыл құрамындағы сутегі жай зат па, әлде элемент пе? 7.Мына заттардың тұздарды теріп жаз, қышқыл қалдықтарының астын сыз, валенттіліктерін көрсет. СиО, НNO3, Н2О, К2SO4, H2SO4, HCI, NaOH, KCI, H3PO4, AIPO4, Mg. Мына заттардың ішінен СиSO4, H2S, H2O, HCI, CиСІ2, H2SO4, Ca3/РО4/2, HNO3, P2O5, HBr, NaOH, H2CO3, Са/ОН/2, Н2SiО3 қышқылдарды теріп жазыңдар, төмендегі кестені толтырыңдар.
Қышқылдың аты мен формуласы
Құрамында оттегі бар
Құрамында оттегі жоқ
Бір негізді
Көп негізді
Азот қышқылы
+
-
+
-
Тұз қышқылының лакумус қағазымен сынағаннан кейін /лакумус қызарады/ магний жанқасын салдық. Біраз уақыттан кейін ерітіндісінің түсі неліктен өзгереді? Сұрақтың жауабын талқылағаннан кейін, мырыш пен күкірт қышқылының арасындағы реакция жасап көрсетеміз. Нәтижесі талданады. Барлық металдар сутегін бөліп шығарама? Осы сұраққа жауап ретінде оқушылар қышқылдардың металдарға әсерін негізделген зертханалық жұмыс жүргізеді. Оқушылар мыспен реакция жүрмейтін тәжірибе жүзінде көреді. Реакция теңдеулерін жазып, металдардың активтігін салыстырады да, қорытынды жасайды.
Зертханалық жұмысты қорытындылау үшін оқушыларға мынадай сұрақ қоюға болады: 1Фосфор қышқылымен а/ сынап; ә/ алюмиеий; б/ хром әрекеттесе ме? 2.Мүмкін болатын реакциялардың теңдеулерін жазыңдар.
Үйге тапсырма. §31. 1 -4 -жаттығу.
Сабақтың тақырыбы
Қышқылдардың металл оксидтерімен әрекеттесуі.
Алмасу реакциясы.
Сабақтың мақсаты. Оқушыларға қышқылдың металл оксидімен әрекеттесуін түсіндіру.Реакцияның жаңа типі -алмасу реакциясымен таныстыру.
Құрал -жабдықтар. Мыс /ІІ/ оксиді, күкірт қышқылының ерітіндісі, әк суы, мыс сульфатының/ кристалдары/ пробирка, спиртшам, сіріңке, шырпы. Оқушылардың үстелінде: 14 -зертханалық жұмысқа керекті реактивтер мен ыдыстар.
Тірек білім мен біліктер. Оксидттерді, металл оксидтерін, қышқылдарды, тұздарды ажырата білу. Алмасу реакциясы.
Өткен сабақты қайталау мақсатында оқушыларға бірнеше тапсырмалар беріледі.
1.Төмендегі заттар арасындағы реакция жүре ме: а/мырыш пен күкірт қышқылы; ә/ күміс пен фосфор қышқылы ; б/ магний мен тұз қышқылы; в/мыс пен тұз қышқылы? Жауабын түсіндіріндер. Жүретін реакция теңдеулерін құрастыр. Түзілген тұздардың атын ата.
2.Төмендегі реакцияларды аяқта. Реакцияның қай типіне жататынын айт: Ғе + S→, Н2SО4+Mg→, Н2О→
Zn+НСІ→ АІ+Н2S4→
3.Төмендегі жүретін реакция тендеулерін құрастыр:
H2SО4+Mg→ НСІ+АІ →
НСІ+Си → Н2SО4 +Нg→
Н2SО4 +Са→ НСІ+Аg→
Н3РО4+Аg→ Н3РО4+Nа→
Жаңа сабаққа кіріспес бұрын мынадай мәселелерді оқушылардан анықтау керек. 1. Реакциялардың қандай типтерін білесіңдер? Мысал келтіріңдер. 2.Қышқылдағы сутегінің орнын күрделі қосылыстағы меалдар баса ала ма? Құрамында металл бар қандай күрделі қосылыстарды білесіндер? Металл оксидтері қышқылымен әрекеттесе ме?
Оқушылармен әнгімелесе отырып, 14 -зертханалық жұмыс барысы талданады. Жүргізген реакциялардың теңдеуін жазу керек. Бұл реакцияны бұрын танысқан реакция типтеріне жатқызуға бола ма? Алмасу реакциясына сызбанұсқасын келтіреді:
АВ+СД=АД+СВ. Содан кейін оқушыларға алған білімін бекіту үшін 5 - минуттық өздігінен жұмыс береміз.
І нұсқа
1.Тұз қышқылының а/ магний; ә/ магний оксидімен реакция тендеулерін құрастыр.
2.Төмендегі заттардың қайсысымен күкірт қышқылы әрекеттеседі:
СиО, Си, ZnO, НСІ?
ІІ нұсқа
-
Күкірт қышқылының а/магниймен; ә/ магний оксидімен реакция теңдеуін құрастр.
-
Төмендегі заттардың қайсысымен тұз қышқылы әрекеттеседі:
НgО, Нg, СаО, Са, Н2SО4?
Үйге тапсырма; §32,33. 2,3-жаттығу.
Сабақтың тақырыбы.
Сутегі. Қышқыл. Тұз тарауын қайталау және қорытындылау
Сабақтың мақсаты. Оқушылардың осы тақырыпта алған білімін белгілі жүйеге келтіріп, қорытындылау. Сутегі мен қышқылдардың химиялық қасиеттерін, тұздардың формуласын құрастырып, қышқылдардың қатысындағы химиялық реакция теңдеулерін жаза білуге үйрету. Оқушыларды сарамандыққа дайындау.
Құрал -жабдықтар. Тұздардың, қышқылдардың ерітінділерді, оксидтер, метелдар, индикаторлар. Оқушылар үстелінде эксперименттік есепке арналған заттар; мырыш, тұз қышқылы, шыны, сіріңке, спиртшам, индикатор, темір /ІІІ/ оксиді, темір, алюминий, сүзгіш заттар, бейорганикалық заттардың жинақтамасы.
Тірек білім мен біліктер. Сутегі, оксид, қышқыл, тұз окидтері. Олардың индикаторға әсері. Масса, мольдік массамен есептер шығару.
Сабақты эксперименттік есептер шығару үшін тақтаға оқушылар шақырылады.
-
Үстелде бар реактивтерді пайдаланып, сутегін алыңдар. Сутегі жанғанда су түзілетінін дәлелде. Реакция теңдеуін жаз.
-
Ыдыста тұз қышқылы бар екенін бірнеше жолдармен анықта. Реакция теңдеуін жаз.
-
Қышқылдың химиялық қасиетін түсіндіретін реакциялар жаса, олардың маңызын түсіндір. Реакция теңдеуін жаз.
-
Темір /ІІ/ сульфатын алу реакциясын жүргіз және жеке бөліп ал.
Оқушылармен әңгімелесу мына сұрақтар арқылы жүргізіледі
1.Бейорганикалық заттардың қандай кластарын оқып үйреңдіндер? Олардың қандай ұқсастығы және ерекшелігі бар.
2.Окидттерге, қышқылдарға тұздарға анықтама беріңдер.
3."Бейорганикалық қосылыстар" жинақтамасын пайдалана отырып, қосылыстардың аттарын ата, қай класқа жатқызасын, мысал келтр.
4. а/ оксидттерді; ә/ тұздарды алудың екі түрлі жолын реакция теңдеуімен көрсет.
5.Төмендегі сызбанұсқа бойынша жүретін реакция теңдеулерін жаз:
Нg
Химиялық теңдеулер бойынша есептер шығару. Масса, малекулалық масса ұғымдарын қайталауға тапсырма беруге болады:
40г х моль
СиО+Н2S4 = Си SО4 +Н2О
Есептің берілгенін көрсетіп, шығар.
Оқушыларға белгілі реакция теңдеулерін пайдаланып, әр түрлі есептер беруге болады "моль -г ", "моль -моль", "г -г ".
Сабақты қорытындылау ретінде оқушыларға өзіндік жұмыс тапсырамыз. Сызбанұсқа бойынша реакция теңдеулерін жаз.

І нұсқа
Мg→MgO→MgCI2
ІІ нұсқа
Си СиО→Си SО4
Үйге тапсырма. §32, 33 /қайталау/. 4, 6 -жаттығу, 4 -сарамандық жұмысқа дайындалу.
IV-тарау. СУ. ЕРІТІНДІЛЕР. НЕГІЗДЕР.
№1 -2 сабақтың тақырыбы: Су адам өмірінде. Табиғаттағы су. Қолданылуы. Су -еріткіш.
Сабақтың мақсаты. Оқушыларды судың еріткіштік қасиетімен таныстырып, бұл құбылысты молекулалық теория негізінен түсіндіре білуге үйрету. "Ерітінді", "ерігіштік " ұғымдарының мәнін ашып, оның өнеркәсіптегі, халық шаруашылығындығы алатын орнын көрсету. Суды тазарту әдістері, тиімді пайдалану және қорғау шараларымен таныстыру.
Құрал -жабдықтар. Айдау кубы, бөлгіш воронка, цилиндр, сынауықтар.
Тірек білім мен біліктер. Заттардың агрегаттық күйлері, қоспаларды ажырата және бөле білу біліктері, заттың құрлысы мен құрылымы, суда заттардың еруі.
Сабақ барысы: Оқушылардың географиядан, табиғаттанудан алған білімдеріне сүйене отырып, бұл сабақты әңгімелесумен бастаған жөн. Әңгіме төмендегі сұрақтар төңірегінде болады.
1.Судың қандай агрегаттық күйлерін білесіңдер?
2.Табиғаттағы судың таралуына, оның тіршіліктегі маңызына мысалдар келтір.
3.Табиғи суда қандай қоспалар болуы мүмкін? Себебін түсіндір.
4.Суды қандай мақсатта тазарту қажет деп ойлайсыңдар?
Бұл сұрақты талдағанда оқушылар таза судың кеңінен қолданатындығын, оның адам өмірінде, тұрмыста, өнеркәсіпте орны ерекше екендігін қорытындылайды.
Осыған орай суды қолданылатын мақсатына сәйкес қосымшалардан тазартудың түрлі әдістері болатындығына тоқталып өткен жөн. Ол үшін оқушылардың тірек білімін естеріне түсіреміз. Қоспаларды бөлудің қандай әдістері бар? Фильтрлеу әдісі суды қандай қосымшаларынан тазартуға қолданылады? т.б. сұрақтар қоюға болады. Мұнан кейін оларды тазалаудың басқа әдістерімен де таныстырамыз.
1.Айдау әдісі. Бұл әдіс суды еріген заттардан бөлу үшін қолданылатындықтан айта келіп, зертханада қолданылатын құралдың құрлысымен таныстыру қажет.
Көрнекі көрсету. 1. Ол үшін айдауға арналған құрал құрастырып, суды айдау процесі зертханада көрсетіледі. Зертханалық құралдардың жұмыс істеу принципін негізге ала отырып, өндірісте дистильденген су алуға арналған айдау кубына сипаттама беріледі.
2. Суды ерімейтін тығыздығы әр түрлі сұйық қосымшалардан бөлуге қолданылатын тағы бір зертханалық құрал бөлгіш варонкамен таныстыру. Ол үшін бөлгіш варонкаға су мен жанармай қоспасын құйып, олардың бөлу тәсілін көрсетуге болады. Айтылған әдістердің суды тазартуда кеңінен қолданылатынына тоқтала отырып, бірақ бұл әдістерді қолдану су ресурстарын пайдалану мәселелерін толық шеше алмайтындығына, қазіргі таңда елімізде оны қорғау және табиғи ресурстарды тиімді пайдалану туралы заң заң қабылданып отырғанына баса назар аударылады.
Бұл сабақта тағы бір ерекше көңіл аударатын мәселе судың еріткіш екендігіне мысалдар арқылы көз жеткізу. Оқушылар судың түрлі заттарды ерітетінін табиғаттану курсынан білетіндігін ескере отырып, негізгі жұмыс "ерітінді" ұғымының мәнін ашуға бағытталады. Ол үшін төмендегі сөйлемдер қандай мағына ұқтыратыны талданады.
1. Тұз, қант және басқа заттар суда ериді.
2. Су көп заттарды ерітеді.
3. Суда заттардың еру құбылысы жүреді.
4. Су -жақсы еріткіш.
5. Ерітінді тұнбай, біркелкі болып тұрады.
Мұнда еріткіш ретінде судың қандай рөл атқаратындығы, заттардың еруі қалай жүретіндігі түсіндіріледі. Сонан соң тотиянның суда еруін көрсету қажет. Тәжірибені жүргізу барысында еруді жылдамдататын жағдай ескеріліп, оқушылар заттың еруі;
а) ерітіндіні араластырғанда:
ә) қыздырғанда;
б) зат пен еріткіш бетінің жанасуын арттырғанда;
в) еритін заттың тығыздығы еріткіштің тығыздығынан артық болғанда тез жүретіндігін қорытындылайды.
Оқушылардың табиғаттану курсынан заттардың шексіз ерімейтіндігін білетінін ескере отырып, қанықпаған және қанық ерітіндіге анықтама бергеннен кейін заттың ерігіштігі туралы ұғымды түсіндіру қажет. Ол үшін " заттардың ерігіштігі ерітінді қанық болуы үшін берілген температурада судың белгілі мөлшерінде заттың қандай массасы ери алатынын көрсетеді " -деген анықтамаға талдау жасалады. Мысалдар келтіре отырып , заттар суда еритін, аз еритін, ерімейтін болып бөлінетіндігін қорытындаланады.
Өтілген материалдарды бекітуге арналған сұрақтар:
-
Суды тазартудың қандай әдістері бар? Олар қандай жағдайда қолданылатынына мысалдар келтр.
-
Тұрмыста қолданылатын заттардың судағы ерітіндісіне мысалдар келтір.
-
Алтын мен мұнай көзін іздеуге қарағанда табиғи су көзін табуға
-
ерекше күш пен еңбек жұмсалатын себебі неде? Дәлелді жауап беріндер.
-
Географиядан, биологиядан алған біліміне сүйене отырып, төмендегі ойлардың мәнін түсіндіріңдер:
а) су -біздің ғаламшарымызда жер бедерін түзуші негізгі геологиялық фактор;
ә) су -өнеркәсіп пен ауыл шаруашылығы дамуының негізі: б)өзендер, көлдер, мұхиттар азық -түліктің және минералды заттардың энергия мен жылу көздерінің, қатынас жолдарының, жер бетіндегі ауа райының, климаттың және егін шығымының анықтауышы;
в) табиғатты аялау, оның байлықтарын қорғау міндеттерін өзің қалай орындайтының туралы хабар дайында.
Үйге тапсырма беру: § 36-37.
№3 сабақтың тақырыбы: Ерітінділердің концентрациясы. Еріген заттардың массалық үлесі. (молярлық концентрация)
Сабақтың мақсаты: Оқушыларға еріген заттың массалық үлесі және ерітіндінің концентрациясы туралы түсінік қалыптастырып, оны есептеуге және іс жүзінде қолдана білуге үйрету.
Тірек білім мен біліктер: Зат мөлшері, мольдік масса, элементтің күрделі заттағы массалық үлесін есептеу білігі. Физика курсынан еріген заттың массалық үлесі.
Сабақ барысы: Үй тапсырмасын төмендегі сұрақтармен тексереміз.
-
Судың физикалық қасиеттерін сипатта.
2. Суды қолданылатын мақсатына қарай тазарту әдістерінің қандай түрлері бар?
-
Молекулалық теорияға сүйеніп, еру құбылысын қалай түсіндіруге болады?
-
Қаныққан және қанықпаған ерітінділер дегеніміз не?
Қанықпаған ерітіндісінің анықтамасын еске түсіргеннен кейін, оқушылармен осы ерітіндінің сандық құрамын қалай анықтауға болатындығы қарастырылады. Ол үшін оқушыларға "күрделі заттағы элементтің массалық үлес қалай есептеледі?" -деген сұрақ беріліп, бір мысалды талдаған соң, бұл әдіс еріген заттың массасы жалпы массаның қандай бөлігін құрайтынын есептеуге қолданылатынын ескертіледі. Физика курсынан еріген зат массаның ерітіндінің жалпы массасына қатынасын еріген заттық массалық үлесі деп айтатыны оқушыларға белгілі болғандықтан, енді осы массалық үлесті өрнектеу әдістері қарастырылады.
1. Массалық үлес бірліктерімен: а) ω = m еріген зат
m ерітінді
немесе процентпен өрнектеледі: ә) ω%= m еріген зат . 100%
m ерітінді
Оқушылардың физика мен математика сабақтарынан алған есептеу біліктерін қолдана отырып, еріген заттың массалық үлесін есептеуге жаттығу жұмыстары жүргізіледі. Ол үшін, мысалы 25% -дық ерітінді туралы сөз болғанда, оқушылар 100г мұндай ерітіндіде 25г тұз бар екенін білуге қажет. Ол есептеу жүргізу барысында пропорция құруды жеңілдетеді. Бұл жерде процент дегеніміз - санның жүзге қатынасы екенін де ескерген жөн, яғни 25 % дегеніміз 25 , бұл жағдайда пропорцияның мәні өзгеріп,
100 мындай түрде өрнектеледі.
20 = 25 не 0,25=25%
80 100 Бұл пропорцияда оның кез келген мүшесі есеп шартына орай белгісіз болуы мүмкін:
-
х = 25 2. 20 = 25 3. 20 = х
80 100 х 100 80 100
Бірінші пропорцияға мынадай есеп сәйкес келед: 80г 25% -тік тұз ерітіндісі берілген. Еріген тұздың массасы қандай?
Екінші пропорция: 20г тұзды ерітіп, 25% -тік ерітінді алу үшін, судың қандай массасын алу қажет?
Үшінші пропорция: егер 80г ерітіндіде 20г тұз бар екені белгілі болса, еріген заттың массалық үлесі қандай?
Осылайша мұғалім бір белгісіз бар теңдеуді шешу арқылы ерітінді дайындау үшін тұздың, судың қандай массасы қажет екенін, еріген заттың массалық үлесін табуға болатынын оқушыларға басқа пәндерден белгілі әдістермен түсіндіре алады. Сонымен қатар еріген заттың массалық үлесін анықтауға арналған формулалардан:
m еріген зат = ω% (ер.зат) · m ерітінді
100%
еріген заттың және судың массасын біле отырып, массалық үлесі белгілі ерітінді даярлауға болатындығын оқушылар өз бетінше қорыта алады.
Ерітіндінің белгілі мөлшерінде еріген зат мөлшері тек пайыздық концентрациясымен ғана өрнектелмейтіндіктен және іс жүзінде өте жиі қолданылатындықтан бұл сабақта молярлық концентрация туралы ұғым қалыптастырылады. Молярлық концентрация 1000мл (1л) ерітіндіде еріген заттың қанша мөлшері болатындығын көрсетеді. Осыған орай оқушылар зат мөлшері деген шама не білдіретіндігін оның өлшем бірліктерін еске түсіреді.
Егер, мысалы, 1000мл ерітіндіде 1моль зат еріген болса, онда мұндай ерітінді бір мольді (1М) деп аталады.
Егер 100мл ерітіндіде 0,5 моль зат еріген болса, оның концентрациясын анықтау үшін 1000мл осындай ерітіндіде еріген заттың қанша молі бар екенін табу керек.
0,5 · 1000 = 5 моль, яғни ерітінді 5М. Көрсетілген концинтрация түрінің
100
өзіндік ерекшелігі бар екеніне көңіл аудару қажет. Мәселен, молярлық концентрациясы бірдей ерітінділердің бірдей көлемдегі зат мөлшері (моль) бірдей болады. Бірақ әр түрлі массаларының моль саны әр түрлі болғандықтан, еріген заттың массасы бірдей болмайды. Мысалы, 100г 10% -тік ас тұзы және қант ерітіндісінде көрсетілген заттар 10г болады. Сарамандық жұмыста - оқушыларды түрлі концентрациялы ерітінділер даярлауға дайындау мақсатында мынадай есептеулер жүргізуге жаттықтыру қажет.
Есеп: 0,4М 100мл глюкоза ерітіндісін даярлау қажет.
Глюкозаның формуласы С6Н12О6 салыстырмалы малекулалық массасы 180.
Молярлық концентрациясы анықтамасы бойынша 1000мл, 0,4М ерітіндіде 0,4 моль еріген зат болады, яғни 180г/моль · 0,4моль =72г Ал 100мл ерітіндіде, еріген зат бір литрдегіден 10 есе аз болатындықтан, мұндай ерітінді даярлау үшін 7,2г глюкоза өлшеп алу қажет болады. Мұндай есептеулер жүргізген соң, оқушыларға молярлық ерітіндіні даярлау барысында өлшеуіш колба мен өлшеуіш цилиндр қолдану ыңғайлы екені ескертіліп, онымен жұмыс істеу технологиясы көрсетіледі.
Оқыған материялды бекіту үшін орындалатын жаттығу жұмыстары.
1. Оқулықтағы 2, 3, 4, 5 ,6-жаттығу.
2. 50мл ерітіндіде 0,1 моль еріген зат бар. Ерітіндінің молярлық концентра циясы қандай?
3. Қай ерітіндіде зат көп мөлшерде болады: 150г 10% -тік натрий хлоридінің ерітіндісіне ме, әлде осы тұздың 0,1 моль 1л ерітіндісіне ме?
Үйге тапсырма беру: §38. Есептер жинағынан:3-25,3-26,3-28,3-30,3-31
Сарамандық жұмыс №6 .
№4 сабақтың тақырыбы: Таразымен жұмыс істеп үйрену.
Мақсаты: Таразының түрлерімен таныстыру. Жұмыс істеушілердің бәріне таразыны дұрыс пайдалана білу керектігін үйрету.
Құрал-жабдықтар: Таразы түрлері. Таразының түрлеріне сәйкес гирлері. Өлшене тін зат. Химия лабораториясына ең керекті қажетті жабдықтардың бірі - таразы. Лабораторияда шамамен өлшеу үшін техно-химиялық (2-сурет),
Аналитикалық (1-сурет) электронды т.б таразылар қолданылады.
Техно - химиялық таразыда заттың салмағын 0,01грамға дейінгі дәлдікпен анықтауға болады. Бұл таразыда синтез жұмыстарында бастапқы алынған зат пен реакциядан шыққан заттарды өлшеу жиі қолданылады.
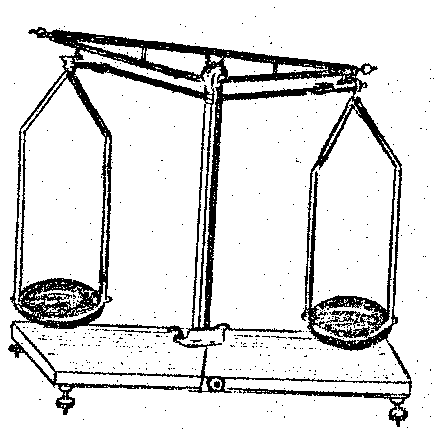 Аналитикалық таразының дәлдігі техно- химиялық таразыдан дәлірек болады. Анализ жұмыстарына қолданылады. Бұл таразыда заттарды 0,0001-0,0002 грамға дейінгі дәлдікпен өлшеуге болады. Әрбір таразының өзіне сәйкес гирлері болады. Техно-химиялық немесе аналитикалық таразы үшін арнаулы қорапқа салынған майда гирлер болады. Кәдімгі гирлерді қолмен алады. Техно-химиялық гирлер мен аналитикалық майда гирлерді қолмен алуға болмайды, себебі олардың дәлдігі өзгереді, сондықтанмайда гирлерді қысқышпен алу керек. Шамамен өлшеуге арналған таразыларды кез келген столға қоюға болады.
Аналитикалық таразының дәлдігі техно- химиялық таразыдан дәлірек болады. Анализ жұмыстарына қолданылады. Бұл таразыда заттарды 0,0001-0,0002 грамға дейінгі дәлдікпен өлшеуге болады. Әрбір таразының өзіне сәйкес гирлері болады. Техно-химиялық немесе аналитикалық таразы үшін арнаулы қорапқа салынған майда гирлер болады. Кәдімгі гирлерді қолмен алады. Техно-химиялық гирлер мен аналитикалық майда гирлерді қолмен алуға болмайды, себебі олардың дәлдігі өзгереді, сондықтанмайда гирлерді қысқышпен алу керек. Шамамен өлшеуге арналған таразыларды кез келген столға қоюға болады.
1-сурет 2-сурет
Таразыда өлшеуі ережесі:
-
Өлшейтін затты таразы табақшаларына бірден салуға болмайды.
Ыдысқа немесе қағазға салып өлшеу керек.
-
Өлшенетін затты таразының сол табақшасына , гирлерді оң табақшасына салады. Өлшенетін зат пен гирлер табақшаның дәл ортасына қойылады.
-
Гирлерді қысқышпен алуға және таразыдан алынғангирлер қораптың қай ұясынан алынса, сол ұяға салынады. Гирлерді стол үстіне қоюға болмайды, өйткені олар тез ластануы немесе жоғалуы мүмкін.
-
Өлшенгеннен кейін таразыда еш нәрсе қалдырмау керек.
-
Ж
11ұмыс бітісімен таразы мен гирлер тексеріледі.
Назар аудар !!!
Сұйықты өлшегенде таразының табағына төкпеу керек. Әсіресе қышқылдарды өлшегенде өте сақ болу қажет.
Есіңде болсын!!!
Таразы табақшаларына ыстық, дымқыл және лас заттарды қоюға болмайды. Сұйықтарды өлшегенде таразыға және гирлерге сұйық тигізуге болмайды.
Үйге тапсырма беру: Қ
9айталау.
Сарамандық жұмыс №6.
№5 сабақтың тақырыбы: Еріген заттың белгілі массалық үлестері бар заттың ерітінділерін дайындау.
Мақсаты: Оқу үрдісінде алған білімнің нәтижесін ерітінділер даярлауда іске асыру. Өлшеу, есептеу дағдыларын дамытып, белгілі концентрацияда ерітінді йындау іскерлігін қалыптастыру.
Құралдар мен реактивтер: 50мл,25 мл, 100 мл көлемдегі стақандар, шыны таяқша, таразы, гирлер,қалақша, өлшегіш цилиндр, өлшемі бар құтылар 25 мл,50 мл,100 мл.
1.Заттың массалық үлесі көрсетілген тұз ерітіндісін дайындау;
1. Заттың массалық үлесі көрсетілген ерітіндіні дайындау үшін тиісті тапсырманы мұғалімнен ал.
2. Есептің шарты бойынша қажетті тұздың массасын және судың көлемін есепте;
3. Таразыға тұзды өлшеп конусты құтыға сал;
4. Дистилденген судың қажетті көлемін ал (сұйықтықтың көлемін өлшеу ереже сін есіңе түсір) және оны конусты құтыдағы тұздың үстіне құй;
5. Конусты құтыдағы тұз ерігенше араластыр;
6. Есепті төменде берілген үлгіде жазып шығар;
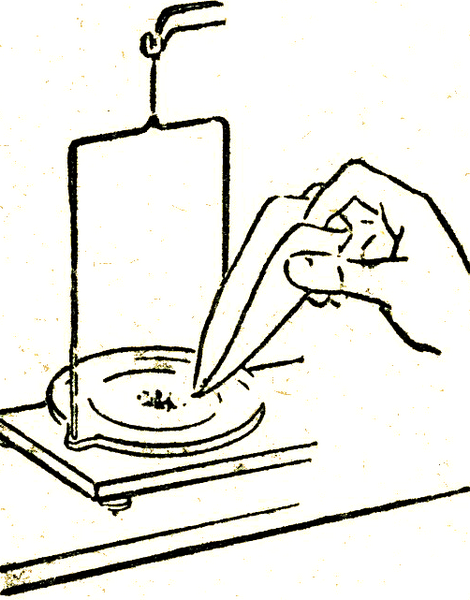
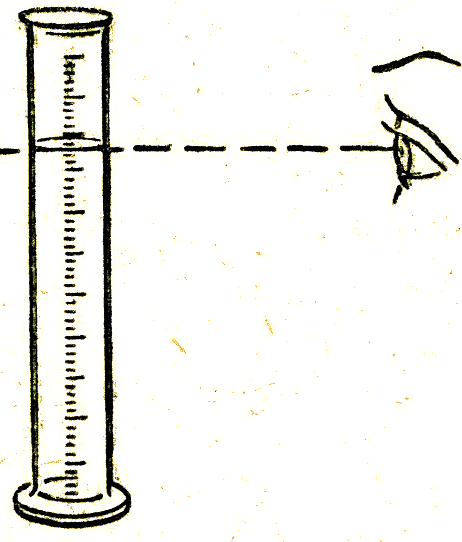
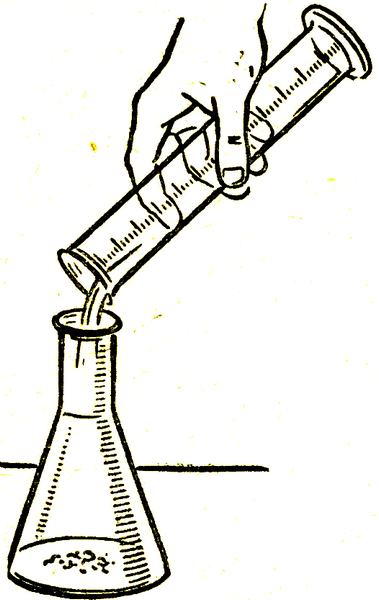
1-есеп. Массалық үлесі 5%-дық ас тұзының 50 грамм ерітіндісін дайында.
2-есеп. Массалық үлесі 5%-дық ас тұзының 25 грамм ерітіндісін дайында.
3-есеп. Массалық үлесі 10%-дық ас тұзының 10грамм ерітіндісін дайында.
Берілгені: Шешуі: ![]() ; m(су) = mерітінді·mтұз
; m(су) = mерітінді·mтұз
ω(%)= ___________________________________________________
mерітінді(г)= ___________________________________________________
_____________ ___________________________________________________
Табу керек: ___________________________________________________
_________________________________________________
Жауабы:___________
2. Мольдік концентрациясы көрсетілген тұз ерітіндісін дайындау;
1. Мольдік концентрациясы көрсетілген тұз ерітіндісін дайындау үшін тиісті тап сырманы мұғалімнен ал.
2. Заттың мольдік концентрациясы көрсетілген ерітіндіні дайындау үшін тұздың массасын және судың көлемін есепте;
3. Тұздың қажетті массасын өлше және құтыға сал;
4. Құтыға аз ғана су құй, тұзы толық ерігенше араластыр. Содан соң қажетті белгісіне дейін құтыға су құй.
5. Есепті төменде берілген үлгіде жазып шығар;
1-есеп. Мольдік концентрациясы 0,2 моль/л 50мл ас содасының ерітіндісін дайында.
2-есеп. Мольдік концентрациясы 0,5 моль/л 50мл ас содасының ерітіндісін дайында.
3-есеп. Мольдік концентрациясы 0,1 моль/л 50мл ас содасының ерітіндісін дайында.
Берілгені: Шешуі: CM = ![]() ;
; ![]() ;
; ![]()
Vер(мл)= _____________________________________________________
C(моль/л)= _____________________________________________________
_______________ _____________________________________________________
Табу керек: _____________________________________________________
mтұз(г)=? _____________________________________________________
_____________________________________________________
Жауабы:___________
Есте сақта !!!
Мольдік концентрация 1 литр ерітіндідегі еріген заттың моль санымен анықталады.
Мольдік концентрацияның өлшем бірлігі - моль/л.
Назар аудар !!!
Өлшеуіш құтының мойнында ерітіндінің нақты көлемін шектейтін дөңгелек сақина болады. Бұл жоғарыдағы белгі сұйықтың құйылатын ең жоғарғы шегін көрсетеді.
Үйге тапсырма беру: Қ
9айталау.
Сабақтың тақырыбы: Судың құрамы, физикалық және химиялық қасиеттері.
Сабақтың мақсаты: Оқушыларды судың сапалық, сандық құрамын анықтау әдістерімен, судың химиялық қасиетін қарастыра отырып, бейорганикалық қосылыстардың жаңа класы - негіздермен таныстыру. Кластар арасындағы байланыстарды мысалдармен көрсету, негіздердің, қышқылдық және негіздік оксидтердің құрамын салыстыра отырып, негізге ұқсастықтары мен айырмашылықтарын анықтау. Жаңа -гидроксид тобы, гидроксид ұғымдарын қалыптастыру.
Құрал -жабдықтар: Темір қасық, банкі, қызыл фосфор, лакумус, сіндірілмеген әк.
Тірек білім мен біліктер: Зат массасының сақталуы заңы, қосылуы және айырылу реакциялары, судың сапалық құрамы, электр тогы әсерінен судың айырылуы, сутегі алу әдістері, валенттік.
Оқушыларға судың сапалық құрамын білетінін ескере отырып, оны еске түсіру мақсатында төмендегі сұрақтар қойылады.
-
Сутегін судан алу әдістерін және олардың реакция теңдеулерін жаз.
-
Нәтижесінде су түзілетін реакция теңдеулерін жазып, қай типке жататынын ата.
Реакция теңдеулерін жазғаннан кейін судың құрамында сутегі және оттегі элементтері бар екендігіне, су осы жай заттардың қосылуы нәтижесінде түзілетіндігіне оқушылардың назарын аудара отырып, осы заттар қандай көлемдік қатынаста болатынын қарастыру қажет.
Судың химиялық қасиетін қарастырғанда оның металмен әрекетесуіне тоқталып, кальций мен судың арасында жүретін реакция көрсетіледі. Кальций мен судың реакцияласу теңдеуін жазғанда оқушыларды бейорганикалық қосылыстардың жаңа класы -негіздермен және оның құрамына кіріп, сол класты анықтайтын гидроксотопты (ОН) таныстыруға ерекше көңіл бөледі. Негіздің құрамына кіретін топтың саны металл атомынын валенттілігіне байланысты болатынын ескертіліп, жалпы [Me(OH)n] формуласын ұсынады. Мұндағы-металл атомының валенттілігіне сәкес келетін гидроксид тобының саны. Судың металдармен әрекетесу реакциясынын мәнін түсіндіргеннен кейін оның теңдеуін жаза білуге жаттықтыру үшін төмендегі тапсырманы ұсынған жөн.
Мына заттар әрекеттескенде түзілетін реакция өнімдерін жазып, атын атаңдар: а) натрий мен су; ә) барий мен су; б) кальций мен су; в) калий мен су; г) литий мен су; д) стронций мен су.
-
оксидтер дегеніміз не?
-
олардың құрамына қандай заттар кіреді?, т.б. сұрақтар беріледі. Оксидтерге мысалдар келтіріледі. Бұл берілген жауапты төмендегі кестеге жазыңдар.
Металдар оксидтері
Бейметалдар окидтері
Бұдан кейін фосфор мен кальций оксидтерінің сумен әрекеттесуі көрсетіледі. Ол үшін фосфор (V) оксидін алу үшін қызыл фосфор жағылады да, оған су құйылады. Фосфор оксиді бейметалл оксиді екеніне осы жерде көңіл аударылады. Алынған ерітіндінің ортасын анықтау үшін оқушыларға таныс күлгін лакумус ерітіндісінен ерітіндінің түсіне қарап, оқушылардан қандай зат алынған сұралады, яғни бейметалл фосфор (V) оксиді сумен әрекеттескенде қышқыл түзілетіндігі қорытылады. Реакция теңдеуді белгіленген кестені оқушылар бейметалл оксидтері мен судың арасында жүретін реакция теңдеуін жазады:
а) SO2+H2O= ә) CO2+H2O= б) N2O5+H2O=
Реакция теңдеулерін дұрыс жаза білу үшін оқушыларға мынадай нұсқаулар беріледі. Бейметалл оксидтері суме әрекеттескенде қышқыл түзіледі. Оның формуласын құрастыру үшін, ойша су мен оксидтің құрамына кіретін әрбір элементтердің атом сандары қосылады. Егер элементтердің алынған атом сандарын қысқартуға болатын болса қысқартып, одан алынған сан формуланың алдына коэфицент ретінде қойылады. Қышқылдың құрамына кіретін сутегі атомы формуланы жазғанда бірінші орында, оттегі атомы - үшінші орынды тұрады.
Мәселен: Р2О5+Н2О=Н2Р2О6=2НРО3
Жаттығу жұмыстарын жүргізіп болған соң металл оксидтерінің сумен әрекеттесілуі көрсетіледі. Бұл тәжірибе оқушыларға күнделікті тұрмыстан таныс. Сөндірілмеген әкті алып, су құйғанда, ол "қайнайды". Бұл кезде температураның жоғарылауынан судың тең жартысы буға айналады. Сондықтан әкке су құйғанда оның шашырауы, буының ыстығы шала күйдіруі мүмкін екендігі ескеріледі.
Металл оксидтері сумен әрекеттескенде гидроксид түзілетіндігі айтылып, кестенің сол жақ бөлігіне реакция теңдеуі жазылады: СаО+ Н2О→ Са(ОН)2
Бұдан соң мыс, мырыш, темір оксидтерінің сумен әрекеттеспейтіндігі көрсетіледі.
Оқушылар су өте тұрақты қосылыс болғандықтан, сутегінің бөлінуі белгілі жағдайда жүзеге асатынын қорытындылайды:
-
электр әсерінен (2H2O=2H2↑ +O2);
-
актив металдармен әрекеттескенде (2Na+2H2O=2NaOH+H2↑);
3) активтігі нашар металдармен қыздырғанда 3Ғе +4Н2О= Ғе3О4+4Н2
4) егер стронцийді суға салса оның бетінде газ көпіршіктері пайда болып, жоғары көтеріле бастайды. Егер цилиндрдің жақтауына жанған шырпыны жақындатса ол газдың тұтануы байқалады. Қай газ бөлінеді? Ерітіндіде қандай жаңа зат түзіледі? Химиялық реакцияның теңдеуін құрастырыңдар. Металл оксидтерінің сумен әрекеттесуі мысалына мындай тапсырма ұсынылады. Төмендегі теңдеуін аяқтап, түзілген заттардың атын ата және жоғарыда берілген кестенің бөлігін жаз. 1.Na2O+H2O= 2.K2O+H2O=
3.BaO+H2O= 4.MgO+H2O=
Металл және бейметалл оксидтерінің сумен өзара әрекеттесетінін анықтауда "ерігіштігі" кестесін пайдалану тиімді екенін ескере отырып, оқушыларға онымен жұмыс істеуді ұсынған жөн. Ол үшін кестеден суда еритін негіздер мен қышқылдардың үш -төртеуін мысалға алып, оларға сәкес оксидтердің формуласын жазу немесе қышқыл мен негіздің сәйкес оксидтерден түзілуінің реакциясын жазу тапсырылады
Үйге тапсырма беру: §40,41,42. 107б - 4,5жаттығу,109б - 3жаттығу,
№8-9 сабақтардың тақырыбы: Негіздердің құрамы және жіктелуі. Негіздердің химиялық қасиеттері және қолданылуы.
Сабақтың мақсаты: Негіздердің құрамымен және олардың жіктелуін таныстыру. Негіздердің формуласын құрастыру, индикаторлардың көмегімен анықтай білу біліктерін жетілдіру. Сілтілер ұғымын қалыптастыру. Негіздер мен сілтілердің қасиеттерін айыра білуге үйрету. Бейметал окидтерінің сілтілермен әрекеттесуін демонстрациялап, оның реакция теңдеуін құруға, түзілген тұздардың құрамын дұрыс анықтай білуге үйрету. Қыздырғанда мыс (ІІ) гидроксидінің айырылуы тәжірибе жүзінде таныстырып, ерімейтін негіздердің айырылу реакциясы теңдеулерін құра білуге үйрету.
Құрал -жабдықтар: Сілтілер,индикаторлар.т.б
Тірек білім мен біліктер: Заттардың құрамы туралы білімі және олардың жіктеу білігі, индикаторлардың әсерін бақылау білігі, негіздердің құрамы, химиялық формуласы, валенттік бойынша формула құрастыру білігі.
Сабақ барысы: Оқушыларға металл валенттілігі бойынша негіздерінің формуласын құрастыру тапсырылады. Nа, К, Са, Ғе(ІІІ),Сu
Бұдан оқушылар " Негіз дегеніміз әрбір металл атомы бір немесе бірнеше гидроксотоп пен байланысқан күрделі зат " деген қорытындыға келеді.
Негіздердің қасиеттерімен оқушыларды зертханалық тәжірибелерді жасау барысында таныстыруға болады. Зертханалық жұмысты жасап оқулықтағы үлгі бойынша кесте толтырылғаннан кейін оқушыларға төмендегі қорытындылау сұрақтары беріледі.
-
Негіздерді қандай белгілері бойынша екі топқа бөлуге болады?
-
Еритін және ерімейтін негіздерге төмендегі жоспар бойынша салыстырмалы сипаттама беріңдер:
а) формулалары; ә) сыртқы түрлері; б) судың әсері; в) индикатордың әсері;
г) қыздырудың әсері.
Ұқсас қасиеттерін бөліп жазыңдар. Сұраққа қайтарылған жауапты сыныпта талдап, жетпеген жерлерін мұғалім толтырады. Бұл жерде мұғалім суда ерімейтін негіздердің тағы бір ерекшелігін ескертеді. Ол -тиісті металл оксидіне су қосқанмен суда ерімейтін гидроксидттер алынбайтындығы. Мұнда олардың алу жолына тоқталу қажет емес. Өтілген материалды бір жүйеге келтіру үшін қорытынды бөлімде мынадай кестені толтыруды ұйымдастырған жөн.
Негіздер
Негіздердің әсері
Сілтілер
Ерімейтін
Суға
Лакмусқа
Фенолфталинге
қыздыруға
Ериді
ерімейді
Ерітіндінің түсі көгереді
өзгермейді
Ерітінді қызыл түске боялады
өзгермейді
ажырамайды
ажырамайды
Химиялық қасиеттерімен таныстыру.
Сабақты пысықтау мақсатында берілетін сұрақтар мен жаттығулар:
1. Негіздер қандай екі топқа бөлінеді? Олардың ұқсастығы мен айырмашылығы.
2. Мыс (ІІ) гидроксиді мен темір (ІІІ) гидроксидін алуға болатын реакция теңдеуін жазыңдар.
3. Еритін негіздер мен ерімейтін негіздер сумен қалай әрекеттеседі?
4. Ерімейтін негіздерді қыздырғанда не байқалады?
5. Төмендегі қышқылдар мен негіздердің өзара әрекеттесу реакция тендеулерін жазып оған қатысатын барлық заттардың аттарың атандар?
а) NaOH және H2SO4; ә) Си (ОН)2 және НСІ;
б) Са(ОН)2 және H2SO4; в) Ғе (ОН)3; және НNO3.
Жаттығулар:1.Бейметалл оксидтеріне сәйкес қышқылдарды ескере отырып, бей металл оксидтері мен негіздердің өзара реакцияласу теңдеулерін құрастырыңдар.
а) SO2+ NaOH→ б) Р2О5+КОН→
ә) SO3+Са/ОН/2 → в) SO2+Ва/ОН/2→
-
Натрий гидроксиді төмендегі оксидтердің қайсысымен әрекеттесетінін анықтаңдар. Сәйкес реакция теңдеулерін жазып, түзілген түзілген тұздарды атаңдар: СаО, Р2О5, АІ2О3, SO2, СиО.
Үйге тапсырма беру: §42,(1-6),§43,(1-13).
№8-9 сабақтардың тақырыбы: Бейтараптану реакциясы.Сілтілермен жұмыс істегендегі сақтық шаралары.
Сабақтың мақсаты. Бейтараптану реакциясы туралы түсінік беру, оның реакция теңдеуін құрастыру білігін қалыптастыру.
Құрал -жабдықтар. Кәрден табақша, тамызғыш, шыны таяқша, пробиркалар, стақан, спиртшам, шыны пластинка, бюретка.
Тірек білім мен біліктер. Химиялық және физикалық құбылыстарының байланысы, қышқылдар мен негіздердің құрамы және қасиеттері, химиялық реакциялардың жүру белгілері, алмасу реакциялары, әр түрлі ерітінділердегі индикатордың түсі.
Оқушылардың өткен сабақта алған біліміне сүйене отырып мына сұрақтар талданады. 1.Қышқылдар мен негіздердің қасиеттерін салыстырыңдар. 2. Алмасу реакциялары дегеніміз не? 3.Алмасу реакцияларына қатысын заттардың қасиеттері қандай? 4.Ерітіндінің сілті не қышқыл екені қалай анықталады? 5. Реакциялардың жүру белгілерін атаңдар.
Қышқылдар мен негіздердің құрамын, қасиеттерінің қарама -қарсы белгілерін тандағаннан кейін бейтараптану реакциясымен таныстыруға кіріскен жөн. Көрнекі көрсету, ерітіндіге лакмус тамызу арқылы сілті екендігі анықталғаннан кейін, оған бюреткадан қышқыл ерітінісі аз -аздан құйылады. Лакмус көк түстен күлгін түске ауысқан кезде құю тоқтатылады.
Оқушыларға пробирканың сыртынан саусаққа жылу білетіндігі, яғни реакция жүретіндігі көрсатіледі. Алынған сілті ерітіндісіне қышқыл тамызғаннан кейін лакмус түсінің қайта күлгін түске ауысуынын мәні түсіріледі, яғни ерітіндіде не қышқыл, не сілті болмау реакцияс жүретіндігінің белгісі. Сонымен қатар бұл жағдайда химиялық реакция қасиеті жағынан қарама -қарсы күрделі заттардан арасында жүргені қорытыналады. Мұнан соң бейтараптану реакциясының жалпы белгісіне жылу бөліну ғана емес, сонымен қатар су бөліну де жататындығы айтылады, оның мәні негіз құрамындағы гидросотоп қышқылының сутегі сутегі атомына қосылып, су түзілетіндігі. Ал жеке белгісіне тұз түзілу жататындығы айтылып, ерітіндіні суалту арқылы натрий хлориді алынады. Реакция теңдеуі жазылғаннан кейін, бұл реакцияның алмасу реакциясымен қандай ұқсастығы бар екеніндігі талданады.
Бейтараптану реакциясына қасиеттері қарама -қарсы заттар қатынасатындықтан, оның көмегімен белгісіз затты анықтауға болатындығы ескеріліп, осыған орай оның қолдануына мысалдар келтірген жөн.
Сонымен қатар ерімейтін негіздердің қышқылдармен әрекеттесуі нәтижесінде тұз және су түзіліп, бейтараптану реакциясы жүретіндігі демонстрацияланады. Осы реакцияның нәтижесінде түзілген заттарға қарап және алдыңғы аталған белгілер ортақ болғандықтан да сілтілер мен ерімейтін негіздердің бір класқа жататындығы туралы қорытынды жасалады.
Оқушылардың бейтараптану реакциясы туралы білімінің пысықтау мақсатында 10 зертханалық тәжірибелерді жасау ұйымдастырылады. Тәжірибелер жасалып болған соң реакция теңдеулері дұрыс құрастыра білуге жаттықтыру қажет.
Үйге тапсырма беру: §39-43 қайталау. Бақылауға дайындалу.
5-тақырып.
Сыныбы: 8 сынып
Күні:
5-тарау. Бейорганикалық қосылыстардың маңызды кластары.
Сабақ тақырыбы: Оксидтердің жіктелуі,аталулары мен алу жолдары.
Оқыту мақсаты: Оксидтер жайлы алған білімдерін еске түсіру арқылы жіктелуін, аталуын,кейбір оксидтердің алу жолдарын қорытындылау.
Реактивтер мен құралдар: Темір(ІІІ)оксиді,сутек оксиді,магний оксиді, фосфор(V) оксиді,хром(ІІІ)оксиді,мырыш оксиді,кальций оксиді,мыс(ІІ)оксиді,т.б.
Көрсетілім: Оксидтердің үлгілерімен танысу.
Сабақ барысы: Ұйымдастыру кезеңі.
Жаңа сабақ: Бейорганикалық заттардың жіктелуін еске түсіру. Оқушылар бейорга- никалық заттардың жіктелу кестесін бұрын алған біліміне сүйене отырып жасайды. Ол келесі сабақта толықтырылып, жалғасын табады.
Бейорганикалық заттар
Жай зат Күрделі зат
Металл Бейметалл Оксид Қышқыл Негіз Тұз
Негіздік Екідайлы Қышқылдық
Жай және күрделі заттардың ережесін еске түсіреді. Күрделі заттардың негізгі кластарының ережелері сұралады. Содан кейін оксидтерді жіктеуді жалғастырады. Негіздік, екідайлы, қышқылдық болып бөлінеді, оларға мысалдар келтіру. Оксидтердің құрылымдық формулалары жазылып көрсетіледі.Оқулықпен жұмыс істеу арқылы жаңа тақырыптағы мазмұнды білу. Оксидтердің алынуы тірек-сызба арқылы түсіндіріледі.
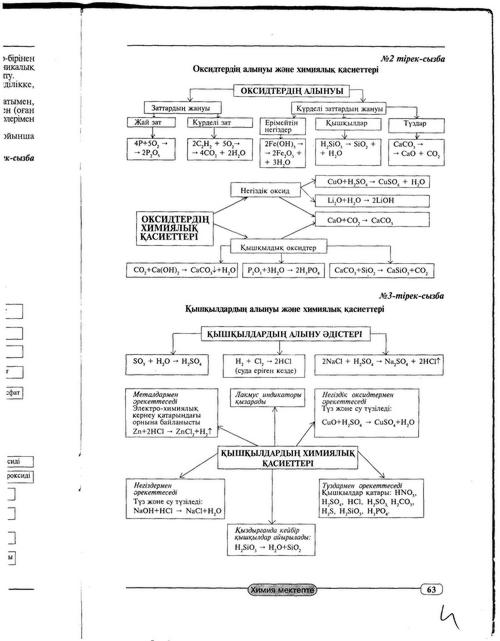
Оқушыларға қысқа мерзімдік өзіндік жұмыстарын ұсыну:
1-нұсқа. Есептер мен жаттығулар жинағы(71-72бет), 4-2, 4-4, 4-17.
2-нұсқа. Есептер мен жаттығулар жинағы(71-72бет), 4-3, 4-5, 4-18.
Өздік жұмысты талдай отырып, түсіндірілген тақырыпты толық бекіту үшін оқушыларға сұрақтар қойылады және тапсырмалар беріледі:
-
Оксидтер деп нені айтады?
-
Негіздік және қышқылдық оксидтердің ұқсастығы мен айырмашылығын айтып беріңдер?
-
Суда еритін және ерімейтін оксидті атаңдар?
-
Күкірт(IV)оксиді,калий оксиді,темір(ІІІ)оксидтеріне сәйкес келетін гидроксидтердің формуласын жазыңдар?
Есептер мен жаттығулар жинағынан орындау (71-72бет):
4-1. Формулалары келтірілген заттардың ішінен: KOH,H2S,H2O,CO2,AICI3,AI2O3,FeO, ,,,,,,,,,Fe2O3 тек қана оксидтердің формулаларын теріп жазыңдар.
4-19. Мына қосылыстар:BaO,CuO,AI2O3,FeO,SO3,SO2,ZnO,P2O5,K2O,SrO оксидтердің қай түріне жатады. Төмендегі үлгі бойынша жіктеп,тұстарына аттарын жазыңдар.
Негіздік оксид
Екідайлы оксид
Қышқылдық оксид
Оқытудың жоспарланған нәтижесі: Оқушылар оксидтердің жіктелуі,аталуы мен алу жолдарын жоспарлы түрде айтып бере білуі керек. Суда еритін және ерімейтін оксидтерге мысалдар келтіре отырып, екідайлы оксидтердің ерекше қасиеттерін айта білу.
Үйге тапсырма: §44 (1-2). Есептер жинағынан 4-10,4-11, Жұмыс дәптері.
Сыныбы: 8 сынып
Күні:
№2-шы сабақ тақырыбы: Негіздік, екідайлы және қышқылдық оксидтердің химиялық қасиеттері және қолданылуы.
Оқытудың мақсаты: Негіздік, екідайлы, қышқылдық оксидтердің химиялық қасиеттері туралы білімді жүйелеп дамыту.
Реактивтер мен құралдар: Кальций оксиді, фосфор(V)оксиді,мырыш оксиді,су,стақан, сынауықтар,сынауық тұрғы,индикаторлар,қышқыл,сілті ерітінділері.
Көрсетілім: Кальций және фосфор(V)оксидтерінің суда еруі. Мырыш
оксидінің қышқыл және сілті ерітінділерімен әрекеттесуі.
Сабақ барысы: Ұйымдастыру кезеңі.
Білім мен біліктерін тексеру: Оксидтердің жіктелуі бойынша сұрақ қойып мысалдар келтіру. 1. Оксидтер неше топқа жіктеледі?
-
Негіздік, екідайлы, қышқылдық оксидтерге мысалдар келтіріңдер.
Оксидтер
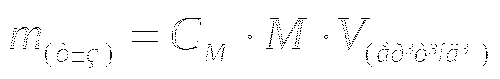



Металл оксидтері айнымалы металл оксидтері бейметал оксидтері
Na2O,MgO,CaO,BaO,CuO AI2O3,ZnO,Cr2O3,BeO, CrO3,Mn2O7,SO3,P2O5,CO2
Негіздік оксидтер Екідайлы оксидтер Қышқылдық оксидтер
Тақтаға сабақ тақырыбы жазылады.Оқушыларға эксперименттік есептерді орындауды ұсынады. 1. Кальций оксиді - негіздік оксид екенін қалай дәлелдеуге болады?
Бір оқушыны тәжірибе жасайтын столға шақырамын. Ол кальций оксидін суда ерітіп, түзілген сілтіні индикатормен анықтайды. Екінші оқушы кальций оксидін лакмуспен боялған тұз қышқылында ерітеді. Содан кейін олар реакция теңдеулерін жазады.
2. Фосфор(V)оксиді - қышқылдық оксид екенін қалай дәлелдеуге болады?
Эксперименттік тәжірибені мұғалім орындайды. Фосфор(V)оксидін суда ерітіп, түзілген қышқыл ерітіндісін индикатормен анықтайды. Фосфор(V)оксидін сілтімен әрекеттестіреді. Ал оқушылар реакция теңдеулерін жазады. Негіздік және қышқылдық оксидтермен қатар екідайлы қасиет көрсететін оксидтерді де қарастыру. Мұндай оксидтер қышқылдармен де,негіздермен де реакцияға түсе алады, демек екідайлы қасиет көрсетеді. Тәжірибе көрсетіледі,теңдеулері жазылады:
ZnO + H2SO4 = ZnSO4 + H2O; ZnO + NaOH = Na2ZnO2 + H2O
Оқушыларды қатыстыра отырып, тірек - сызба таблицасы арқылы оксидтердің химиялық қасиеттері түсіндіріледі.

Өтілген тақырыпты бекіту:
1-тапсырма: Берілген формулалар:NaCI,SO2,CO2,H2O,HCI,H2SO4,KOH. Осылардың қайсысы кальций оксидімен әрекеттеседі. Тиісті реакция теңдеулерін жазыңдар.
2-тапсырма: Берілген формулалар:H2O,BaO,SiO2,BaCI2,Ca(OH)2,Na,H2SO4. Осылардың қайсысы көміртек(IV) оксидімен әрекеттеседі. Тиісті реакция теңдеулерін жазыңдар.
Оқытудың жоспарланған қасиеті: Суда еритін және ерімейтін оксидтерге мысалдар келтіре отырып, екідайлы оксидтердің ерекше қасиеттерін тәжірибе қорытындысы бойынша түсіндіріп беруі қажет.
Үйге тапсырма: §45(1-10). Жұмыс дәптері.
Сыныбы: 8 сынып
Күні:
№3 -шы сабақ тақырыбы: Негіздердің жіктелуі, аталуы, алынуы мен химиялық қасиеттері.
Оқыту мақсаты: Судың химиялық қасиеттерін еске түсіру арқылы негіздердің ережесі.
Химиялық қасиеттерді оқып-үйренуді жалғастыру. Екідайлы қасиетті элементтер туралы мағлұмат беру. Заттарды бір-бірімен салыстырып, олардың ерекше қасиеттері
мен ортақ қасиеттерін ажырата білу, заттың құрамы мен құрылысы жайлы білімді дамыту. Негіздер класына жататын заттардың ортақ химиялық қасиеттері және ұқсастығы мен айырмашылығын құрамына қарап ажырату.
Реактивтер мен құралдар: Темір(ІІ), мыс(ІІ) және мырыштың ерігіш тұздары, мыс(ІІ) гидроксиді, сілтілер,қышқылдар,спирт шамы,сіріңке.
Лабораториялық тәжірибе: Ерімейтін негізді қыздырып айыру. Мырыш гидроксидінің әрі қышқыл,әрі негізбен әрекеттесу тәжірибесін жасау.
Сабақ барысы: Ұйымдастыру кезеңі.
Тірек білім мен біліктер: Оксид,қышқыл,тұз,қышқылдық оксид,негіздік оксид, бейта- раптану реакциясы,жай және күрделі заттар,металл,бейметалл,екідайлы оксид, индика- торлар. Кесте толтыру,химиялық тілді жаттықтыру,өз бетімен жұмыс істеу.
Кесте толтыру: Бейорганикалық заттар
Жай заттар
Күрделі заттар
элементтер
оксидтер
қышқылдар
негіздер
тұздар
металл
бейметалл
екідайлы
Негіз
дік
Қыш
қыл
дық
Екі
дай лы
оттекті
оттексіз
сілті
негіз
екідайлы
Білім мен біліктерін тексеру: Оқушыларға жалпы негіздер, олардың құрамы,түрлері туралы түсініктер белгілі. Өткен сабақтар бойынша негізгі түсініктерді оқушылар қалай қабылдағанын фронтальді түрде сұрау арқылы төмендегі сұрақтарды қою:
- Оксидтер,қышқылдар,негіздер және тұздар дегеніміз не?
- Негіздер мен тұздардың құрамдарын салыстыра отырып, қандай ұқсастықтары мен ,,,айырмашылықтары бар екендігін анықтаңдар?
- Қышқылдық,негіздік оксид дегеніміз не?
- Суда еритін қандай негіздерді білесіңдер? Олар қалай аталады?(ерігіштік кестесі)
- Химиялық қасиеттеріне байланысты негіздік оксидтердің, қышқылдық оксидтерден ,,қандай айырмашылығы бар?
Жаңа сабақ: Оқушыларға жаңа сабақтың мақсатын таныстыру. Тірек - сызба арқылы негіздердің алыну әдістері мен химиялық қасиеттері түсіндіріледі. Сілтілермен қышқылдық оксидтердің әрекеттесуі, суда ерімейтін негіздердің қыздырғанда айырылуы, екідайлы гидроксидтің екі жақты қасиеті жайлы мәліметтер беріледі. Түсіндірілген тақырыпты толық бекіту үшін оқушылар лабораториялық тәжірибені орындайды, соңынан сұрақтар қойылады:
Суда ерімейтін негіздердің қыздырғанда айырылуы және екідайлы гидроксид жайлы тәжірибе жасалып, тиісті реакция теңдеулері жазылады.
-
Лакмус,фенолфталеин,метилоранж индикаторларының сілтілерге әсері қандай?
-
Суда еритін және ерімейтін негіздерге тән химиялық қасиеттерінде қандай ұқсастық пен айырмашылық бар?
-
Екідайлы гидроксидтер қандай қосылыстармен әрекеттеседі?
-
Бейтараптану реакциясы дегеніміз не?
Дамытудың жоспарланған нәтижесі: Негіздер мен тұздардың құрамын салыстырып сипаттау.
Үйге тапсырма: §45,(1-10), §46. Жұмыс дәптері.
Сыныбы: 8 сынып
Күні:
№4-інші сабақ тақырыбы: Қышқылдардың, жіктелуі алынуы, химиялық қасиеттері мен қолданылуы
Оқыту мақсаты: : Оқушылардың қышқылдар жайлы алған білімдерін еске түсіру арқылы жіктелуін, алу жолдарын қорытындылау және олардың жалпы химиялық қасиеттері жайлы меңгерген білімдерін жүйелеу.
Реактивтер мен құралдар: Темір, алюминий, мырыш, мыс түйірлері, мыс оксиді,күкірт немесе тұз қышқылы, натрий карбонаты,сынауық,лабораториялық тұрғы,спирт шамы,сіріңке.
Лабораториялық тәжірибе: Қышқылдардың металдармен әрекеттесуі.
Көрнекі тәжірибелер: Индикаторларға әсері,металдарға қатысы,негіздік оксидпен әрекеттесуі,натрий карбонатымен әрекеттесуі,бейтараптану реакциясы. Тірек-сызба.
Сабақ барысы: Ұйымдастыру кезеңі.
Білім мен біліктерін тексеру:Үй тапсырмасын және бұрын алған білімді дамыту мақсатында тексеру жұмыстарының үлгісін ұсынамыз. Тақтаға үш оқушы шақырылады.
1. Негіздік оксидтерге тән қандай химиялық қасиеттерді білесің? Әрбір қасиетін дәлелдейтін реакция теңдеулеріне мысал келтіріп жаз.
2. Қышқылдық оксидтерге тән қандай химиялық қасиеттерді білесің? Әрбір қасиетін дәлелдей- тін реакция теңдеулеріне мысал келтіріп жаз.
3. Ақ түсті ұнтақ - оксид берілген. Іс жүзінде оның қышқылдық немесе негіздік оксид екенін қалай дәлелдеуге болады? Тиісті теңдеулерін жаз.
Сыныпта отырған оқушыларға жалпылама тапсырма беріледі:
1-нұсқа.1. Мына қосылыстардың:калий, көміртек(IV), кальций, күкірт(VI)оксидтерінің сумен әрекеттесу реакция теңдеулері жаз.
2. Төмендегі айналуларды іске асыруға болатын тиісті реакция теңдеулерін жаз:
K2SO3
↑
S → SO2 → H2SO3
2-нұсқа. 1. Күкірт(IV)оксидінің натрий гидроксидімен, фосфор(V)оксидінің кальций гидроксидімен реакция теңдеулері жаз.
2. Төмендегі айналуларды іске асыруға болатын тиісті реакция теңдеулерін жаз:
KNO3 → K2O → KOH
Жаңа сабақ: Оқушылардың тақтада жауаптарын талдаймыз,содан кейін тақырыпты жазып, әңгіме жүргіземіз:
1. Көміртек(IV),күкірт(VI),фосфор(V) оксидтеріне қандай қышқылдар сәйкес келеді?
2. Қышқылдар құрамында қандай ұқсастық бар?
3. Тұз қышқылы мен азот қышқылының құрамындағы айырмашылық қандай?
4.Қышқылдардың негіздігі қалай анықталады?
5.Қышқылдарды қандай белгілеріне қарап топтауға болады?
Оқушылар қышқылдарды жіктеу сызба-нұсқасын өзбеттерімен толтырады.
 бір негізді екі негізді үш негізді
бір негізді екі негізді үш негізді
оттекті оттексіз оттекті оттексіз оттекті оттексіз
Оқушыларға қышқылдардың химиялық қасиеттері бойынша көрнекі тәжірибелер көрсе- тіледі және тірек-сызба бойынша қасиеттері мен алынуы түсіндіріледі.
Түсіндірілген тақырыпты толық бекіту үшін оқушылар лабораториялық тәжірибені орындайды, қорытындысын жазады, соңынан сұрақтар қойылады:
-
Бейтараптану реакциясы дегеніміз не?
-
Хлорсутек пен натрий гидроксидін іс жүзінде қалай бейтараптауға болады? Реакция теңдеуін құру.
-
Егер магний, мыс(ІІ) оксиді, калий гидроксиді, күкірт қышқылы,фенолфталейн берілсе, қышқылдарға тән қандай реакцияларды жүргізуге болады.Сол теңдеулерді жаз.
Оқытудың жоспарланған нәтижесі. Оқушылар оттекті және оттексіз қышқылдарды өзара салыстырып,ұқсастығы мен айырмашылығын танып біледі.
Дамытудың жоспарланған нәтижесі. Оқушыларметал мен қышқыл,карбонат пен қышқыл т.б. арасындағы реакцияның жүру себебін өз түсінігімен дәлелдеп бере білуі керек.
Үйге тапсырма: §47(1-11). Жұмыс дәптері.
Сыныбы: 8 сынып
Күні:
Сабақ тақырыбы: Тұздардың жіктелуі мен алынуы. Химиялық қасиеттері мен қолданылуы.
Оқыту мақсаты: Тұздар жайлы алған білімдерін одан әрі қарай дамытып,олардың аталуы мен жіктелуін, суда еритін,ерімейтін тұздар жайлы толық мағлұмат алуды іске асырады. Тұздардың формуласын, реакция теңдеулерін жазу дағдысын түсіндіру.
Реактивтер мен құралдар: CaCI2,Na2CO3,H2SO4,BaCI2,Ca(OH)2,AgNO3.CuSO4, NaOH, Zn, Cu,Hg(NO3)2,т.б,шыны түтік,сынауықтар,сынауық қысқыш,спирт шам,сіріңке.
Көрнекі тәжірибелер: Тұздардың алынуы,химиялық қасиеттері.
Сабақ барысы: 1. Ұйымдастыру кезеңі.
Білім мен біліктерін тексеру: Оқушылардың бұрын алған білімін ескере отырып, төменде көрсетілген қысқа мерзімдік өзіндік жұмысты орындауды ұсынамын:
4-119. Төменде формулалары берілген қосылыстардың ішінен тұздарды теріп жазыңдар: Fe2O3,Na2SO4,LiOH,KCI,H2CO3,KCIO3,Cu(OH)2,MgCI2,FeS,P2O5,KMnO4.
4-120. Төменде кейбір тұздардың тұрмыста, медицинада,ауыл шаруашылығында, өнеркәсіпте жиі қолданылатын жабайы атаулары берілген:ас тұзыNaCI,ас содасы NaHCO3 бор, мрамор, әктас CaCO3, мүсәтір NH4CI, ляпис AgNO3, сыр HgS, магнезит MgCO3, магнезия MgSO4, фосфорит Ca3(PO4)2, сақар K2CO3. Осы тұздарды халықаралық атаулар жүйесі бойынша атаңдар.
4-139. Мына тұздардың: кальций карбонаты,мыс(ІІ) сульфаты, сынап(ІІ) фториді, калий сульфиді, қорғасын(ІІ)иодиді, темір(ІІІ)хлориді формулаларын жаз. Ерігіштік кестесін пайдаланып,бұл тұздардың суда ерігіштігін анықта.
Жаңа сабақ: Оқушылардың тақтада жауаптарын талдаймыз,содан кейін тақырыпты жазып, тұздардың жіктелуі мен алынуы және химиялық қасиеттері мен қолданылуы
туралы әңгімелеу. Химиялық қасиеттеріне байланысты көрнекі тәжірибелерді көрсету.
Түсіндірілген тақырыпты толық бекіту үшін оқушыларға есептер мен жаттығулар жинағынан тапсырмалар беріледі соңынан сұрақтар қойылады:
4-121. Формулалары келтірілген тұздарды: NaNO2,K2S,KHS,CuSO4,Na2HPO4,NaH2PO4, K3PO4,MgOHCI,CaCO3,NaHCO3,AI(OH)CI2,AgNO3,FeCI3,FeSO4 берілген кестеге бөліп жаз:
Орта тұз
Қышқыл тұз
Негіздік тұз
4-128. Нәтижесінде мына тұздар: а)калий хлориді; ә)кальций нитраты түзілетін бейтараптану реакцияларының теңдеулерін жаз.
4-138. Мына тұздардың: темір(ІІ)сульфаты,мырыш нитраты,алюминий фосфаты, күміс хлориді,барий сульфаты формулаларын жаз. Ерігіштік кестесін пайдаланып,бұл тұздардың суда ерігіштігін анықта.
4-144. Келтірілген сызба нұсқалардың ішінен жүзеге асатын реакциялардың теңдеулерін жазыңдар:
1) ZnSO4 + Pb →
2) BaCI2 + Na2SO4 →
3) CuSO4 + NaOH →
4) Na2SO4 + HCI →
Уақыт жеткен жағдайда оқулықтан 131 беттегі 8 жаттығуларды орындау:
а) C → CO2 → Na2CO3 → CO2 → CaCO3
ә) Сu → CuO → CuCI2 → Cu(OH)2 → CuO → Cu
Оқытудың жоспарланған нәтижесі: Оқушылар ерігіштік кестесін пайдаланып, суда еритін тұздардың формуласын құрастырып, металл атомының валенттігі мен қышқыл қалдығының валенттігі арқылы тұздарды жіктей отырып, аттарын атауды үйрену.
Үйге тапсырма: §48(1-7). Жұмыс дәптері.
Күні: Сыныбы:
Сабақ тақырыбы: Бейорганикалық қосылыстар арасындағы генетикалық байланыстар.
Сабақтың мақсаты: Негізгі бейорганикалық қосылыстар жайындағы білімді жүйелеу. Классаралық генетикалық байланысты оқушыларға түсіндіру.
Сабақтың барысы: Ұйымдастыру кезеңі
Білім мен біліктерін тексеру: Бұрын алған білімді дамыту мақсатында
-
Қандай оксидтер тобын білесің?
-
Қышқылдық және негіздік оксидтерге қандай оксидтер жатады?
-
Барлық қышқылдық оксидтердің ортақ химиялық қасиеттері қандай?
-
Барлық негіздік оксидтердің ортақ химиялық қасиеттері қандай?
-
Әкті су арқылы көбірек ауа өткізгенде ерітінді не себептен лайланады?Тиісті реакция теңдеуін жаз
-
Қара түсті-оксид берілген. Ол оксидтердің қай тобына жататынын анықта?
-
Күкірт қышқылын пайдаланып, мырыш сульфатын қалай алуға болады?
-
Тиісті металдың оксидінен сілтіні қалай алуға болады? Мысал келтір.
Жаңа сабақ: Заттарды класқа - оксидтер,негіздер,қышқылдар,тұздар деп бөлдік. Әр- қайсысына тән қасиетті қарастыру арқылы олардың арасындағы генетикалық байла- нысты түсінуге мүмкіндік туады.Оқушыларға металдар мен бейметалдардың генети- калық қатарының өзара байланысы туралы мәліметтерді естеріне түсіремін.
Г

 енетикалық қатарлардың өзара байланысы: Металл Жай жат Бейметалл
енетикалық қатарлардың өзара байланысы: Металл Жай жат Бейметалл
1 . Ca → CaO → Ca(OH)2
. Ca → CaO → Ca(OH)2
 Ca3(PO4)3 Негіздік Қышқылдық
Ca3(PO4)3 Негіздік Қышқылдық
2
 . P → P2O5 → H3PO4 оксид Тұз оксид
. P → P2O5 → H3PO4 оксид Тұз оксид
 Негіз Қышқыл
Негіз Қышқыл
,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,
Бұл сызба-нұсқаға қарап,оқушылар металл мен бейметалдың генетикалық қатары тұз түзілумен аяқталатындығы туралы қорытындыға келеді. Заттарды жіктеуде судың алатын орны туралы сұрақты талқылауға болады. Судың негіздік және қышқылдық оксидтермен әрекеттесіп, нәтижесінде негіз және қышқыл түзетіні белгілі. Оқушыларға сұрақтар қойылады:
1. Судың өзі қандай қасиет көрсетеді?
2. Суды қандай класқа жатқызуға болады?
( Оқушылар заттарды жіктеудің негізгі белгілерін естеріне түсіріп,судың екідайлы оксидке жатқызуға болатындығы туралы қорытындыға келеді.)
Биологияда өсімдіктер мен жануарларды туысқа,түрге бөліп жіктегені сияқты, химияда да заттарды жіктеу арқылы олардың да өздеріне тән қасиеттеріне сәйкес бірігіп, бір тұтас топ түзетінін байқадық. Бұл табиғаттың тұтастығын дәлелдейтін заңдылық.
Түсіндірілген тақырыпты толық бекіту: Бейорганикалық қосылыстардың маңызды кластары бойынша оқулықты пайдаланып, оқушыларға өздік тапсырма беремін:
4-жаттығу. 131бет.Берілгені:O2,H2O,Na,KOH,CuO,NaOH,Na2SO4,SO3,HCI,Na2O,CuSO4.
Осылардың ішінен генетикалық өзара байланысы бар заттарды тауып, өзара айналула- рын реакция теңдеулерін жазу арқылы дәлелдеңдер.
5-жаттығу. Төмендегі айналуларды іске асыруға болатын тиісті реакция теңдеулерін жаз: а) Cu → CuO → CuCI2→Cu(OH)2 → CuO → CuSO4
ә) AICI3 → AI(OH)3 → AI2O3 → AI2(SO4)3 → AI(OH)3 → AI(OH)2CI
Есептер мен жаттығулар жинағынан берілетін тапсырмалар.
4-156. Төмендегі сызба нұсқалардағы белгісіз заттарды тауып,айналуларды жүзеге асыруға мүмкіндік беретін химиялық реакция теңдеулерін жазыңдар:
1) Na → X → Na2SO4 →Ba2SO444
2) H2S → X → SO2 → У → H2SO4 → MgSO4
Үйге тапсырма: §49(5-9). Жұмыс дәптері.
Күні: Сыныбы;
Сабақ тақырыбы: №7- практикалық жұмыс.
Бейорганикалық қосылыстардың негізгі кластарын қорытындылау тақырыбына эксперименттік есептер.
Оқыту мақсаты. Оксидтер,негіздер,қышқылдар,тұздар жайлы алған білімді бір жүйеге келтіру және оқушылардың дағдысын, біліктілігін, тірек білімін химиялық эксперимент арқылы қалыптастыру.
Құралдар мен реактивтер: Магний, темір, кальций, магний оксиді, темір (ІІІ) гидроксиді, тұз, күкірт, азот қышқылы ерітінділері, индикаторлар, тұрғылар, сынауықтар, қстағыштар, химиялық стақандар, ыдыстар.
Ескерту. Қышқылмен, сілтімен жұмыс істегенде қауіпсіздік техникасы ережесін қатаң сақтау қажет.
1 - есеп Кальций оксидінен кальций гидроксидін; мыс (ІІ) оксидінен мыс (ІІ) гидроксидін алыңдар.
2 - есеп. Үстелде берілген заттарды пайдаланып, кальций карбонатын алып, оны қоспа дан тазартуды іске асырыңдар;өзгерістерді тәжірибе жүзінде іске асырып, реакция теңдеулерін жазыңдар: FeCI3 → Fe(OH)3 → Fe2 (SO4)3
3 - есеп. Тәжірибе арқылы: а) мыстан; ә) мыс (ІІ) гидроксидінен, мыс (ІІ) оксидін алып, оның негіздік оксид екенін дәлелдеңдер.
4 - есеп. Үстелде берілген:PbO, Pb(OH)2, H2SO4 реактивтерді пайдаланып, қорғасын сульфатын алыңдар және оны қоспадан тазартыңдар.
5 - есеп. Мыс (ІІ) гидроксиді, тұз қышқылы берілген. Мыс (ІІ) оксидін және мыс (ІІ) хлоридін алыңдар.
6 - есеп. Үстелде бар Mg, MgO, H2SO4 реактивтерді пайдаланып, екі әдіспен магний сульфатын алыңдар.
7 - есеп. Үстелде бар темір, темір (ІІІ) оксиді, тұз қышқылы, күкірт қышқылдарын пайдаланып, темір (ІІ) және темір (ІІІ) тұздарын алыңдар.
8 - есеп. Берілген үш сынауықта: а) күйдіргіш натр, күкірт қышқылы, су. Қай сынауық- та қандай зат бар екенін анықтаңдар; ә) үстелден мыс (ІІ) оксидін тауып, оның негіздік оксидке жататынын дәлелдеңдер.
9 - есеп. Берілген үш сынауықтағы заттар: әк суы, күйдіргіш калий және тұз қышқылы. Әрқайсысын өзіне тән реакция көмегімен анықтаңдар.
10 - есеп. Екі оксид: P2O5 және CaO берілген. Бірншісі - негіздік, екіншісі - қышқылдық оксид екенін дәлелдеңдер.
11 - есеп. Ерімейтін оксид СuО негіздік оксид екенін, СО2 қышқылдық оксид екенін қалай дәлелдуге болады?
Осы аталған эксперименттік есепті іске асыру үшін оқушылар деңгейлік тапсырманың үш нұсқаға бөлінген үлгісін төмендегідей етіп орындағаны дұрыс.
І нұсқа: 1,3,6 - есеп ІІ нұсқа: 2,4,8 - есеп ІІІ нұсқа: 3,7,9 - есеп
Немесе екі есептен орындауға болады:
І нұсқа: 1,6 ІІ нұсқа: 2,8 ІІІ нұсқа: 3,4
Бұл сабақ оқушылардың бұрын алған білімдерін пайдалануға негізділгендіктен төмен- дегі жоспар есте болсын.
1. Эксперименттік есепті ретімен біртіндеп орындау қажет.
2. Әр тапсырманы түсініп, қай заттар (реактив) пайдаланылады және оның нәтижесі қандай болатынын болжай білген дұрыс.
3. Тәжірибе орындау кезінде байқалатын өзгерістер мен түрлі құбылыстарды бақылаған жөн.
4. Жұмысты аяқтаған соң оқушы тәжірибе нәтижесін кестеге сүйеніп, дәптерге толтырады.
Тәжірибенің аты
Әрекеттесуші реагенттер
Байқалған құбылыс
Реакция теңдеуі
Қорытынды
Үйге тапсырма: Қайталау.
Күні: Сыныбы:
№7-сарамандық жұмыс. Бейорганикалық қосылыстардың маңызды кластарын қорытындылауға арналған эксперименттік есептер
Қауіпсіздік техникасының ережелерімен таныс.
1. Мұғалімнің айтуы бойынша тиісті нұсқаңды ал.
2. Берілген әрбір есепті түсініп оқып ал және есептерді шешудің жоспарын құр.
3. Жұмыс орныңда берілген құралдар мен реактивтер ішінен өзіңе қажетін таңда ал.
Назарыңда болсын!!! Әрбір оқушы нұсқаның біреуін орындайды.
1-нұсқа
1. Нөмірленген үш сынауықта: су, күкірт қышқылы, әкті су ерітінділері бар. Әрбір сынауықтағы заттарды эксперименттік жолмен қалай анықтауға болады?
2. Тәжірибе жасау арқылы, мыс(ll)оксиді-негіздік оксид екенін қалай дәлелдеуге болады?
Құралдар мен реактивтер: Н2О, Н2SO4, Са(ОН)2, индикаторлар, СuO, сынауық, сынауық қысқыш, спиртшам, сіріңке.
2-нұсқа
1. Мыс және темір қоспасынан, мыс үгінділерін химиялық тәсілмен қалай бөлуге болады?
2. Мыс (ll) оксидінен - мыс (ll) гидроксидін тәжірибе жасау арқылы қалай алуға болады?
Құралдар мен реактивтер: Сu, Fe үгінділері, NaOH, Н2SO4,,екі стақан, сүзгі, сүзгі қағаз, шыны таяқша, қасық, сынауық қысқыш, сынауық, спиртшам, сіріңке.
3-нұсқа
1. Магний, магний оксиді, тұз қышқылы берілген.Магний хлоридін екі тәсілмен қалай алуға болады?
2. Берілген мыс (ll) оксидінен , мыс (l) хлоридін қалай алуға болады?
Құралдар мен реактивтер: Mg, MgO, HCI, 3-сынауық, шыны пластина, тигель ұстайтын қысқыш, спиртшам, қасық, сіріңке.
4-нұсқа
1. Әкті судың негіздік қасиет көрсететінін екі тәсіл арқылы дәлелде.
2. Кальций гидроксидінің ерітіндісі (әкті су) берілген. Кальций карбонатын, одан кальций хлориді ерітіндісін ал.
Құралдар мен реактивтер: Ca(OH)2,фенолфталеин, НСІ, СО2 газы, шыны түтік, сынауық,
Дәптерге: нұсқа нөмірін жазып, төменгі үлгіде таблицаны толтыр.
Есеп шарты
(қысқаша)
Бақылағаныңды және реакция тең- деулерін жаз
Қорытындысы.
Есіңде болсын!!! Жұмыс орныңды қалпына келтір, қолданған ыдыс аяқтарды жуып тиісті орнына тапсыр. Стол үстін сүртіп, жинастыр.
Күні: Сыныбы:
Сабақ тақырыбы: Бейорганикалық қосылыстар класы бойынша қайталау.
Сабақтың мақсаты: Оқушыларды бейорганикалық қосылыстардың әр түрлі кластарына жататын заттардың құрамын,қасиеттерін салыстыра білуге,заттарды жіктеп,олардың арасындағы генетикалық байланыс туралы білімін қорытындылауға үйрету және дамыту.
Реактивтер мен құралдар: Барий хлориді,күкірт қышқылы,әкті су ерітінділері, шыны түтік, сынауықтар.
Лабораториялық тәжірибе: Қышқылдық оксидтің және қышқыл химиялық қасиеті.
Сабақ барысы: 1. Ұйымдастыру кезеңі.
Білім мен біліктерін тексеру.Оқушылардың генетикалық қатар,генетикалық байланыс, екідайлы қосылыстар, бейорганикалық қосылыстардың әр түрлі кластарына жататы- нын заттардың құрамына,қасиетіне байланысты салыстыру,заттарды жіктеу,олар- дың арасындағы байланыс туралы білімдерін тексеру.Қысқа мерзімдік жаттығу жұмыстарын жүргізу. Мұны орындау барысында оқушылардың келесі сабақта өткізілетін практикалық не бақылау жұмыстарына дайындау жүзеге асырылады.
Бейорганикалық қосылыстар класы бойынша қайталаудың негізгі мақсаттары:
1-жұмыс. Генетикалық байланыс,генетикалық қатар ұғымдарын пайдалана білу.
2-жұмыс. Реакция теңдеулерін құрастыру,теңдеу бойынша есептеу есептері шығару.
3-жұмыс.Есептің берілгені бойынша мазмұнын құрастыра білу.
4-жұмыс. Бейорганикалық қосылыстардың химиялық қасиеттерін сипаттай білу.
5-жұмыс. Эксперименттік есептерді шығару білігін бекіту.
1 - нұсқа.
1.Магний элементінен түзілетін бейорганикалық қосылыстардың генетикалық қатарын құрастыр.
2.Зат мөлшері 3моль магний оксиді тұз қышқылымен әрекеттескенде түзілетін тұздың массасын анықта.
3.Есептің шарты қысқаша түрде берілген. Мазмұнын құрастырып шығар:
Хг 16,42г
CaO + 2HNO3 = Ca(NO3)2 + H2O;
4.Мына берілген заттармен:KNO3,HNO3,CuO,Zn,SO3,H2SO4,Cu(OH)2 төмендегі заттар- дың қайсысы әрекеттеседі? а) натрий гидроксиді; ә) күкірт қышқылы;
Сәйкес келетін реакция теңдеуін құрастырып, реакция типін көрсет.
5.Әкті су ерітіндісі берілген. Шыны түтік арқылы оған көбірек үрле, нәтижесінде ерітінді лайланады.Бұл құбылысты реакция теңдеуін жазу арқылы дәлелде.
2 - нұсқа.
1.Көміртек элементінен түзілетін бейорганикалық қосылыстардың генетикалық қатарын құрастыр.
2.Массасы 10г магний оксиді күкірт қышқылымен әрекеттескенде түзілетін тұздың массасын есептеу..
3.Есептің шарты қысқаша түрде берілген. Мазмұнын құрастырып шығар:
3,72г Хлитр
Ca(OН)2 + СО2 = CaСО3 + H2O;
4.Мына берілген заттармен:KNO3,HNO3,CuO,Zn,SO3,H2SO4,Cu(OH)2 төмендегі заттар- дың қайсысы әрекеттеседі? а) барий гидроксиді; ә) тұз қышқылы;
Сәйкес келетін реакция теңдеуін құрастырып, реакция типін көрсет.
5.Барий хлориді ерітіндісі берілген,оған қүкірт қышқылын құйғанда тұнба түзіледі. Тұнбаға түскен қандай зат? Реакция теңдеуін жаз.
Үйге тапсырма: §44-49 қайталау.
Күні: Сыныбы:
Сабақ тақырыбы: Бақылау жұмысы.
Сабақтың мақсаты: Оқушылардың генетикалық қатар,генетикалық байланыс, екідайлы қосылыстар, бейорганикалық қосылыстардың әр түрлі кластарына жататынын заттардың құрамына,қасиетіне байланысты салыстыру,заттарды жіктеу,олардың арасындағы байланыс туралы білімдерін тексеру.
Сабақ барысы: 1.Ұйымдастыру кезеңі.
Жаңа сабақ:
Бақылау жұмысын екі нұсқада алу.
1. Төмендегі сызба нұсқалардағы белгісіз заттарды тауып,айналуларды жүзеге асыруға мүмкін-дік беретін химиялық реакция теңдеулерін жазыңдар:
1-нұсқа: С → СО2 → Х → Na2CO3 → CO2 → CaCO3
Cu → CuO → CuCI2→X → CuO → Cu
2-нұсқа: AI → AICI3→ AI(OH)3 → AI2(SO4)3 →X → AI2O3
CaCO3 → CaO → Ca(OH)2 → Ca(HCO3)2 → X(газ)
2. Мына қосылыстардың қай тобы өзара әрекеттеседі:
1-нұсқа: HCI мен NaOH; Cu мен HCI; 2-нұсқа: CO2 мен NaOH; Fe мен H2O;
3. Төмендегі заттар ішінде генетикалық қатары бар заттарды тауып, айналуларды іске асыруға болатын реакция теңдеулерін жазыңдар.
1-нұсқа: BaO,Mg,K,CaO,CuSO4,Ba,MgCI2,Mg(OH)2,Ba(OH)2,CaSO4,Ba3(PO4)2.
2-нұсқа: NaNO3,P2O5,PbCI2,H2SO4,K3PO4,P,CuO,H3PO4,Fe,CuO,CaSO4.
4. Төмендегі сызбанұсқаларға сәйкес химиялық реакциялардың теңдеулерін жазып теңес- тіріп,белгісіз заттарды тауып,оларды атаңдар:
1-нұсқа: 1) S + O2 = x; 2-нұсқа: 1) x + H2O = H3PO4;
2) H2CO3 = H2O + x; 2) Na + x = Na2O;
3) MgCO3 = x + у; 3) Ca(OH)2 + x = CaCO3 + у;
№2 бақылау жұмысы. А,В,С деңгейлік тапсырмалары.
1-нұсқа.
1. Негіздерді жіктеуге екі мысалдан келтіріп, химиялық қасиеттерін сипаттаңдар.
2.Қышқылдарды жіктеп,әрқайсысына үш мысалдан келтіріп сипаттаңдар.
3.(Негіздік,қышқылдық,екідайлы оксидтердің әрқайсысына үш мысалдан келтіріңдер.
4.Тұздарды:NaCI,CaCO3,Ca(HCO3)2,MgOHCI,NaHCO3,K2CO3,Ca3(PO4)2 жіктеп жаз.
5.Төмендегі айналуларды іске асыруға болатын реакция теңдеулерін жаз:
Сa(OH)2 → CaCO3 → CO2 → Na2CO3;
↓
CaCI2
В6(2-балл). Төмендегі сызбанұсқаларға сәйкес химиялық реакциялардың теңдеулерін жазып теңестіріп,белгісіз заттарды тауып,оларды атаңдар: FeCI3 → x → Fe2O3 → у;
C7(4балл). Массасы 10г кальций карбонатын тұз қышқылымен әрекеттестіргенде бөлініп шығатын газды натрий сілтісі арқылы өткізгенде қанша грамм натрий гидрокарбонаты түзілетінін есептеңдер.
2-нұсқа.
А1(1-балл). Негіздерді жіктеуге екі мысалдан келтіріп,химиялық қасиеттерін сипаттаңдар.
А2(1-балл). Қышқылдарды жіктеп,әрқайсысына үш мысалдан келтіріп сипаттаңдар.
А3(1-балл). Негіздік,қышқылдық,екідайлы оксидтердің әрқайсысына үш мысалдан келтір.
А4(1-балл). Тұздарды:NaCI,CaCO3,Ca(HCO3)2,MgOHCI,NaHCO3,K2CO3,Ca3(PO4)2 жіктеп жазыңдар.
В5(2-балл). Төмендегі айналуларды іске асыруға болатын реакция теңдеулерін жаз:
CuCO3 → CuCI2 → Сu(OH)2 → CuO → Cu;
В6(2-балл). Төмендегі сызбанұсқаларға сәйкес химиялық реакциялардың теңдеулерін ,жазып теңестіріп,белгісіз заттарды тауып,оларды атаңдар: CuCO3 → x → СuCI2 ![]() у;
у;
C7(4балл). Көлемі 4,48 л қалыпты жағдайда оттек түзілу үшін мына тұздардың: KNO3, ,,,,,,,,,,,,,,,,,KCIO3,KMnO4 әрқайсысының қандай массалары қажет болатынын есептеңдер.
(Ескерту: Балдардың қосындысы жоғары болатындай қалаған төрт есепті шығарыңыз.)
Үйге тапсырма: §44-49 қайталау.
VI тарау. Д.И.Менделеев жасаған химиялық элементтердің периодтық заңы және
периодтық жүйесі.
№1-інші сабақ тақырыбы: Химиялық элементтерді жіктеудегі алғашқы қадамдар.
Оқыту мақсаты: Оқушыларға химиялық элементтерді жіктеудің қажеттілігін көрсету,элементтерді металдар және бейметалл деп үлкен екі топқа бөлген жіктеудегі алғашқы қадамдармен таныстырып,оның жасанды екенін,екідайлы және ауыспалы қасиет көрсететін элементтер туралы түсінік беру. Оларды элементтердегі табиғитекке біріктіру мақсатымен таныстыру.
Реактивтер мен құралдар: Жаңа дайындалған мырыш,натрий гидроксидінің және тұз қышқылының ерітінділері,сынауықтар,сынауық тұрғы.
Көрнекі тәжірибелер: Екідайлықты дәлелдеу.
Сабақ барысы: Ұйымдастыру кезеңі.
Жаңа сабақ: Сабақ тақырыптың маңызын айтудан басталады,одан соң әрбір ғылымның дамуына байланысты көптеген мәліметтер жинақталып, оны жіктеу,белгілі заңдылықтардың байланысын ашу қажеттілігі айтылады.
Химияда элементтер және олардың қосылыстары туралы білімнің жинақталуы ХІХ ғасырдың ортасында оларды ұқсас қасиеттеріне қарай топтастыруды қажет етті.Оқушыларға химиялық элементтерді жіктеудің негізгі белгілерін атап көсету.Элементтерді жіктеу негізінде физикалық және химиялық қасиеттерін нақтылауға мүмкіндік туа бастады. Нағыз металдарға негіздік оксидтер,оған негіздер сәйкес келеді.Ал нағыз бейметалдар ұшқыш сутекті қосылыстар түзеді,металдар ондай қосылыстар түзбейді.Содан кейін төмендегі эксперимент есептерді талдау:
1.Егер берілген зат суда ерімейтін болса,оның қышқыл екенін қалай дәлелдейміз? H2SiO3 -ұсыну.
2. Егер берілген зат суда ерімейтін болса,оның негіз екенін қалай дәлелдейміз? Сu(ОН)2-ұсыну.
Оқушылар төмендегідей қорытындыға келеді: а)нағыз металдың гидроксиді қыш- қылдармен әрекеттеседі,ал сілтімен әрекеттеспейді; ә)ал нағыз бейметалдан түзілген қышқыл сілтілермен әрекеттеседі,бірақ қышқылдармен әрекеттеспейді.
Кейбір элементтердің металға да,бейметалға да тән қасиет көрсетуіне қарай екідайлы қасиет көрсететіні белгілі болды.Оқушылардың алдында жаңа проблемалық сұрақ туады: ,,,,,,,,,,,,,,,,,,,,,,,,,а)мырыш гидроксиді қышқыл болама,әлде негіз бола ма?
,,,,,,,,,,,,,,,,,,,,,,,,,ә) Мырыш нағыз металға жата ма, немесе нағыз бейметалға жата ма?
Оқушыларға көрнекі тәжірибе көрсетіледі. Мырыш гидроксидінің қышқылда да,сілтіде де еріп тұз түзетіні түсіндіріледі. Оқушылар мырыш ауыспалы қасиет көрсететін элемент деген қорытындыға келеді.Бұл қасиет металдан бейметалға ауысатын өтпелі элементке тән. Оқушылар мырыш гидроксидінің қышқылмен,негізбен әрекеттесуінің реакция теңдеулерін жазады.
Бұдан кейін оқушыларға қышқылдық та, негіздік те қасиет көрсететін гидроксидтер болатынын айта отырып,олардың негіздер мен қышқылдар туралы білімдерін қорытындылау мақсатында төмендегі кестені толтыруды ұсынамыз:
Қосылыстар
негіздер
Екідайлы гидроксидтер
қышқылдар
1.Қышқылмен әрекеттесуі.
2.Негізбен әрекеттесуі.
+
-
+
+
-
+
Оқушыларға оксидтер немесе гидроксидтері екідайлы болатын элементтердің өте көп екендігін айтамыз. Мысалы: Be,Zn,AI,Cr(III),As,т.б.Осыдан кейін химиялық элементтерді жіктеу үшін жасалған басқа да әрекеттермен таныстырамын. Валенттігі бойынша бөлу:
а) жоғары оксидтегі валенттігі бойынша;
ә) ұшқыш сутекті қосылысындағы валенттігі бойынша;
Одан кейін төмендегі тапсырмалар беріледі:
1.BeO-нің екідайлы қасиетін көрсететін реакция теңдеуін құрастырыңдар.
2.Be(OH)2-нің екідайлы қасиетін көрсететін реакция теңдеуін құрастырыңдар.
3.Төмендегі айналымдардың теңдеулерін жазыңдар: Na2ZnO2
↑
ZnCI2→Zn→ZnO→Zn(OH)2→Zn(NO3)2
Үйге тапсырма: §50 (1-6). Жұмыс дәптері.
күні айы жылы
№2-інші сабақ тақырыбы: Элементтердің табиғи ұяластары және олардың қасиеттері.
Оқыту мақсаты: Элементтерді алғашқы топқа бөлу,ұқсастығы мен айырмашылығы арқылы оларды сілтілік металдар,галогендер,халькогендер және инертті газдарға топтастыру.Осы топтардағы элементтердің физикалық және химиялық қасиеттерінің салыстырмалы атомдық массаға тәуелді екенін түсіндіру.
Реактивтер мен құралдар: Сілтілік металдар,галогендер үлгілері,натрий,литий , су,стақан, сүзгі, индикатор, лабораториялық тұрғы, сіріңке.
Көрнекі тәжірибелер: Сілтілік металдар,галогендер үлгілері,cілтілердің сумен әрекеттесуі.
Сабақ барысы: 1.Ұйымдастыру кезеңі.
Білім мен біліктерін тексеру: Оқушыларға төмендегі сұрақтар қойылады:
1.Химиялық элементтерді жіктеудің негізгі себебі неде?
2.Химия ғылымы дамуының бастапқы сатысында химиялық элементтерді жіктеудегі алғашқы қадамдарды айт.
3.Zn(OH)2 -нің екідайлы қасиетін қалай дәлелдеуге болады? Тәжірибе жасау арқылы дәлелде.
4.Металдар мен бейметалдар оксидтерінің және екідайлы оксидтердің қандай қасиеттерін білесіңдер?
5.Бір оқушы тақтада элементтерді жіктеудің сызбанұсқасын сызып,оны түсіндіреді.содан кейін мына тапсырманы орындайды. №1 тапсырма.Мына өзгерістердің реакция теңдеулерін жаз:
BeO → Be(NO3)2 → Be(OH)2 → K2BeO2
Қалған оқушыларға екідайлы қасиет көрсететін оксидтер мен гидроксидтер туралы білімін бекіту үшін мына заттардың арасындағы реакция теңдеулерін жазуды ұсыну:
1-нұсқа. а) ZnO + HNO3; ә) ZnO + NaOH; 2-нұсқа. KAIO2 →AI(OH)3→ AI2O3→NaAIO2
б) Zn(OH)2 + H2SO4; в) Zn(OH)2 + KOH; ↓
AI(NO3)2
Жаңа сабақты әңгімелеуден бастау. Металдар,бейметалдар,ауыспалы элементтердің ішінде қасиеттері жағынан өте ұқсас элементтер кездеседі,сондықтан ерекше топқа біріктіру кажет болды. Мысалы,элементтерді төмендегі екі белгісі бойынша топқа біріктіру басталды: 1.Элементтердің оттекті қосылыстарындағы жоғары валенттігі;
2.Элементтердің ұшқыш сутекті қосылысындағы валенттігі;
1-топ.R2O; Li Na K Rb Cs ІІтоп.RO; Mg Ca Sr Ba ІІІтоп.R2O3 B AI IVтоп RO2 C Si Sn
7 23 39 86 133 24 40 88 137 11 27 12 28 119
Алайда, бұл бөлінген топтарға ХІХғасырдың ортасында табылған 63 элементтің барлығы бірдей кірген жоқ. Әрбір топтағы элементтер қалғандарымен салыстырғанда өзгеше, ол бір-біріне тек жоғарыда көрсетілген белгілері бойынша ғана емес,сол сияқты оксидінің құрамы,қасиеті,гидрок- сидтері,тұздары бойынша да өте ұқсас болды. Олар көбінесе табиғатта бірге кездеседі,қосылыс тардан бірдей әдістермен бөлініп алынады.Сол сияқты әрбір топқа кіретін элементтерді атомдық массасының өсуі бойынша орналастырғанда белгілі бір заңдылықтар байқалады:
а)жай заттардың металдық қасиеттері артады;
ә)оксидтері мен гидроксидтерінің негіздік қасиеттері артады;
б)ұшқыш сутекті қосылыстарының тұрақтылығы біртіндеп кемиді;
Көрсетілген топтарды табиғи тек деп атаудың басты себебі біріктірілген элементтер өте ұқсас. Осыдан кейін оқушыларды элементтердің табиғи ұяластарымен таныстырамын....
Тақырыпты қорытындылау үшін сілтілік металдардың және галогендердің табиғи топтарына
салыстырмалы сипаттама бере отырып,ұқсастығымен айырмашылығын ажыратуға үйрету.
Тапсырма: 1)Сілтілік металдар,галогендер,оттек және халькогендер тегіне жататын элемент- тердің физикалық және химиялық қасиеттеріндегі ұқсастықтары мен айырмашылықтарын көрсетіңдер.(кестелер бойынша:
2) С.а.м. өсуіне қарай физикалық қасиеттері қалай өзгереді?
3) Белсенділіктері қалай өзгереді?
4) С.а.м. өсуіне қарай химиялық қасиеттері қалай өзгереді?
Оқытудың жоспарланған нәтижесі: Оқушылар сілтілік металдар мен галогендердің физикалық қасиеттерін айтып,оларға тән химиялық қасиеттерін реакция теңдеулерін жазу арқылы дәлел- деуі қажет.
Дамытудың жоспарланған нәтижесі:Оқушылар сілтілік металдарды және галогендерді,инертті газдарды өзара салыстыра білуі тиіс.
Үйге тапсырма: §51 (1-6). Жұмыс дәптері.
күні айы жылы
№3-інші сабақ тақырыбы: Д.И.Менделеевтің периодтық заңы.
Оқыту мақсаты: Периодтық заңның мәнін,оның негізгі қағидаларын түсіну.Әрбір элементерге тән химиялық қасиеттерді талдай отырып, олар периодта орналасуына байланысты екенін түсіндіру. Элементтер және олардың қосылыстары жайлы мағлұмат алу алу үшін периодтық заңның маңызын түсіну қажеттігі.
Құрал - жабдықтары: Алғашқы 20 элементтің таңбасы жазылған қиықтар.
Сабақ барысы: Ұйымдастыру кезеңі.
Білім мен біліктерін тексеру: Оқушылар сабақтың барысында өздеріне таныс элемент терді жіктеудегі алғашқы қадамдарды естеріне түсіреді:
-
Элементтерді екі топқа бөлу:металдар және бейметалдар.
-
Үш класқа бөлу: металдар; екідайлы қосылыс түзетін элементтер;бейметалдар;
-
Жалпы қасиеттеріне байланысты табиғи тектерге бөлу: салыстырмалы атомдық массалары және қосылыстардағы валенттіліктері.
Жаңа сабақ: Д.И.Менделеев химиялық элементтерді жіктеуді одан әрі жалғастырғанда, олардың салыстырмалы атомдық массасының өсу ретімен орналастыруды басшылыққа алған. Сонда элементтер қасиеттерінің белгілі бір элементтен кейін қайталанатынына көңіл аудар ғаны айтылады. Сөйтіп қасиеті ұқсас элементтерді бірінің астына бірін орналастыру нәтиже сінде табиғи топтар анықталған. Осыдан кейін оқушыларға Д.И.Менделеевтің жолын қайталау ұсынылады. (Ол үшін қиықтар қолданылады). Элементтердің қасиеттері атомдық массаның өсуіне қарай:
-
элементтің сипаты:(металл,ауыспалы элемент,бейметалл);
-
жоғары оксидтеріндегі валенттілігі;
-
ұшқыш сутекті қосылыстарындағы валенттігі өзгеретініне көңіл аударамыз.
Оқушылар элементтердің қасиеті қосылыстардағы валенттілігі мен атомдық массасының өсуіне байланысты периодты түрде өзгереді деген қорытындыға келеді.Мұның өзі Д.И.Менделеев ке элементтерді салыстырмалы атомдық массаларының өсу реті бойынша орналастырып, периодтық заңды ашуға мүмкіндік берді. Осы заңдылықты 1869 жылы Д.И.Менделеев элемент тердің периодтық жүйесін жасағанда периодтық заң түрінде тұжырым дады.Қазіргі кездегі атом құрылысы теориясы тұрғысынан периодтық заңның ережесі: химиялық элементтің,олар түзетін жай заттарының және қосылыстарының қасиеті атом ядросының зарядына периодты түрде тәуелді болады.Оқушылар ережені талдай келе өздері оның маңызын түсінеді,дүниета -нымдылық көзқарастары қалыптасады.
Периодтық заң және периодтық жүйені ашуда Д.И.Менделеевтің еңбегі зор. Атомдық масса ның өсуін негізге ала отырып,кезінде Д.И.Менделеев болжаған элементтер кейін ашылды. Бұл сол кездегі атом және молекула туралы жаңа көзқарастың қалыптасуына жол ашты.
Сөйтіп, Д.И.Менделеев болжаған элементтердің толығымен ашылып, табиғатта кездесетін және жасанды жолмен алынған элементтердің бәрі периодтық жүйе де тиісті орын алғанын айту қажет. Элементтердің: металдық, бейметалдық қасиеттері, жоғары оксидтеріндегі валенттіктері, ұшқыш сутекті қосылыстарындағы валенттіктері, оксидтерінің қасиеттері, гидроксидтерінің қасиеттері былай өзгереді.
7Li 9Be 11B 12C 14N 16O 19F 20Ne Металдық қасиет кемиді, бейметалдығы артады
І ІІ ІІІ IV V валенттіліктері өседі
Li2O BeO B2O3 CO2 N2O5 - - -
Негіздік Екідайлы Қышқылдық оксидтер
LiOH Be(OH)2 H3BO3 H2CO3 HNO3 - - -
Негіз Екідайлы Өте әлсіз Әссіз Күшті
Гидроксид қышқыл қышқыл қышқыл
IV III II I валенттіліктері кемиді
CH4 NH3 H2O HF -
Сабақты бекіту үшін тапсырма беру. Na-ден Ar-ға дейінгі элементтердің: металдық, бейметал дық қасиет тері, жоғары оксидтеріндегі валенттіктері, ұшқыш сутекті қосылыстарындағы валенттіктері,оксидтерінің қасиеттері,гидроксидтерінің қасиеттері қалай өзгереді?
Оқытудың жоспарланған нәтижесі:Оқушылар Д.И.Менделеев ұсынған периодтық заңның ереже сін айтып,нақты мысалдар келтіре отырып, жеке-жеке элементке және оның қосылыстарына сипаттама бере білуі қажет.
Дамытудың жоспарланған нәтижесі. Окушылар элемент және оның қосылыстарының қасиет- терін период бойынша талдай білуге үйренеді.
Үйге тапсырма: §52. (1-7). Жұмыс дәптері.
күні айы жылы
№4-інші сабақ тақырыбы: Атом құрылысы. Атом ядросының құрамы, изотоптар.
Оқыту мақсаты: Атом құрылысы туралы білімді нақтылау. Химиялық элементтердің периодтық жүйедегі рет нөмірінің физикалық мәнін түсіндіру. Атом құрылысының күрделілігіне байланысты периодтық заңның қазіргі кездегі тұжырымдамасын айту.
Құрал - жабдықтары: Д.И.Менделеевтің периодтық жүйесі.
Сабақ барысы: Ұйымдастыру кезеңі.
Оқушылардың периодтық заң туралы білімін тексеру мақсатында тапсырмалар беру:
-
Кейбір элементтердің сутегі мен және оттегімен қосылыстарының жалпы формулалары қандай:RH3,R2O,RO2,RH,RH4. Осылардың қайсысы көміртегі мен мышьяктың сутекпен қосылысы мен жоғары оксидінің формуласына сәйкес келеді?
-
Мына қосылыстардың формуласы дұрыс болу үшін қажетті индекстерді қойыңдар: РН, Н, СН, NH .
-
Жоғары оксидтерінің формуласы дұрыс болу үшін қажетті индекстерді қойыңдар: CIO, SbO, PbO, SiO.
Оқушыларға төмендегі сұрақтар қойылады:
-
Салыстырмалы атомдық массаларының өсуіне қарай орналасқан элементтердің химиялық қасиеттері не себепті периодты өзгереді?
-
Период дегеніміз не?
-
Периодтық заңның тұжырымдамасы қандай?
-
Неге кей жағдайларда (Ar-K, Co-Ni, Te-I) элементтер атомдық массаларының өсуіне байланысты орналаспаған?
-
Заңды өзгерістер болатын элементтердің және олардың атомдарының қандай қасиеттерін білесіңдер?
Осындай проблемалық сұрақтар кезінде Менделеевті де ойландырды. Өмірінің соңғы жылдарында мұның сыры атомдардың күрделі құрылысында болар деген болжам жасады. Оқушылар бұл сұраққа жауап беру үшін физикадан өткен атом құрылысы туралы білімдерін қолданады.
-
Атом құрылысы туралы не білесіңдер?
-
Атомдар қандай негізгі екі бөлшектен құралған?
Тағы басқа сұрақтар бере отырып, атомның күрделі құрылысы туралы әңгімелеу.
Оқушылардың жауабы 1911 жылы ағылшын физигі Резерфордтың атом ортасында оң зарядты ядро, ал оның айналасында электрон бұлтын түзе қозғалатын электрон бар деген теориямен толықтыру.Американ физигі Милликен электрон теріс заряд көрсете- тінін тәжірибе жүзінде дәлелдеп,оны бірге тең деп қабылдады. Атом жалпы электр- бейтарап болғандықтан, электрондар зарядының жалпы саны ядро зарядына тең.
Ал 1913 жылы Резерфордтың шәкірті Г.Мозли атом ядросындағы зарядтардың шамасы элементтің периодтық жүйедегі рет нөміріне тең болатындығын анықтады.
Мозлидің ашқан жаңалығынан кейін Менделеевтің жасаған периодтық жүйесіндегі
Ar-K,Co-Ni,Te-I элементтердің орындарының алмасуы заңды екені анықталды.Осыған байланысты,элементтердің реттік нөмірі атом ядросындағы оң зарядтың санын,сол сияқты ядро айналасында қозғалатын электрондар санын көрсетеді.
Реттік нөмірдің физикалық мәні осында.Элементтердің реттік нөмірі - оның атом ядросының заряды. Атомның ядро заряды химиялық элементтердің қасиеттерін сипаттайтын маңызды шама. Атом құрылысын одан әрі зерттеу кезінде құрамына протондар мен нейтрондар деп аталатын бөлшектер кіретіні анықталды.
Атомның элементар бөлшектері:
Бөлшектер
Белгісі
Салыстырмалы заряды
Салыстырмалы массасы
Протон
р
+
1
Нейтрон
п
0
1
Электрон
е
−
0
1. Элемент атомының массасы протон мен нейтрон массасының қосындысына тең.
2. Ядродағы протон саны элементтің реттік нөміріне тең.
А = Z + N; A - атомдық масса; Z - протон; N - нейтрон;
Табиғатта атомдық массасында айырмашылығы болатын бірдей элементтер атомы болады. Мысалы, хлор элементінің массасы 35 және 37 болатын екі түрі кездеседі. Бұл атомдардың ядросында протондар саны бірдей,ал нейтрондар саны әр түрлі. Олар изо- топтар. Изотоптар - ядро зарядтары бірдей,атомдық массалары әртүрлі атомдардың түр өзгерістері. Изотоп - бірдей орында деген мағнаны білдіреді.
Изотоптарда протон мен электрон саны бірдей, нейтрон сандары әртүрлі. Әрбір изотоп екі түрлі шамамен өлшенеді: массасы және элементтің рет нөмірі. Мысалы:
1. ![]() - атомдарының ядро зарядтары бірдей - оттегі изотоптары.
- атомдарының ядро зарядтары бірдей - оттегі изотоптары.
2. ![]() - сутегінің изотоптары, аттары: протий, дейтрий, тритий .
- сутегінің изотоптары, аттары: протий, дейтрий, тритий .
Элементтердің атомдық массалары бөлшек сандармен өрнектеледі. Мысалы, хлор эле- ментінің с.а.м. 35,5. Бұл ұғымдардың айырмашылығын түсіндіру үшін мынадай мысал- дар келтіріледі. Табиғатта ![]() изотобы 75%, ал
изотобы 75%, ал ![]() изотобы 25% таралған.Осыдан хлор элементінің орташа с.а.массасы шығады: Аr(CI) = 35∙0,75+37∙0,25 = 35,5
изотобы 25% таралған.Осыдан хлор элементінің орташа с.а.массасы шығады: Аr(CI) = 35∙0,75+37∙0,25 = 35,5
Периодтық жүйеде келтірілген элементтердің атомдық массалары изотоптардың табиғи қоспаларының орташа массалық саны. Изотоптар туралы мәліметтерді ескере отырып, оқушыларға химиялық элемент ұғымының нақты анықтамасын беру қажет. Химиялық элемент дегеніміз - ядро заряды бірдей атомдар түрі.Периодтық заңға атом құрылысы тұрғысынан жаңа анықтамасын береміз.
Өтілген тақырыпты бекіту мақсатында оқушыларға тапсырма беріледі және сұрақтар қойылады.
1-нұсқа. 5-49,5-50,5-52,5-53а, 2-нұсқа. 5-55,5-51,5-54,5-53ә,
-
Атом ядросы қандай бөлшектерден тұрады?
-
Атом ядросының заряды немен анықталады?
-
Нейтрон мен протонның қандай ұқсастықтары мен айырмашылықтары бар?
-
Протон мен электронның қандай ұқсастықтары мен айырмашылықтары бар?
-
Элемент атомының массасы немен анықталады?
-
Протон, нейтрон және электронның массасы мен зарядтар қандай?
-
Изотоп атомдарында қандай ұқсастықтар мен айырмашылықтар бар?
Оқытудың жоспарланған нәтижесі: Оқушы қазіргі периодтық заңның ережесін,әр атомның ядро зарядын, нейтрон және электрон санын таба білуі қажет.
Үйге тапсырма: §53,(1-4), §54,(1-4), §55оқу. Жұмыс дәптері.
күні айы жылы
№5-6-ыншы сабақтар тақырыбы: Электрондардың атомдарда орналасуы. Энергиялық деңгейлер.
Оқыту мақсаты: Атом қабаттарына электрондарды толтыру заңдылығы, электрондық деңгейлер,олардың периодқа байланысты екенін түсіндіру. Электрон қабаттарының өзгеруіне байланысты элементтердің және олардың қосылыстарының қасиеттері периодты және секірмелі түрде өзгеретінін түсіндіру.Зат құрылысының және элементтің химиялық қасиетінің табиғи заңдылығын нақтылай отырып,оның себебін түсіндіру. Материя құрамындағы ортақ заңдылықтар туралы мағлұматтар беру.
Құрал - жабдықтар: Химиялық элементтердің периодтық жүйесі,екінші период элементтерінің атом құрылысы туралы кесте.
Тірек білім мен біліктер: Атом,атом ядросы,электрон,реттік нөмірдің физикалық мәні туралы білім.
Сабақ барысы: Ұйымдастыру кезеңі.
Оқушылардың білімін тексеру. Оқушылармен мына сұрақтар талданады:
-
Атомдар қандай бөлшектерден тұрады?
-
Изотоп деген не?
-
Реттік нөмірдің физикалық мәні неде?
-
Элемент және оның қосылыстарының химиялық қасиет,і элементтердің оксидтеріндегі валенттілігі, бейметалдардың сутегімен қосылыстарындағы валентігі қалай өзгереді?
Екінші период элементтерінің құрамы тақтаға ,оқушылар дәптеріне жазады?
Элемент таңбасы, рет рөмірі
Протон саны
Нейтрон саны
Электрон саны
С.а.м.
№3.Li
3
4
3
7
№4.Be
4
5
4
9
№5.B
5
6
5
11
№6. C
6
6
6
12
№7. N
7
7
7
14
№8. O
8
8
8
16
№9. F
9
10
9
19
№10. Ne
10
10
10
20
Оқушылар атом ядросының заряды элементтің реттік нөмірі қанша өскен сайын электрон қабатындағы электрон саны да,сонша өсетіндігі туралы білімдерін бекітеді.
Жаңа сабақ. Бұдан соң атомдағы электрондар ядродан әр түрлі қашықтықта орналаса отырып,электрон қабаттарын түзетіндігі жайлы айтып өткен жөн.Электрон қабаттары энергиялық деңгейлер деп те аталады.
Оларды ядродан бастап 1,2,3,4,5,6,7,деп нөмірлейді,немесе K,Z,M,N,O,P,Q әріптерімен белгілейді.
Атомдағы электрондарда түрлі энергия қоры болады,оны электрондар квант деп аталатын кесінді үлеспен сіңіреді немесе бөліп шығарады. Деңгейдің нөмірін көрсететін бүтін п саны негізгі кванттық сан деп аталады. Ол берілген энергиялық деңгейдегі электронның энергиясын көрсетеді. Ядроға ең жақын бірінші энергиялық деңгейдегі электрон энергиясы ең аз мөлшерде болады. Бірінші энергиялық деңгейдегі электронмен салыстырғанда қалған деңгейдегі электрондардың энергия қоры көп болады.Осыған орай сыртқы қабаттағы электрондардың ядромен байланысы әлсіз. Атомдағы энергиялық деңгейдің саны,осы элемент тұрған периодтың нөміріне сәйкес келеді:
1-период элементтеріне бір энергиялық деңгей,
2-периодта - екі,
3-периодта - үш т.с.с.
Энергиялық деңгейдегі болатын электрондардың ең жоғары саны мына формуламен өрнектеледі: N = 2n2. N-электрон саны, п-деңгей саны(ядродан бастап санағандағы) немесе негізгі квант саны.
Осы формулаға сәйкес бірінші энергиялық деңгей де п=1; 2∙12=2 электрон,
п=2; 2∙22=8 электрон,
п=3; 2∙32=18 электрон,
п=4; 2∙42=32 электрон.
Осыдан кейін оқушыларға оқулықтағы кестені пайдаланып, алғашқы 20 элементтің электрондық қабаттарының құрылысы түсіндіріледі.(Оқушылар дәптерлеріне жазып отырғаны жөн).
Бірінші энергиялық деңгейге екі электроннан артық сыймайтындығына назар аударамыз (Мысалы, Н атомында 1-электрон, Не атомында 2-электрон бар). Сондықтан 1-ші периодта екі элемент бар.Осы формулаға сүйене отырып, 2-ші периодта - 8, 3-ші периодта - 18 элемент болатынын оқушылар есептеп табады да, Li-ден, Ne-ға дейінгі элементтердің энергиялық қабаттарында электрондардың орналасуын жазады. Үшінші энергиялық деңгейді электрондар- мен толтыру алғашқы қабаттарға қарағанда өзгеше болатынына көңіл аударылады.
Алғашқыда оған 8 электрон орналасады: натрийден (бір электрон) аргонға дейін (8 электрон), мұнан соң үшінші қабатты электронмен толтыру уақытша тоқталады. Калийдегі 19-шы, кальцийдегі 20-шы электрондар төртінші деңгейде болады.
Бұл элементтердің атом құрылысының сызбанұсқасы:
+19К 2е,8е,8е,1е;
+20Са 2е, 8е, 8е, 2е;
Скандий элементінен бастап (№21), мырыш элементіне (№30) дейін электрондар қайтадан үшінші энергиялық деңгейге орналасады, ал төртіншіде екі электрон сақталады, сызбанұсқасы: +21Sc 2e,8e,9e,2e;
+30Zn 2е,8е,18е,2е;
Галий элементінен бастап(№31) электрондар төртінші энергиялық қабатқа орналаса бастайды. Ол 4-ші периодтың соңғы элементі криптонға дейін сақталады.
Сабақ соңында мынадай қорытынды жасаған жөн: элементтердің қасиеттерінің периодты өзгеруі атомдардың сыртқы электрондық қабаттарындағы электрон сандарының қайталануымен түсіндіріледі,бір периодта әрбір жаңа электрондардың қосылуынан қасиеттердің күрт өзгерісі байқалмайды,ал жаңа электрон қабатында келесі электронның пайда болуы элементтер қасиетінің секірмелі өзгеруіне әкеледі (күрт өзгертеді). Диалектиканың санның сапаға көшу заңдылығының дәлелі.
Электрон қабаттарының құрылысы жайлы оқушылар білімін және құрылыс сызбанұсқасын жазу білігін бекіту үшін жаттығу жұмыстары орындалады.
1-нұсқа. 5-56 а,б, 5-78, 5-61; 2-нұсқа. 5-56 ә,в, 5-79, 5-62; 97-99беттер.
Оқытудың жоспарланған нәтижесі: Оқушы алғашқы 1-3 период элемент атомдар арасындағы электрон қабатын толтыру заңдылығын түсіндіре білу,элементтің реттік саны өсуіндегі қасиеттерінің біртіндеп және секірмелі түрде өзгеру себептерін айтып беруі қажет. Сөйтіп оқушылар зат құрылысының табиғи заңдылығын түсіне бастайды. Химиялық қасиеттері энергиялық деңгейлерде электронның орналасуына тәуелді екенін түсінулері қажет.
Үйге тапсырма: §56,(1-8) Жұмыс дәптері.
Есептер мен жаттығулар жинағы. 5-69,5-70,5-71,5-73, 98-99 беттер.
күні айы жылы
№8-інші сабақтар тақырыбы: Д.И.Менделеев жасаған химиялық элементтердің периодтық жүйесі. Периодтық заңның маңызы.
Оқыту мақсаты: Оқушыларға периодтық жүйені табиғат заңдарына негізделген элементтердің табиғи жіктелуі екендігін түсіндіру. Периодтағы элементтер қасиетінің өзгеруіндегі заңдылық туралы алған білімін бекіту. Негізгі топ элементтерінің қасиетінің өзгеруіндегі заңдылықтарды түсіндіру.
Құрал - жабдықтар: Химиялық элементтердің периодтық жүйесі, кіші және үлкен период элементтерінің салыстырмалы кестесі.
Тірек білім мен біліктер: Элементтер қасиеттерінің периодты өзгеру себептері, атом құрылысы, электрондық қабаттарының құрылысы.
Сабақ барысы: Ұйымдастыру кезеңі.
Периодтық заң,электрондық қабаттың құрылысы, кіші және үлкен периодтар туралы білімді бекіту мақсатында әңгіме жүргізіледі. Оқушылар мына сұраққа жауап береді.
-
Период дегеніміз не? Кестеден кіші және үлкен периодтарды көрсет.
-
Үлкен периодтағы және кіші периодтағы элементтердің металдық және бейметалдық қасиеттері қалай өзгереді?
-
Кіші периодтағы элементтердің оттегі және сутегі бойынша валенттілігі қалай өзгереді?
-
Период бойынша элементтердің қандай қасиеттері өзгереді?
-
Периодтық жүйедегі сілтілік металдар мен галогендердің қасиеттерінің периодты өзгеруін түсіндіру.
Оқушыларға кіші және үлкен период элементтерін салыстыруға дайын түрде беріледі.
Белгілері
Периодтар
кіші
үлкен
Период нөмірлері
1,2,3
4,5,6,7
Элемент саны
2 және 8
18 және 32
Қатар саны
бір
екі
Элемент атомы құрылысының ерекшеліктері
Атомда ішкі қабат электронмен біртіндеп толтырылады. Валенттік электрондар сыртқы энергиялық қабатта орналасады.
Атомда ішкі қабат электронмен біртіндеп толтырылады. Валенттік электрондар сыртқы және астыңғы энергиялық қабатта орналасады.
Период бойынша элементтер қасиеттерінің өзгеру ерекшеліктері
Металдық қасиеті тез кемиді
Металдық қасиеті баяу кемиді (жұп қатарда металдар орналасқан)
Жаңа тақырыпты оқыту. Сөйтіп топ, топша, негізгі топша және қосымша топша туралы түсінікке біртіндеп келеміз. Элементтердің оттегімен қосылыстарындағы жоғары валенттілігінің топ нөміріне сәйкес келетіндігіне көңіл аударамыз.
Жоғары оксидтер мен сутегі қосылыстарының формуласы жазылған кестені көрсетеміз. Сілтілік металдар тобы мен галогендер тобындағы элементтер қасиет- терінің ядро зарядына атом радиусына тәуелді өзгеретінін айта отырып, мынадай қорытындыға келеміз. Негізгі топша элементтердің ядро зарядының артуына байланысты металдық қасиеті артады, бейметалдық қасиеті кемиді.
Бұл бағыныштылыққа тек қана негізгі топша элементтеріне тән екендігін атап көрсету керек. Үлкен периодтағы тақ қатардың элементтерінен құралған қосымша топшада тек металдар ғана орналасқандығына көңіл бөлген жөн.
Қосымша топша элементтерінің атомдарында арттан санағандағы екі қабаты электронға толады, ал сыртқы электрон қабаты негізгі топшаның металдарындай болады. Период және негізгі топша бойынша элементтер қасиеттерінің өзгеруі.
Қасиеттер
Өзгерістер бағыты
Негізгі топшада
Периодтарда
Металдық
өседі ↓
өседі ←
Бейметалдық
өседі ↑
өседі →
Оттек бойынша валенттігі
тұрақты,топ нөміріне сәйкес
1-ден 7-ге дейін өседі
Сутек бойынша валенттігі
тұрақты,8-ден топ нөмірін алғанға тең
4-тен 1-ге дейін кемиді
Ядро заряды
өседі ↓
өседі →
Салыстырмалы атомдық массасы
өседі ↓
өседі →
Осы тақырыпты оқушылар қалай меңгергенін тексеру үшін мынадай сұрақтар қоямыз:
-
Д.И.Менделеев ашқан жаңалығын - заңын неге периодтық деп атады? Жауаптарыңды химиялық элементтердің қасиетін талдай отырып дәлелдеңдер.
-
Период бойынша және негізгі топ бойынша химиялық элементтердің қасиеттері қалай өзгереді? Бұл заңдылықтарды атом құрылысы теориясы тұрғысынан түсіндіріңдер.
Екінші сабақта мына біліктерді қалыптастыруға көңіл аударған жөн:
-
Элементтерді периодтағы орны бойынша салыстыру;
-
Элементтерді қосылыстардың белгілі түрлері бойынша анықтау (оксиді, сутекті қосылысы, т.б.);
-
Нағыз металдар мен бейметалдардың қасиеттерін сипаттау;
-
Оксидтері мен гидроксидтерінің қасиеттерін түсіндіру;
-
Периодтың, топтың, элементтердің реттік нөмірінің физикалық мәнін ашу;
-
Химиялық элементтердің атом құрылысын сипаттау;
Сабақтың басында өткен тақырыптарды қайталау мақсатында оқушыларға төмендегі сұрақтарды қоямыз:
-
Мына элементтердің оксидтерінің формуласын атаңдар:Na,Mg,AI,Si,P,C. Осы элементтердің сутекті қосылыстары бола ма?Олардың формуласы қандай?
-
Мына элементтердің жоғары газ тектес сутегімен қосылыстарының формуласын жазыңдар: германий, мышьяк,теллур, иод.
-
Реттік нөмірі 19 және 29-ыншы элементтерді атаңдар. Олардың қандай ұқсастықтары мен айырмашылықтары бар?
-
Реттік нөмірі 14 және 32-інші элементтерді атаңдар. Олардың қандай ұқсастықтары мен айырмашылықтары бар?
-
ІІІтоп элементі оксидінің с.м.массасы Мr=102-ге тең, ол қай элемент?
-
Қосылысының формуласы Н2Э. Егер ол 5-інші периодта болса, оның с.м.массасы қанша?
-
Кіші периодтардағы металл элементтерді атаңдар. Атомдарының сыртқы қабаттарында қанша электрон саны болады?
-
Кіші периодтардағы бейметалл элементтерді атаңдар. Олардың сыртқы электрон қабаттарында қанша электрон болады?
-
Элементтердің сыртқы қабаттарындағы электрондар неге валенттік электрондар деп аталады?
-
Реттік нөмірлері 7 және 10-ыншы элементтердің атом құрылысының сызба нұсқасын келтіріңдер. Осы элементтердің тобын, топшасын, периодын анықтаңдар. Ол қандай химиялық қасиет көрсетеді?
-
Реттік нөмірі 12, 13, және 16-ыншы элеенттерінің жоғары оксидінің, гидроксидінің формулаларын жазыңдар. Осы қосылыстардың қасиеттері қандай?
-
Оттегі мен селен, литий мен берилий элементтерін салыстырыңдар. Олардың қандай ұқсастықтары мен айырмашылықтары бар?
Оқытудың жоспарланған нәтижесі:Химиялық элементтердің периодтық жүйесіндегі элементтер қасиеттерінің электрон санына тәуелді өзгеруін периодтық заң негізінде түсіндіру. 2-3-інші период элементтерін мысалға алып дәлелдеу. Негізгі топшадағы элемент қасиеттерінің ұқсастығы мен айырмашылығын түсіндіру.
Үйге тапсырма: §58 (1-8). Жұмыс дәптері.
күні айы жылы
№9-ші сабақ тақырыбы: Химиялық элементтің периодтық жүйедегі орны мен атом құрылысы тұрғысынан элемент және оның қосылыстарының сипаттамасы.
Оқыту мақсаты: Периодтық жүйедегі орнына байланысты химиялық элемент және оның қосылыстары жайлы болжам айта білуді қалыптастыру, элемент қасиеттерінің өзгеруіндегі заңдылықтар туралы білімді бекіту. Периодтық жүйедегі барлық элементтер арасында қандай өзара байланыстылық болатындығын көрсету.
Құрал - жабдықтар: Элементтер қасиеттерінің периодты өзгеруі туралы
жасалған кесте. Д.И.Менделеевтің периодтық жүйесі.
Тірек білім мен біліктер: Атомның құрылысы туралы және периодтық жүйені оқыту барысында алған білімдері.
Сабақ барысы: Ұйымдастыру:
Оқушылардың білімін тексеру. Оқушыларға мынадай сұрақтар қойылады:
-
Элементтер периодтық жүйеде қандай белгілеріне қарай орналасқан?
-
Периодтық жүйе қалай құрылған?
-
Периодтық жүйеде атом ядросы зарядының артуына байланысты элементтердің қасиеті қалай өзгереді?
-
4-ші периодтағы нағыз металдар мен нағыз бейметалдарды атаңдар.
-
Периодтық жүйеде неше топ бар?
-
Топтар қалай бөлінеді?
-
Атомның ядро зарядына байланысты топшаларда элементтердің қасиеті қалай өзгереді?
-
І топтағы ең белсенді металды және VII топтағы ең белсенді бейметалды атаңдар?
Жаңа тақырып бойынша түсіндіру:Оқушылар назарын химиялық элементтің периодтық жүйедегі орнына аударамыз. Химиялық элементтің периодтық жүйедегі орнына қарап элемент туралы көп мәлімет алуға болады. Барий элементін мысалға алып, периодтық жүйедегі орнына сай оған сипаттама беру. Жоспар бойынша. Барий тұздарының формуласын құрастырамыз, олардың судағы ерігіштігіне назар аударамыз. Периодтық жүйе дегі орнына сай элемент туралы қанша көп нәрсе айтуға болатындығын атап өтеміз. Осы тақырып бойынша оқушылардың білімдерін бекіту үшін,кез келген элементке сипаттама берудің үлгі жоспарын ұсынамыз:
-
Элементтің периодты жүйедегі орны.
а) реттік нөмірі;
ә) периоды, қатары;
б) тобы, топшасы;
в) атомдық массасы;
2. Элементтің атомдық құрылысы.
а) атом ядросының заряды;
ә) атом құрамының формуласы (р,п,е сандары);
б) энергиялық деңгейлер саны және онда электрондардың орналасуы (е);
в) электрондық формуласы(1s2,2s….);
г) кванттық ұяшықтар;
д) сыртқы қабаттағы электрон саны=>металл немесе бейметалл;
3. Элементтің жоғары валенттілік көрсететін қосылыстарының формуласы.
а) оксидтері;
ә) гидроксидтері;
б) ұшқыш сутекті қосылыстары;
4. Химиялық қасиеті.
а) оксидінің (негіздік,екідайлы, қышқылдық);
ә) гидроксидтері (негіз, екідайлы,қышқыл);
5. Элементті көрші элементпен салыстыру.
а) период бойынша;
ә) топ бойынша; (металды бейметалмен салыстыруға болмайды).
Оқушылардың білімін бекіту. Оқушыларға төмендегі кестенің оң жағын толтырту арқылы бүгінгі өтілген сабақты қорытындылаймыз.
Периодтық жүйенің атом құрылысы теориясымен байланысы
Түсініктер мен заңдылықты атом құрылысы теориясы тұрғысынан түсіндіру
Мысалдар.
1 Элементтің реттік нөмірі және ядро заряды атомдағы электрон санына сәйкес келеді.
2. Период нөмірі берілген элемент атомының энергиялық деңгейінің санына сәйкес, яғни атомдағы энергия қабатының мөлшері сан жағынан элемент орналасқан периодтың нөміріне тең.
3. Элементтердің химиялық қасиетінің периодты өзгеруі электрондардың энергиялық деңгейде периодты орнала суына байланысты. Элемент атомының ядро зарядының өсуіне байланысты бірдей валентті электрон бар эле менттер периодты түрде қайталанады.
4.Элементтердің жоғары оксидтерінде валенттіктерінің өсуі сутекті қосылыстарында кемуі (периодта солдан оңға қарай) ішкі энергиялық қабатта электрон санының өсуімен түсіндіріледі.
5. Периодта солдан оңға қарай ядро заряды біртіндеп өседі, ядро мен валенттілік электрондардың ара қашықтығы кемиді. Осыған орай электрондарды беріп жіберу қиындап, металдық қасиет әлсіреп бейметалдық қасиет күшейеді.
6. Элементтің жоғары оксидтегі валенттілігі сыртқы электрон қабатындағы электрон санына, топ нөміріне сәйкес болады. Ал сутекті қосылысында валенттілігі сыртқы электрон қабатын аяқтауа жетіспейтін элек трон санымен анықталады.
7. Негізгі топтың элементтерінде атомдық массаның өсуіне қарай (жоғарыдан төмен қарай) валенттілік электрон мен ядроның ара қашықтығы ұлғаяды, сондықтан элементтің электрон беру қабілеті мен металдық қасиеті артады. Негізгі топ элементтерінің сыртқы электрон қабатындағы электрон саны топтың нөміріне сәйкес келеді.
Н атрий элементінің реттік нөмірі-11. Атомның ядро заряды - 11, оның айналасында теріс зарядты 11 элетрон орналасады.
атрий элементінің реттік нөмірі-11. Атомның ядро заряды - 11, оның айналасында теріс зарядты 11 элетрон орналасады.
Кальций элементі 4-ші периодта орналасқан. Оның атомында электрондар 4-ші энергиялық деңгейде орналасқан.
Азоттан фосфорға, одан мышьякқа қарай қасиеттердің периодты қайталануы, осы элементтердің сыртқы энергиялық деңгейінде 5 электроннан орналасуымен, яни сыртқы энергиялық деңгейде электрон санының қайта лануымен түсіндіріледі.
Кремний элементінен (ішкі қабатта 4 электрон) фосфор элементіне қарай (ішкі қабатта 5 электрон) жоғары оксидтерінде валенттілік 4-тен 5-ке дейін, сутекті қосылыстарында 4-тен 3-ке дейін кемиді.
ІІІ периодта натрийден (Na →СІ) хлорға қарай металдық қасиет азайып бейметалдық қасиет басым болады. Мұндай заңдылық барлық периодта сақталады.
Хлор элементі VII-топта, сыртқы электрон қабатында 7 электрон орналасқан. Осыған орай хлордың жоғары оксидінде валенттілік VII, ал сутекті қосылысында-1.
4-ші топтың негізгі топшасындағы көміртегі элементті бейметалл, ал ең төменгі қорғасын - металл.
Үйге тапсырма: §59.(1-7). Жұмыс дәптері.
күні айы жылы
№10-ыншы сабақтың тақырыбы: Д. И. Менделеевтің ғылыми жетістігі.
Периодтық заңның маңызы.
Сабақтың мақсаты. Химия ғылымының және өндірістің қазіргі мәселелерін шешудегі периодтық заңының маңызын көрсету. Оқушылардың периодтық жүйе және периодтың заң туралы білімдерін жүйеге келтіру.
Құрал - жабдықтар: «Д. И. Менделеевтің өмірі мен ғылыми қызметі».
Сабақ барысы: Ұйымдастыру:
Сабақты оқушылардың өздігінен жұмыс істеуін бастаған жөн.
І. Мына элементтердің гидроксидтерінің формуласын жазыңдар.
а) калий, рубидий, цезий; ә) барий, стронций, магний;
2. Кайсы топтың негіздері күшті болады. Жауаптарынды түсіндіріңдер
Ары қарай оқушыларға Менделеевтің периодтық заңы мен периодтық жүйесінің химияны дамытудағы, элементтерді бір жүйеге келтіріп жіктеудегі маңызын түсіндіру мақсатында мынадай сұрақтар қойылады:
1. Қазіргі кезде неше химиялық элемент белгілі.
2. Химиялық элементтің қасиеті немен анықталады?
3. Элемент атомының құрылысы қандай?
4. Элементтердің топша бойынша қасиеттерінің ұқсас болуы немен анықталады ,,,,,,,,,, және олардың металдық, бейметалдық қасиеттері қалай өзгереді.
5. Период бойынша элементтердің қасиеті қалай өзгереді?
6. Элементке сипаттама беру жоспары бойынша реттік нөмірі 20 және 6-ыншы ,,,,,,,,,,,элементтеріне сипаттама бер. Осы элементтер оксидтері берілген заттың ,,,,,,,,,,қайсысымен әрекеттеседі: НСІ, NaOH?
Жаңа материалды баяндауды мына жоспар бойынша жүргіземіз:
1. Периодтық заң - химиялық элементтер жайындағы барлық білімнің қорытындысы.
2. Д. И. Менделеевтің периодтық жүйе негізінде элементтердің атомдық массасын өзгертуі.
3. Ашылмаған элементтерді алдын-ала сипаттау және периодтық заң мен период тық жүйенің (атомдық массасын) негізгі даму кезеңдері.
4. Физиктердің периодтық заңға сүйене отырып атомның күрделі құрылысын ашуы, зат қасиетінің оның атомдық немесе молекулалық құрылысына тәуелділігін анықтауы.
5. Периодтық заңның маңызына Ф. Энгельстің А. Ферсманның және Г.Сиборгтың берген бағасы.
6. Периодтық заңның философиялық маңызы.
Осы аталған сұрақтарды шешуді мынадай бірізділікпен жүргіземіз.
1. Д. И. Менделеевтің ашқан периодты заңы мен соған негізделе отырып 1869 жылы жасалған периодтық жүйе химиялық элементтердің алғашқы екпінді ғылыми жіктелуі болып саналады. Соның нәтижесінде азғана химиялық элементтерін, түзілген сан алуан химиялық қосылыстарды бір жүйеге келтіруге және оларды одан ары қарай оқып үйренуге мүмкіндік туды. Периодтық заң химиялық элемент жайындағы барлық білімді қорытындылады, бір жүйеге келтірді.
2. Д. И. Менделеев өзінің ашқан периодтық заңында көптеген элементтердің атомдық массасы дұрыс емес деді және оларды химиялық қасиеттері бойынша өз орындарында орналастырып, теория жүзінде атомдық массасын қайта жөндеді. Ол мысалы, мына 10 элементтің атомдық массасын жөндеді: Берилий, титан, иттрий, индий, цезий, празеодим, эрбий, торий, уран. Одан кейін көптеген ғалымдар периодты жүйеге сүйене отырып 20 элементтің атомдық массасын қайта жөндеді.
3. Д. И. Менделеев өз кестесін құрастырғанда ондағы көптеген элементтер әлі ашылмаған еді. Мысалы, қазір 4 - қатарда орналасқан 21-інші скандий элементі ашылмаған еді. Атомдық массасы бойынша Са - ден кейін осы қатарда титан келеді, бірақ оны кальцийден кейін орналастыру мүмкін емес еді. Себебі онда ол ІІІ топта орналасқан болар еді. Ал, титан IV валентті және басқа қасиеттері жағынан да ІІІ топта емес, ІV топта орналасу керек еді. Сондықтан Д. И. Менделеев бір торкөз тастады, яғни кальциймен титан арасында бос орын қалдырды. Сол сияқты 5 - қатарда мырыш пен мышьяк арасында 2 торкөз қалдырылды. Ал, қазір ол торкөздерде гелий мен германий орналасқан. Периодтық жүйедегі тағы да басқа қатарларда бос орындарда қалдырылды. Ол кезде реттік нөмірі 21,31,32,43,61,75,85,87 - элементтер белгісіз еді.
Д .И. Менделеев периодтық жүйеде бос орындар қалдыра отырып, табиғатта осы орындарды толтыратын элементтер болуы тиіс деген пікір айтты және олардың ашылатынына сенді. Сол ашылуға тиіс болған элементтердің қасиеттерін көрші элементтерге қарай периодтық заңға негіздей отырып, алдын ала сипаттап берді. Мысалы, ол алдын ала скандий, галий, германий, т.б. элементтердің қасиеттерін өте дәл анықтап берді. Д. И. Менделеевтің қасиеттерін, орнын алдың ала айтып берген элементтері көп кешікпей ашылды.
Мысалы 1875 жылы француз химигі Лекок - де Буабодран Д. И. Менделеевтің «Экваалюминий» деп сипаттап берген галий элементін ашты. 1873 жылы швед химигі Нильсон Менделеевтің алдын ала сипаттап берген 2-ші элементті - скандийді ашты, оның қасиеті Менделеевтің «экабор» деп аталған элементіне сәйкес келеді. Ал 1896 жылы неміс оқымыстысы Винклер Менделеев сипаттаған 3-інші элементті германийді
ашты. Оқушыларға 33-кестедегі Менделеев сипаттаған Экасилиций қасиетін тәжірибе арқылы ашылған германийдің қасиетіне салыстыру ұсынылады.
Д.И.Менделеевтің алдын ала айтқан элементтерінің үш елде ашылуы оның айтқандарының соншалықты дәл, таңқаларлықтай екендігін көрсетеді, бұл периодтық заңның маңызын арттырды.
1894-1898 жылдары ағылшын оқымыстылары Рэлей мен Рамзайдың инертті газдарды ашуы периодтық жүйе үшін зор сынақ болды (1894 жылы аргон, 1895 жылы гелий, 1898 жылы неон, криптон, ксенон ашылған). Инертті газдардың ашылуы периодтық жүйенің мәнін тереңдете түсті, себебі белсенді металдар мен бейметалдар арасында инертті газдар орналасты. Инертті газдар ашылған соң периодтық заңды бүкіл әлем моиындады.
Д.И.Менделеевтің өзі Вильям Рамзайды периодтық заңды бекітушілердің бірі деп санады. Ол He,Ne,Ar,Kr,Xe-ды ашты, олардың атомдық массасын анықтады, ол сандар периодтық жүйенің талабына сай келді.
4. Периодтық заң ашылмаған элементтерді іздеудегі жол көрсетуші жұлдыз болды. Ғылымның дамуына байланысты ғалымдар химиялық элементтерді жасанды түрде шығара бастады.Периодтық жүйеге сүйене отырып физиктер атомның ішкі құрылысын ашты, атом молекулалар қасиетінің құрылысына тәуелділігі анықталды. Атом құрылысын оқып үйрену периодтық жүйені терең түсінуге мүмкіндік берді. Элементтердің периодтық жүйедегі орны мен атомдарының құрылысы арасында байланыстың болатындығы анықталды. Қазірдің өзінде де периодтық заң және периодтық жүйе ғылымның терең сырларын түсінуге мүмкіндік береді.
5. Атом құрылысындағы барлық жаңалықтар периодтық заңды тереңдетті, дамытты, себебі ол табиғаттың жеке заңы емес, оның жалпы заңдарының бірі. Ол тек химия мен физиканың ғана емес басқада жаратылыстану ғылымдарының жаңалық прогресінің бұлағы болады.
6. Периодтық жүйе химиялық элементтердің дамуының диалектикалық сипатын көрсетеді, онда диалектикалық материализмнің барлық заңдылығы көрінеді.(қарама-қарсылықтың бірлігі мен олардың арасындағы күрес, сандық өзгерістен сапалыққа көшу, терісті терістілеу, өзара байланыс және өзара себептілік заңдылықтары).
Периодтық заң мен периодтық жүйеде философиялық материализмніңт сипаты өз орнын табады, яғни табиғаттың танымдылығы.
Үйге тапсырма: §60 оқу.
Баяндамалар тақырыбы:
-
Д.И.Менделеевтің балалық және жастық шағы.
-
Педагогтық және ғылыми қызметі.
-
Периодтық заңның ашылу тарихы.
-
Периодтық заңның бекітілуі және жеңуі.
-
Д.И.Менделеев жайында замандастарының еске алуы.
-
Д.И.Менделеев еңбегіне шетелдіктердің көзқарасы.
-
Д.И.Менделеевтің периодтық заңы - жаңалықтар және техникалық прогрестің бұлағы.
-
Д.И.Менделеевтің өмірі мен қызметі.
VІІ тарау. Химиялық байланыс. Заттардың құрылысы.
№1 сабақтың тақырыбы: Химиялық элементтердің электртерістігі.
Сабақтың мақсаты: Оқушыларға атомдардың электртерістігі туралы және осы түсінік негізінде химиялық байланыстың түзілу табиғатын түсіндіру. Период және негізгі топша бойынша элементтердің электртерістігінің өзгеруімен таныстыру.
Құрал-жабдықтар: Химиялық элементтердің периодтық жүйесі, «Элементтердің салыстырмалы электртерістігі» кестесі.
Тірек білімі мен бірліктер. Физика мен химия курсынан атом құрылысы мен электрон туралы білім. (Ядро құрамы мен электрон заряды мен атом ядро құрамына кіретін бөлшектер, электрондық жұптасуы туралы түсінік)
Сабақ барысы: Оқушылардың атом құрылыс туралы білімін төмендегі сұрақтар негізінде пысықтаймыз.
-
Атом қандай бөлшектерден тұрады?
-
Электронның заряды қандай?
-
Химиялық байланыс қандай жағдайда түзіледі?
-
Атом құрылысы тұрғысынан элементтердің металдық және бейметалдық қасиеті немен анықталады?
Жаңа материалды оқыту: Электртерістік дегеніміз не?
1. Атомдардың басқа басқа элемент атомдарымен қосылысында көрсететін қасиеті;
2. Элемент атомының ядро заряды мен атом радиусына байланысты басқа элементтерден электрондарды өзіне тартып алу қасиеті;
Электртерістілік түралы түсінік - оқушыларға хим/байланыстар табиғатының мәнін түсінуге және ұғынуға көмектеседі. Электртерістіліктің абсолюттік мәні іс жүзінде қолдануға қиын тиетін сандармен анықталады, сондықтан ол салыстырмалы сандармен анықталады. Электртерістілік қатарымен таныстыру:
F,O,N,CI,Br,S,C,Se,I,P,As,H,B,Si,Sb
Солдан оңға қарай электртерістілік кемиді. →
Металдар үшін электртерістіктің мәні екіден кем, ал бейметалдар үшін екіден жоғары. Период бойынша солдан оңға қарай электртерістік артады, ал негізгі топшада төменнен жоғары қарай артады. Осыған орай периодтық жүйеден кез келген екі элементтің қайсысының электртерістілігі күшті екенін айтуға болады.
ә) Элементтердің металға немесе бейметалға жататынын олардың атомдарының элек трондарды беру не қосып алу қабілеттеріне байланысты анықталады;
б) атомдары электрондарын оңай беретін элементтер күшті бейметалдық қасиет көр сетеді.
в) негізгі топшада жоғарыдан төмен қарай, яғни салыстырмалы атомдар массаларының өсуіне байланысты энергетикалық деңгейлер саны артады және ядродан валенттік электрондары атомнан оңай бөлініп шығады.
Электртерістілік түсінігін пайдалана отырып атомдар арасындағы химиялық әрекеттердің үш түрлі жағдайын түсіндіру:
1. Химиялық реакция - электртерістілік мәні өте алшақ элементтердің арасында жүреді, яғни сілтілік металдар мен галоген атомдарының арасында .
2. Химиялық реакция - электртерістілік мәні бірдей элемент атомдары арасында жүреді. Бұндай әрекеттесу бірдей атомдардан тұратын газ молекулалары арасында болады. Мысалы: H2, CI2
3. Химиялық реакция - электртерістілік мәні шамалас болатын элементтер атомы арасында жүреді. Мысалы: H2S, HCI
Оқушылардың білімін бекіту үшін тапсырмалар жұмыс дәптерінен беріледі.
Үйге тапсырма беру: §61 1-2 жаттығуларды орындау.
№2 сабақтың тақырыбы: Химиялық байланыстың негізгі түрлері. Ковалентті полюсті және полюссіз байланыстар.
Сабақтың мақсаты: І-ІІІ период элементтерінің атомдарындағы электрондардың орналасуы туралы білімін бекіту. Атом құрылысының белгілі заңдылықтары негізінде химиялық ковалентті байланыстардың түзілу мәнін таныстыру, ковалентті байланысқан жай заттардың электрондық формуласын құру білігін қалыптастыру.
Құрал-жабдықтар: Д.И.Менделеевтің периодтық жүйесі, интерактивті тақта. «Химиялық байланыстардың түрлері», «Химиялық байланыстың түзілуі кестесі атом құрылысының үлгілері».
Оқушылардың білімі мен білігін тексеру. Сыныптағы бірнеше оқушыға жазбаша сұрақтар беріледі (карточка түрлері).
-
Электртерістілік дегеніміз не?
-
Натрий мен фтор атомының құрылыс сызбанұсқасын сызып көрсет. Олардың химиялық автивтілгін қалай түсіндірсең?
-
Металл, бейметалл, инертті элементар атомдарының құрылыс ерекшелігі неде?
-
Аяқталған және аяқталмаған электрондық қабат нені білдіреді?
-
Период және негізгі топша бойынша элементтердің қасиеттері қалай өзгереді? Осы өзгерістердің себебі неде?
Жаңа материалды оқыту. Ковалентті байланыстың екі түрлі үлгісін ұсынамыз.
Химиялық байланыстың түзілуі.
Байланыс түзуші бөлшектер
Әр түрлі химиялық байланыстың түзілуі
Байланыс қалай түзіледі
Химиялық байланыс түрлері
Әр түрлі химиялық байланыстағы заттар
Бейметалл атомда рының бір түрі
Бейметалдардың әр түрлі атомдары
Металдармен бейме- талдар атомда ры
Н·+·Н→Н:Н
:СІ·+·СІ:→:СІ:СІ:
Н·+СІ:→Н:СІ:
Nа·+·СІ:→Nа+(:СІ:)-
Электрондардың жұптасуы арқылы
Электрондардың жұптасуы арқылы
Металл атомдарынан бейметалл атомына электронның ауысуы және түзілген иондары -ның лектростатикалық тартылуы арқылы
Ковалентті полюссіз
Ковалентті полюсті
Ионды
Н2, СІ2, О2, Вr2, F2, N2
НСІ, НВr, НY, Н2S, т.б.
NaCI, NаF, К2S, Li2О, NаВr т.б.
Кестені толтыру барысында оқушы төмендегі жағдайға ерекше көңіл аударуы керек: химиялық әрекеттесу кезінде электрон атомдары дара электрондық жұптасу есебінен электрондық сыртқы қабатын аяқтап, тұрақты электрондық құрылысқа көшеді. Яғни атомдар 8 н/е 2 электроннан тұратын тұрақты конфигурация түзуге тырысады. Жалпы электрон жұптарының саны атомдардың сыртқы энергитекалық деңгейшедегі дара электрон сонымен анықталады. Галогенсутектері (НСІ, НВr) молекуласындағы ковалентті полюсті байланыстың түзілуі электрондық тығыздықтың ығысуымен түсіндіріледі.
Одан әрі электрондық формула құрудың алгоритімімен таныстыру.
-
Сәйкес келетін атомдардың химиялық таңбасын тізіп жазу.
-
Элементтің периодтық жүйедегі орнын (қай топқа) табу.
-
Берілген элементтің орналасқан тобына сәйкес валенттік электрондардың санын белгілеу.
-
Нүктелер арқылы элемент атомдарындағы дара электрондардың жалпы санын белгілеп, электрондық қабатын аяқталуына неше электрон жетпейтінін анықтау.
-
Әр атомның химиялық таңбасының айналасына нүктелеріне қалған электрондарды белгілеу.
Н2, СІ2, О2, N2 элементтерінің электрондық формуласын жазып болған соң, осы формуладағы нүктелермен көрсетілген элетрон жұптарын сызықшамен ауыстырса құрылымдық формула алынатынын түсіндіру. Тақтаға және дәптерге төмендегіше жазылады:
Электрондық формула: Құрылымдық формула:
Н:Н :СІ:СІ: :О:О: :N:N: Н:СІ: Н-Н, СІ-СІ, О=О, N-N, Н-СІ
Ковалентті полюсті байланысты малекуланың құрылымдық формуласында электрон тығыздығының бір атомынан өткінші атомға ығысуын бағдаршамен көрсетеді. Электрон тығыздығын өзіне тартатын электрон элемент атомы ішінара теріс зарядталады. Ал өзінен ығыстыратын элемент атомы ішінара оң зарядталады. Мысалы: Н+→СІ-
Оқушылар білімін тексеру үшін төмендегідей тапсырма беріледі:
1. О2 мен НF молекулаларының электрондық формуласын салыстырыңдар. Ұқсастығы мен айырмашылығы неде?
2. Вr2, Н2S, NН3 малекуласының электрон тығыздығы ығысуы мен ішінара зарядталуын көрсетіп, электрон дық және құрылымдық формуласын жаз.
3. Н2О, СО2, N2, NН3, О2, Н2S, НF, F2, СІ2 заттары берілген. Көрсетілген заттардың қайсысы ковалентті полюсті, қайсысы ковалентті полюссіз байланысқан.
Үйге тапсырма. §62 Жұмыс дәптерінен жаттығулар орындау.
№3 с а б а қ т ы ң т а қ ы р ы б ы : Иондық байланыс.
С а б а қ т ы ң м а қ с а т ы : Оқушылардың ковалентті байланыстың түрлері, элемент атомдарының терісэлектрлік түсінігін қолданудағы шеберлігі мен дағдыларын арттыру. Ионды байланыс табиғаты туралы түсінік беру. Ионды қосылыстар түзілуінің сызбанұсқасы мен химиялық реакция теңдеулерін құруға үйрету.
Қ ұ р а л - ж а б д ы қ т а р : «Химиялық байланыстар», «Ионды байланыс» интерактивті тақтадан көрсетілетін көрнекілік.
Ж а ң а м а т е р и а л д ы б а я н д а у . Бұл сабақ өткен сабақтың жалғасына жатады деуге болады. Оқушылардан ковалентті полюсті және полюссіз байланыстардың қалай түзілетіні элементтердің терісэлектрлік ұғымы туралы сұралып, ионды байланысты қарастыруға кірісеміз. Ол үшін мына жағдайды сипаттаймыз:
-
Ионды байланыс - терісэлектрлік мәні бір-бірінен өте алшақ элемент атомы арасында түзіледі (бірінші жағдай). Бұл кезде терісэлектрлігі нашар элементке терісэлектрлігі күшті элементтер атомынан электрондар түгелдей өтуі арқылы жүреді. Өзінің сыртқы қабатындағы валенттік электрондарын толық беріп жіберетін атомдар оң зарядты ионға, ал осы электрондарды қосып алатын атомдар теріс зарядты ионға айналады. Оқушыларды қатыстыра отырып ионға анықтама беріп, атомның ионға айналу процесін былай көрсетеміз:
+11Na0 2e-, 8e-, 1e- + F 2e-, 7e- → Na+F-
 e
e
Na0 + F → Na+F-
Қарама-қарсы зарядталған бөлшектердің бірін-бірі тартатыны оқушыларға физика курсынан белгілі. Соны еске түсіре отырып, ионды байланысқа анықтама береміз. Ионды байланысты заттарға мысалдар: NaCl, KCl, NaF, K2O, Li2O, MgCl2.
Оқушылардың назарын төмендегі жағдайға аударамыз. Атом қанша электрон берсе не қанша электронды қосып алса, түзілген оң және теріс ион заряды да сонша болады. Ион заряды элемент таңбасының оң жағына қойылады:
Na+, Cl-, Mg2+, Al3+, Ca2+, S4+.
Оқушылардың білімі мен іскерлігін бекіту. Әр түрлі байланыстардың түзілуі механизмінің негізгі теориялық маңдайын ұғу және түсіну үшін төмендегі жаттығуларды орындату қажет:
-
Төменде көрсетілген заттардың ковалентті полюсті, ковалентті полюссіз және ионды байланысты заттардың формулаларын теріп, бөліп жаз: H2, РН3, NaI, ZnF2, Br2, H2S, H2O, CaCl2, HBr, O2, N2, AlCl3.
-
Натрий хлориді мен хлорсутегі молекулалары мысалында ионды және ковалентті полюсті байланыстар түзілуінің ұқсастығы мен айырмашылығын белгілеңдер.
-
Галогенсутектері қатарында НҒ, НСl, HBr байланыстың полюстілігі қалай өзгереді? Жауабыңа түсінік бер.
-
Төмендегі қосылу реакциясы теңдеуін құрастыр және металл атомынан бейметалға қанша электрон өткенін белгіле:
а) Li + O2 → б) Cs + S →
ә) Ca + F2 →в) Na + F2 →
-
Төмендегі элементтер атомы мен ионның құрылысын салыстыр:
Na+ және Na0 Mg2+ және Mg0 N3- және N0
S2- және S0 S2- және S0
Ү й г е т а п с ы р м а б е р у: §61 3-4 жаттығуларды орындау
№4сабақтың тақырыбы: Кристалл торлары.
Сабақтың мақсаты. Оқушыларға молекулалық, атомдық және иондык кристалл торлары туралы түсінік беру, заттардың қасиеттері кристалл торлардың түріне байланысты екенін және кристалл торлардың әр түріне химиялық байланыстың қандай түрі сәйкес келетінін түсіндіру.
Қ ұ р а л - ж а б д ы қ т а р: Натрий хлоридінің, графиттің, алмаздың кристалл торларының үлгілері. «Кристалл торларының түрлері»т.б.таблицалар.Интерактивті тақта
Сабақ барысы: Сабақ үй тапсырмасын тексеруден басталады:
1. Мына косылыстардағы байланыстардың түрін анықта: MgCI2,Br2, HCI, CCI4, NaCI, SO2.
2. Мына қосылыстардың қайсысында иондық байланыс бар: калий хлориді, фосфор (V) оксиді, күкіртсутегі, натрий фториді.
Жаңа сабақты түсіндіру. Қатты заттарды кұрайтын бөлшектердің қатаң заңдылықпен орнала- сатынын рентген сәулесінің жәрдемімен зерттеп, дәлелденгендігін айту. Ион, атом немесе молекула күйіндегі бөлшектер кеңістікте белгілі бір қашықтықта, түйіндерде орналаса отырып, кристалл торларды құрайды. Осындай зандылықпен белгілі бір қашықтықта орналасқан кристал дардың бөлшектері кезектескен кәдімгі. торлардың құрылысын еске түсіреді. Осыдан барып «кристалл торлары» деген ат қалыптасады. Осы кристалл тордың түйінінде қандай бөлшектердің орналасуына байланысты, иондық, атомдық және Молекулалық кристалл торлар деп бөлінеді.
Иондық, атомдық және молекулалық кристалл торларына сипаттама беріледі. Көрсетілген байланыстың түрлеріне мысал келтіру және физикалық қасиеттеріне сипаттама беріледі.
Оқушылардың берген жауабын жүйеге келтіріп, төмендегі кестені толтыру.
Кристалл торлардың түрлері
Кристалл торларға сипаттама
Торлардың түйіндеріндегі бөлшектер
Түйіндердегі бөлшектердің бір - бірі не әсері
Химиялық байланыстың түрлері
иондық
иондар
электростатыкалық
иондық
атомдық
атомдар
Ковалентті (өте берік)
Ковалентті полюссіз
молекулалық
молекулалар
Вандер-ваальс (әлсіз)
Ковалентті полюсті, полюссіз
Төмендегі кестенің көмегімен оқушыларға заттардың физикалық қасиеті кристалл торларының түріне тәуелді екенін түсіндіру.
Кристалл торларының физикалық қасиеті
Кристалл торларының түрлері (заттар)
Балқу t - сы
Қайнау t - сы
Тығыздығы, г/см3
Қасиеті
1.Иондық
NaCI
NaF
8000
9950
14000
15000
2,2
3,2
Қатты заттар, полюсті молекулалардан тұратын сұйықтықтарда ериді.
2.Атомдық
С - алмаз
Si - кремний
Ge - германий
35000
14280
9370
42000
26000
27000
3,51
2,33
5,32
Өте қатты.
Қаттылығы жоғары. Қаттылығы орташа.
3.Молекулалық
F2
CI2
Br2
I2
HF
HCI
HBr
HI
-223
-100
-7,2
113,5
-114,2
-92
-87
-50,8
-187
-34
58,75
184,5
-99,9
-84,9
-66,7
-35,3
1,11
1,56
3,12
4,93
0,98
1,19
2,16
2,8
Газ тәрізді немесе ұшқыш заттар.
( кристалл торларының серіктігі фторға қарай төмендейді)
Молекулалық кристалл торлы заттар қаттылығының төмендігімен, ұшқыштығымен, қайнау ж/е балқу температураларының төмендігімен ерекшеленеді. Оқушылардың білімін бір жүйеге келтіру үшін мынадай сұрақтар қоямыз:
1. Иондық молекулалық және атомдық кристал торлардың бір-бірінен айырмашылығы неде?
2. Иондық кристалл торлы заттардың физикалық қасиеттері қандай?
3. Атомдық,молекулалық кристалл торлы заттардың физикалық қасиеттері қандай?
4.Кристалл торларының әр түріне екіден мысал келтір.
Үйге тапсырма беру: §63. 1-3 жаттығулары. Жұмыс дәптерінен тапсырма.
№5-6 сабақтың тақырыбы: Тотығу дәрежесі. Тотығу-тотықсыздану реакциясы.
Сабақтың мақсаты:Тотығу дәрежесі. Тотығу - тотықсыздану реакцияларын жазу дағдысын қалыптастыру.
Сабақтың барысы: Зат құрылысы жайлы сұрақтар қойылады.
-
Кристалдық торлар түрін атап беріңдер.
-
Қандай кристалдық торлар ең мықты? Неге?
-
Тор түйіндері деген не? Иондық кристалл торлы заттардың қасиеті қандай болады?
Жаңа сабақ: Әуелі бинарлы қосылыстардағы AI2+3O3-2 тотығу дәрежесін анықтауды одан соң күрделі заттағы H2+1C+4O3-2 элементтің тотығу дәрежелерін анықтауға жаттығу жасайды. Оқушыларға мына заттардың формулаларындағы элементтердің тотығу дәрежесін анықтайды:H2SO4, MnCI2, MgSO4,SiO2, CuO,HMnO4,K2Cr2O7.
Жаттығулар орындау. 1. Мына қосылыстардағы хлордың:HCI,CI2,HCIO, HCIO2, HCIO4 тотығу дәрежелерін анықтаңдар.
2. Мына қосылыстардағы фосфордың:PH3,HPO3,H3PO4,H3PO3 тотығу дәрежелерін анықтаңдар.
3. Мына қосылыстардағы күкірттің: H2S,ZnS,SO2, H2SO3, H2SO4 тотығу дәрежелерін анықтаңдар.
Екінші сабақ алдына мынадай сұрақтар қойылады:
-
Қандай жағдайда химиялық элементтер оң, теріс, нөл тотығу дәрежесін көрсетеді?
-
H2,HCI,H2O,F2,PCI5 қосылысындағы элементтердің тотығу дәрежесін анықтаңдар.
-
Иондық,атомдық және молекулалық кристалл торлы заттардың физикалық қасиеттері қандай? Оксидтер тақырыбындағы тотығу деген сөздің мағнасын еске түсіру. Реакциялардың бәрі ТТР-на жатпайды, тек теңдеуде тотығу дәрежелері өзгеретін элемент атомдары болса, ондай теңдеулер ТТР - на жатады. Енді оны заттың құрылысы тұрғысынан қарастыру қажет. Магнийдің күкіртпен әрекеттесуін қарастырамыз: Mg0 + S0 = Mg+2S-2
ЭБТ құру арқылы теңдеуді теңестіру: Mg0 - 2е = Mg+2 тотығады
S0 + 2е = S-2 тотықсызданады
Mg-тотықсыздандырғыш, S -тотықтырғыш, Магний сульфидіндегі +2,-2 тотығу дәрежесінің мәні айтылады.
Солдан оңға қарай ТД өсетін болса,элемент атомдары тотықсыздандырғыш (ТСШ) қасиет көрсетеді: -4, -3, -2, -1 ,0, +1, +2, +3, +4, +5,+6
Оңнан солға қарай ТД кемитін болса, элемент атомдары тотықтырғыш (ТТШ) қасиет көрсетеді:
Оқушыларға тотықтырғыш,тотықсыздандырғыш ұғымдарының анықтама сын,тотығу-тотықсыздану реакциясының мәнін түсіндіру. Тотығу-тотықсыздану реакциясының теңдеуін құру алгоритмі берілген кесте ілініп, оқушылар жаттығу жұмысын орындайды. Алгоритмі:
-
Химиялық теңдеуді құру.
-
Теңдеудің оң және сол бөлігіндегі барлық элементтердің тотығу дәрежесін анықтап, оны жазу.
-
Тотығу дәрежесі өзгерген элементті табу.
-
Электрондық баланс теңдеуін құру.
-
Химиялық теңдеуге коэффициенттерін қою.
-
Теңдеудің оң және сол бөлігіндегі оттегінің саны бойынша коэффициенттің дұрыс қойылғандығын тексеру.
-
Тотықтырғышты, тотықсыздандырғышты, тотығу - тотықсыздандыру процесін анықтау.
Сабақты пысықтау мақсатында жаттығулар орындау.
-
Тотығу - тотықсыздану реакцияларының теңдеулерін құру:
AI + S = H2S + O2 = PbO + H2 = AI + Br2 =
2. ТТР теңдеулерінің коэффициенттерін қойыңдар.H2S + CI2 = HCI + S ; HNO3 + Cu = Cu(NO3)2 + NO2 + H2O;
Үйге тапсырма беру: §64. 5-6-7 жаттығуларын орындау.
№7 сабақтың тақырыбы: Заттардың құрылысы, химиялық байланыстар, тотығу дәрежесі, тотығу-тотықсыздану реакциясы тақырыбына бақылау жұмысы.
Сабақтың мақсаты: Оқушылардың осы тақырыптар бойынша білім, білік және дағдыларын тексеру үшін бақылау жүргізу.
Бақылау жұмысы:
1 - нұсқа.
1- есеп. Берілгені: CI2, NaCI, C, H2O, CO2, SiC, CaCI2
а) осылардан атомдық, иондық молекулалық кристалдық торға сәйкес қосылыстарды бөліп жазыңдар.
ә) осылардан иондық,ковалентті полюсті,ковалентті полюссіз байланыстарға сәйкес қосылыстарды бөліп жазыңдар.
б) осы қосылыстардың тотығу дәрежелерін анықтаңдар.
2-есеп. Төмендегі реакция теңдеуін тотығу - тотықсыздану реакциясы тұрғысынан теңестіріңдер.
K + CI2 = KCI
Fe + CI2 = FeCI2
Mg + O2 = MgO
2 - нұсқа.
1.Мына заттардың: хлор, бромсутек, натрий хлориді, калий сульфиді, күкіртсутек, формуласын жазыңдар және иондық байланыстағы қосылысты бір сызықпен, ковалентті полюссіз байланыстағын екі сызықпен,ал ковалентті полюсті байланыстағын ирек сызықпен сызыңдар.
2. Хлор және су молекуласының түзілу сызбанұсқасын бейнелеңдер. Ондағы байланыс түрлері қандай?
3.Мына элементтер: AI0, AI3+, CI0, CI - атомдардан иондарға айналады, олардың түзілу процесін қалай бейнелеуге болады?
4. Төмендегі реакция теңдеулерін тотығу - тотықсыздану реакциясы тұрғысынан теңестіріңдер.
СІ2 + КІ = KCI + I2
Na + H2O= NaOH + H2
3 - нұсқа.
1.Егер: а) элемент атомында 3 электрондық қабат болып, ең сыртында электрон саны бес
болса;
ә) элемент атомында 13 протон болса қай элементтер жайында сөз болғаны? Бұлар өзара әрекеттесе ме? Өзара қандай химиялық байланыс түзетінін тауып, оны сызбанұсқа түрінде көрсетіңдер.
2. Мына қосылыстардағы: SO2, CaCI2, AI2O3, CuCI, FeS, Br2 элемент атомдарының тотығу дәрежесін анықта, атомдар арасындағы байланыс түрлері қандай?
3. Мына элементтер:Br0,Br -,N0,N3+атомдардан иондарға айналады,олардың түзілу процесін қалай бейнелеуге болады?
4. Төмендегі реакция теңдеулерін тотығу - тотықсыздану реакциясы тұрғысынан теңестіріңдер. Тотықтырғыш пен тотықсыздандырғышты анықтаңдар.
AI + O2 = AI2O3
H2 + FeO = Fe + H2O
Үйге тапсырма беру: Қайталау.
8-сынып Бақылау жұмысы
1-нұсқа:
-
Мына қосылыстардағы элементтердің валенттігін анықтаңдар: NH3, P2O5 , CrO3 , H2S , ,SO3;
2. Мына фосфор қышқылының (H3PO4) құрамындағы әр химиялық элементтің массалық үлесін
есептеп шығар.
3. Төмендегі берілген химиялық реакция теңдеулерін теңестіріп, типтерін анықтаңдар:
а) Mg + O2 - MgO ә) Ag2O- Ag + O2
б) KCIO3 - KCI + O2 в) AI + S - AI2S3
г) CuO + AI - AI2O3 + Cu д) Na + H2O - NaOH + H2
ж) AI2O3 + HBr = AIBr3 + H2O
4. Массасы 6 грамм магний жанғанда түзілген магний оксидінің (MgO) массасын және зат мөлшерін
есептеп шығар.
5. Реакциясының теңдеулерін аяқтап жаз:
а) Hg2O = ? + ? ә) HgCI2 + Cu = ? + ? б) MgO + HCI = ? + ?
2-нұсқа:
1. Төмендегі қосылыстардың формуласын құрыңдар: а) кальций мен хлор(І); ә) азот (V) пен ,оттек;
б) алюминий мен ,оттек;, в) натрий мен ,күкірт (ІІ).
2. Мына әктастың (CaCO3 ) құрамындағы әр химиялық элементтің ,массалық үлесін есептеп шығар.
3. Төменде берілген химиялық реакция теңдеулерін теңестіріп, типтерін анықтаңдар:
а) Fe + O2 - Fe2O3 ә) P + O2 -P2O5
б) KCIO3 - KCI + O2 в) ZnO - Zn + O2
г) Fe3O4 + AI - AI2O3 + Fe д) Na + H2O - NaOH + H2
в) KOH + H2SO4 = K2SO4 + H2O
4. Массасы 6,2 грамм фосфор жанғанда түзілген фосфор (V) оксидінің (P2O5) массасын және зат
мөлшерін есептеп шығар.
5. Реакциясының теңдеулерін аяқтап жаз:
a) CuO = ? + ? ә) FeS + HCI = ? + ? б) CuO + H2 = ? + ?
--------------------------------------------------------------------------------------------------------------------------------------
8-сынып Бақылау жұмысы
1-нұсқа:
-
Мына қосылыстардағы элементтердің валенттігін анықтаңдар: NH3, P2O5 , CrO3 , H2S , ,SO3;
2. Мына фосфор қышқылының (H3PO4) құрамындағы әр химиялық элементтің массалық үлесін
есептеп шығар.
3. Төмендегі берілген химиялық реакция теңдеулерін теңестіріп, типтерін анықтаңдар:
а) Mg + O2 - MgO ә) Ag2O- Ag + O2
б) KCIO3 - KCI + O2 в) AI + S - AI2S3
г) CuO + AI - AI2O3 + Cu д) Na + H2O - NaOH + H2
ж) AI2O3 + HBr = AIBr3 + H2O
4. Массасы 6 грамм магний жанғанда түзілген магний оксидінің (MgO) массасын және зат мөлшерін
есептеп шығар.
5. Реакциясының теңдеулерін аяқтап жаз:
а) Hg2O = ? + ? ә) HgCI2 + Cu = ? + ? б) MgO + HCI = ? + ?
2-нұсқа:
1. Төмендегі қосылыстардың формуласын құрыңдар: а) кальций мен хлор(І); ә) азот (V) пен ,оттек;
б) алюминий мен ,оттек;, в) натрий мен ,күкірт (ІІ).
2. Мына әктастың (CaCO3 ) құрамындағы әр химиялық элементтің ,массалық үлесін есептеп шығар.
3. Төменде берілген химиялық реакция теңдеулерін теңестіріп, типтерін анықтаңдар:
а) Fe + O2 - Fe2O3 ә) P + O2 -P2O5
б) KCIO3 - KCI + O2 в) ZnO - Zn + O2
г) Fe3O4 + AI - AI2O3 + Fe д) Na + H2O - NaOH + H2
в) KOH + H2SO4 = K2SO4 + H2O
4. Массасы 6,2 грамм фосфор жанғанда түзілген фосфор (V) оксидінің (P2O5) массасын және зат
мөлшерін есептеп шығар.
5. Реакциясының теңдеулерін аяқтап жаз:
a) CuO = ? + ? ә) FeS + HCI = ? + ? б) CuO + H2 = ? + ?
Сабақ тақырыбы: «Галогендер және олардың қосылыстары» тақырыбын қорытындылау сабағы
Сабақтың мақсаты:
Білімділік : Оқушыларға галогендер және олардың қосылыстары тақырыбын жете меңгерту.
Дамытушылық : Оқушылардың галогендер топшасы және олардың қосылыстары туралы білімдерін дамыту.
Тәрбиелік : Оқушыларды басқа бейметалдарға қарағанда галогендердің басты ерекшелігін ажырата алуға тәрбиелеу.
Сабақ әдісі : Баяндау, сұрақ- жауап.
Сабақ жоспары: 1. Ұйымдастыру.
2. Өткен тақырыпқа пысықтау сұрақтары.
3. Ойын барысы.
4. Бекіту.
6. Бағалау .
5. Үй тапсырмасын сұрау.
Өткен тақырыпқа пысықтау сұрақтары:
-
Натрийдің ең маңызды қосылыстарын атап беріңдер. Бұл заттар қайда қолданылады?
-
Натрий хлоридін калий хлоридінен қалай айыруға болады?
-
NaCl қайда қолданылады? Маңызы неде?
Сабақтың барысы:
-
Кезең
Өткен тақырыпқа қайталау сұрақтары қойылғаннан кейін, сынып оқушылары үш топқа бөлінеді. Әрбір топқа жетекші сайланады, жетекшілер тақтаға шығып, жасырын тұрған топ аттарын таңдайды, соған сәйкес әрбір топ өздерінің атаулары бойынша түсініктеме беріп, таныстыруы тиіс (ашылуы, қолданылуы, маңызды қосылыстары).
Мысалы:
Йод. Мені 1811 жылы француз фабриканты химик-технолог Бернер
Куртуа ашты. Атым грекше иодус- күлгін, қара көк деген мағына береді.
Минералдарым лаутарит (СаІО3) және дицеит 7Са(ІО3)2·8СаСrO4,
тұздарым иодидтер аз мөлшерде гидросферада- теңіз суында,
скважиналанған мұнай суларында кездесемін. Теңіз орман- жапырағы деп
аталатын ламинария балдырының құрамында 0,1-0,6 %-мын.
Организмдеріңізге йод жетіспесе бақшаңкөз ауруына шалдығасыздар,
сондықтан құрамында йоды бар асты пайдаланыңыздар.
Менен медицинада дәрілер даярлайды, тамақ өнеркәсібінде, фото, кино
ісінде, лабораториялық реактив ретінде де қолданыламын.
Фтор. Мен бүлдіргіш элементпін, қ.ж. солғын сары түсті бейметалмын. Өткір иісті улы газбын. Қосылыстарымда бір валенттімін, өте белсендімін, қалыпты температурада көптеген элементтермен әрекеттесемін. Менімен жанасқан кезде натрий, кальций, кремний, күкірт, фосфор мына тұрған галогендер: бром мен йод та жанады, ал су айырылады. Мені органикалық қосылыстар синтездеуде, шыны өңдеуде, ағашты шіруден сақтауда, т.б. мақсаттарда да қолданылады. Өсімдіктер мен жануарлар, адам өмірінде де елеулі рөл атқарамын. Ауыз суда мен жетіспесем тістеріңіз ауыратын болады. Мен адамзатқа қажетті элементпін.
Бром. Мені 1826 жылы француз ғалымы Ж.Балар ашқан. Иісім сасық болғандықтан менен бәрі қашады. Мен қалыпты жағдайда өткір иісті қызыл-қоңыр түсті ауыр сұйықтықпын, ауада тез буланып, сары қоңыр бу түземін. Судағы ерітіндім бром суы деп аталады. Менің қосылыстарым өнеркәсіпте сурет, кино материалдарын жасауда, медицинада дәрі-дәрмектер алуда, іштен жанатын двигательдердің (автокөлік, авиация) бензин сапасын жақсартып, этилдеуде қолданыламын.
-
Кезең
Үш топқа «Ойлан,тап» атты 3 сұрақ беріледі:
 1. Жеңіл 1 ұпайлық ( );
1. Жеңіл 1 ұпайлық ( );
 2. Орташа 2 ұпайлық( );
2. Орташа 2 ұпайлық( );
 3. Қиынырақ 3 ұпайлық ( ).
3. Қиынырақ 3 ұпайлық ( ).
І топ


VII топтың негізгі тошасындағы элементтерге сипаттама беріңіз.
Cl2 молекуласының түзілу сызбасын жазыңыз, қандай байланыс тән?
Галогендердің бірін-бірі ығыстыруына, сәйкес реакция теңдеуін жазыңыз.
ІІ топ


Хлор атомының тотығу дәрежесі +3, +5, +7 болып өзгеретінін түсіндіріңіз?
Тотықтырғыш сөзіне түсініктеме беріңіз.
Хлорсутектің физикалық қасиеттерін сипаттап айтып беріңіз?
ІІІ топ


Галогендердің сутекті қосылыстарының тұрақтылығы қалай өзгереді?
F, Br, I жалпы физикалық қасиеттеріне сәйкес сипаттамасын айтып беріңіз?
Галогендердің ішіндегі ең белсендісі қайсысы? Себебін түсіндіріңіз?
-
Кезең
Әрбір топқа галогендер тақырыбы бойынша сөзжұмбақтар беріледі. Тез шешкен топқа жоғары ұпай берілсе, ал кейін шешкен топтарға тиісті ұпай сандары беріледі.
Сөзжұмбақ «Химиктер»
1
Х
2
И
3
М
4
И
5
К
6
Т
7
Е
8
Р
-
Заттар және олардың бір - біріне айналуы туралы ғылым.
-
Орыс химиясының атасы.
-
Тізбекті реакцияны шығарған химик.
-
Әрі, композитор, әрі химик - ғалым.
-
Тұзды көлдердің тұзын өнеркәсіп мүдделеріне пайдалану
мүмкіндіктерін зеттеген ғалым.
-
Гипстен күкірт өндірген химик.
-
Химия ғылымының тарихында ұлы алтын заң ашқан ғалым.
-
Химияның құрылыс теориясын ашқан органик - химик.
Шешуі:
-
Химия. 2. Зинин. 3. Семенов. 4. Бародин. 5. Морковников. 6. Бекетов. 7. Менделеев. 8. Бутлеров
Сөзжұмбақ «Металдар»
1
м
2
е
3
т
4
а
5
л
6
д
7
а
8
р
-
Күмістей ақшыл, женіл металл.
-
Мемлекет атымен аталатын элемент.
-
Магнитті қасиеті бар металл.
-
Сілтілік металл.
-
Бағалы металл.
-
Радоиактивті металл.
-
Ең ауыр металл
-
Оқтың құрамына кіретін металл.
Шешуі:
1. Магний. 2. Германий. 3. Темір. 4. Натрий. 5. Алтын. 6. Радий. 7. Қалайы. 8. Қорғасын.
Сөзжұмбақ «Галогендер»
Г
А
Л
О
Г
Е
Н
Д
Е
Р
1. Бірінші дүниежүзілік соғыста хлорды тұншықтырғыш улы зат ретінде қолданған мемлекет.
2. Тез ыдырап кететін тұрақсыз радиоактивті элемент.
3. 1774 жылы швед оқымыстысы К. Шееле алған элемент (сарғылт жасыл түсті, тұншықтырғыш , улы газ).
4. Тоңазытқыш сұйықтар фреондар алуға жұмсалатын элемент.
5. Металдармен тікелей әректтесіп тұз түзетін элементтер.
6. Йодты 1811 жылы қай ғалым ашты.
7. 1886 жылы фторды ашқан химик.
8. Алғашқы көмекке пайдаланылатын бейметалл.
9. Ауада түтінденетін концентрлі ерітінді.
10. Жүйкені жайландыратын, дәрі- дәрмек құрамына кіретін элемент.
Шешуі:
1. Германия
-
Астат
-
Хлор
-
Фтор
-
галоген
-
Бернер
-
Муассан
-
Йод
-
Хлорсутек
-
Бром
IV. Кезең
Келесі кезеңде 3 топ зертханалық жұмыстарда қауіпсіздік ережесін сақтауға
байланысты сөйлемді құрастыру керек. Әрбір топ тиісті ұпайларын алады.
Жасырын сөйлем:
C
Ұ
Й
Б
И
З
І
Ң
А
Т
Ы
Л
М
Р
А
Ы
О
Р
Ө
Ж
Е
Р
А
П
О
А
Д
Т
Қ
Р
Қ
Ы
Ә
Н
А
Қ
Ұ
Б
Й
Ы
Қ
Ы
П
А
Н
Ж
Е
Ң
Ы
С
А
Д
Ы
Д
З
Н
А
Қ
О
А
С
Р
Т
Ғ
Ы
Р
Ы
П
Ж
А
Т
Л
Д
Т
А
А
У
Жауабы: Сұйықтарды қыздырып жатқан пробирканы өзіне және жолдастарына қаратып ұстауға болмайды.
Жасырын сөйлем:
Х
Р
М
Ж
Ұ
Ш
К
А
Ф
Л
О
Е
Н
М
А
П
А
Т
Т
С
І
С
Ы
Р
Т
Ж
А
Е
Г
Ж
І
Т
А
У
А
С
Н
Е
Ә
Р
І
Н
Қ
Е
Т
Д
Е
Т
И
Б
Е
А
Ж
Жауабы: Хлормен жұмыс істегенде тәжірибені тартпа шкафта жасау қажет
Жасырын сөйлем
Б
е
Н
п
А
п
С
т
Ы
е
Н
Р
М
Т
Т
Ш
Ы
а
Қ
қ
П
Ж
о
М
А
Р
к
н
а
л
Ы
м
ұ
Р
А
т
Ф
а
т
Ы
А
С
у
Қ
е
ң
К
о
Л
П
П
Д
І
Е
А
т
з
Е
е
Қ
ғ
А
а
Й
с
Т
ж
Е
Жауабы: Броммен тартпа шкафта, резеңке қолғап пайдаланып, сақтықпен жұмыс істеу қажет.
Сабақты бекіту: Әрбір оқушыға «Галогендер және олардың қосылыстары»
бойынша тест жұмыстары беріледі.
І - нұсқа
1. Галогендер тобына жататындар:
а) Si, Ca, Mg, Ba, In
б) F, C1, Br, I, At
в) C1, I, K, At, Na
г) C1, F, Ne, Xe, Cu
2. Галогендердің сытрқы энергетикалық деңгейі мына электронды
формуламен сипатталады:
а) 1s2 2s2
б) 1s2 2s2 2p3
в) 1s2 2s2 2p5
г) 1s2 2s2 2p4
3. Галогендер атомының белсенділігі мына қатарда артады:
а) F, C1, Br, I, At
б) C1, Br, I, F, At
в) At, I, Br, C1, F
г) I, At, C1, Br, F
4. 20˚c температурада 1 көлем хлордың неше көлемі ериді:
а) 3,5
б) 1,7
в) 2,9
г) 2,5
5. Галоген тобына жатпайтын элемент :
а) I
б) Br
в) Cr
г) Cl
6. Мүмкін болатын химиялық әрекеттесу:
а) NaF + Cl2
б) NaI + F2
в) NaCl + Br2
г) NaCl + F2
7. Тұз қышқылы мына заттармен әрекеттеседі:
а) Cu, CuO, Cu(OH)2
б) АgNO3, Ca, NaOH
в) Zn, ZnO, Zn(OH)2
г) NaOH, Na2O, метилоранж
8. Бөлме температурасында қатты күйде болатын элемент:
а) F2
б) Cl2
в) Br2
г) I2
9. Хлордың судағы ерітіндісі:
а) хлорсутек
б) тұз қышқылы
в) хлор қышқылы
г) хлорсуы
10. Хлор темірмен әрекеттескенде түзілетін өнім:
а) темір хлориді (ІІ)
б) темір оксиді (ІІІ)
в) темір хлориді (ІІІ)
г) темір бромиді (ІІІ)
11. Галогендердің ішіндегі күшті тотықтырғышы:
а) F2
б) Cl2
в) Br2
г) I2
12. 1826 жылы француз оқымыстысымен ашылған элемент:
а) F2
б) Cl2
в) Br2
г) I2
13. Фтор бос күйінде:
а) сұйық улы зат
б) қатты улы зат
в) улы газ
г) қара сұр түсті улы газ
14. Теңіз балдырларында кездесетін элемент:
а) F2
б) Cl2
в) Br2
г) I2
15. Хлор газы ауадан неше есе ауыр:
а) 2 есе
б) 1,5 есе
в) 2,5 есе
г) 3 есе
ІІ - нұсқа
1.1774 жылы швед оқымыстысы К. Шееле күшті тотықтырғыштарға концентрлі тұз қышқылын әсер ету арқылы алынған элемент:
а) F2
б) Cl2
в) Br2
г) I2
2. Галогендердің ішіндегі ең әлсіз тотықтырғыш элемент:
а) F2
б) Cl2
в) Br2
г) I2
3. Тоңазытқыш сұйықтар фреондар алуға жұмсалатын элемент:
а) F2
б) Cl2
в) Br2
г) I2
4. Тұз қышқылының тұздары:
а) хлоридтер
б) хлорсутек
в) хлорсуы
г) хлор қышқылы
5. Хлорсутектің 1 л массасы нешеге тең:
а) 1,55
б) 1,64
в) 2,22
г) 2,64
6. Бірінші дүниежүзілік соғыста 1915 жылы Германия қай элементті тұншықтырғыш улы зат ретінде қолданды:
а) F2
б) Br2
в) Cl2
г) I2
7. 1886 жылы француз химигі Г. Муассанмен ашылған элемент:
а) F2
б) Br2
в) Cl2
г) I2
8. Бөлме температурасында қатты күйде болатын элемент:
а) F2
б) Cl2
в) Br2
г) I2
9. Галогендердің сытрқы энергетикалық деңгейі мына электронды формуламен
сипатталады:
а) 1s2 2s2
б) 1s2 2s2 2p3
в) 1s2 2s2 2p5
г) 1s2 2s2 2p4
10. Галогендердің ішіндегі күшті тотықтырғышы:
а) F2
б) Cl2
в) Br2
г) I2
11. Хлор газы ауадан неше есе ауыр:
а) 2 есе
б) 1,5 есе
в) 2,5 есе
г) 3 есе
12. Фтор бос күйінде:
а) сұйық улы зат
б) қатты улы зат
в) улы газ
г) қара сұр түсті улы газ
13. Хлор темірмен әрекеттескенде түзілетін өнім:
а) темір хлориді (ІІ)
б) темір оксиді (ІІІ)
в) темір бромиді (ІІІ)
г) темір хлориді (ІІІ)
14. Теңіз балдырларында кездесетін элемент:
а) F2
б) Cl2
в) Br2
г) I2
15. Тұз қышқылы мына заттармен әрекеттеседі:
а) Cu, CuO, Cu(OH)2
б) АgNO3, Ca, NaOH
в) Zn, ZnO, Zn(OH)2
г) NaOH, Na2O, метилоранж
ІІІ - нұсқа
1. Галоген тобына жатпайтын элемент :
а) I
б) Br
в) Cr
г) Cl
2. Хлор электрондық құрылымына сай неше валентті бола алады:
а) І, ІІ, ІІІ
б) І, V, VI
в) II, IV, VI
г) I, III, V, VII
3. Хлордың салыстырмалы атомдық массасы нешеге тең:
а) 35,5
б) 34,7
в) 40,5
г) 45,5
4. 1886 жылы француз химигі Г. Муассанмен ашылған элемент:
а) F2
б) Br2
в) Cl2
г) I2
5. 1774 жылы швед оқымыстысы К. Шееле күшті тотықтырғыштарға концентрлі тұз қышқылын әсер ету арқылы алынған элемент:
а) F2
б) Cl2
в) Br2
г) I2
6. Тұз қышқылы мына заттармен әрекеттеседі:
а) Cu, CuO, Cu(OH)2
б) АgNO3, Ca, NaOH
в) Zn, ZnO, Zn(OH)2
г) NaOH, Na2O, метилоранж
7. Хлорсутектің 1 л массасы нешеге тең:
а) 1,55
б) 2,22
в) 2,64
г) 1,64
8. Галогендердің сытрқы энергетикалық деңгейі мына электронды формуламен
сипатталады:
а) 1s2 2s2
б) 1s2 2s2 2p3
в) 1s2 2s2 2p5
г) 1s2 2s2 2p4
9. Хлор газы ауадан неше есе ауыр:
а) 2,5 есе
б) 1,5 есе
в) 2 есе
г) 3 есе
10. Теңіз балдырларында кездесетін элемент:
а) F2
б) Cl2
в) Br2
г) I2
11. Галогендер тобына жататындар:
а) Si, Ca, Mg, Ba, In
б) F, C1, Br, I, At
в) C1, I, K, At, Na
г) C1, F, Ne, Xe, Cu
12. Галогендердің ішіндегі күшті тотықтырғышы:
а) F2
б) Cl2
в) Br2
г) I2
13. Хлордың судағы ерітіндісі:
а) хлорсутек
б) тұз қышқылы
в) хлор қышқылы
г) хлорсуы
14. 20˚c температурада 1 көлем хлордың неше көлемі ериді:
а) 3,5
б) 1,7
в) 2,9
г) 2,5
15. Тоңазытқыш сұйықтар фреондар алуға жұмсалатын элемент:
а) F2
б) Cl2
в) Br2
г) I2
Үйге тапсырма: «Галогендер және олардың қосылыстары» тақырыбын
қайталау, берілген есептерді шығару.
Бағалау. 18-20 балл «5»
17-15 балл «4»
14-12 балл «3» деген бағалармен бағаланады.