- Учителю
- Урок химии 8 класс по теме «Степень окисления»
Урок химии 8 класс по теме «Степень окисления»
Урок химии в 8 классе, по теме «Степень окисления»
Учитель БОУ г Омска
«Средняя общеобразовательная школа № 27»
Мазур Евгения Викторовна
Цель урока: Изучить понятие степени окисления.
Рассмотреть виды степеней окисления: положительная, отрицательная.
Научиться правильно, определять степени окисления атома в соединении. Развивать навыки самостоятельной работы; способствовать развитию логического мышления.
Оборудование : Периодическая таблица, учебник химии 8 класс, карточки - задания, презентация.
Ход урока:
-
Организационный момент
-
Актуализация знаний
-
Изучение нового материала
-
Закрепление изученного
-
Подведение итогов урока.
№ п/п
Этап урока, содержание.
Деятельность учителя
Деятельность ученика
1
Организационный момент:
Проверяет подготовку к уроку, присутствие на уроке, отмечает отсутствующих
Готовится к уроку
2
Актуализация знаний:
Фронтальный опрос по следующим темам
Что называется химической связью?
Какие виды химических связей вы знаете?
Какая связь называется ковалентной связью?
Какие ковалентные связи выделяют ?
В это же время у доски работают 3 человека , которые выполняют задания на определение типов химической связи
1 ученик из предложенного перечня выбирает вещества с ковалентной неполярной связью
2 ученик- вещества с ковалентной полярной связью
3 ученик вещества с ионной связью.
Задает вопросы,
Слушает ответы, оценивает ответы.
Отвечают на вопросы, выполняют задания, участвуют в обсуждении
3
Изучение нового материала
Степень окисления является важной характеристикой состояния атома в молекуле. Высшая валентность элемента, как правило, равна номеру группы. Степень окисления в соединениях с разными химическими связями образуется неодинаково.
Как образуется степень окисления у молекул с разными химическими связями?
1) В соединениях с ионной связью степени окисления элементов равно зарядам ионов.
Мg отдает 2 электрона = Мg+2
2) В соединениях с ковалентной неполярной связью (в молекулах простых веществ) степень окисления элементов равно 0.
Н20, СI20, F20, S0, AI0
3) Степень окисления элемента - это условный заряд его атома, в молекуле, если считать, что молекула состоит из ионов. Степень окисления определяется числом смещенных электронов от атома с меньшей электроотрицательностью, к атому с большей э-о.
У молекул с ковалентно-полярной связью степень окисления определяется подобно молекулам с ионной химической связью.
Степень окисления атома имеет знак. Она может быть положительной, отрицательной и нулевой.
Степень окисления обозначается арабскими цифрами с зарядом над символам элемента (Мg+2, Са+2, Nа+1, CIˉ¹).
Положительная степень окисления - равна числу электронов, отданных данным атомам. Атом может отдать все валентные электроны (для главных групп это электроны внешнего уровня) соответствующее номеру группы, в котором находится элемент, проявляя при этом высшую степень окисления (исключение ОF2).Например: высшая степень окисления главной подгруппы II группы равна +2 ( Zn+2)Положительную степень проявляют как металлы так и неметаллы, кроме F .Например: С+4 ,Na+1 , Al+3
Отрицательная степень окисления равна числу электронов, принятых данным атомом, ее проявляют только неметаллы. Атомы неметаллов присоединяют столько электронов, сколько их не хватает до завершения внешнего уровня, проявляя при этом отрицательную степень.
У элементов главных подгрупп IV-VII групп минимальная степень окисления численно равна
Номер группы - 8 = «минимальная отрицательная степень окисления»
Например:
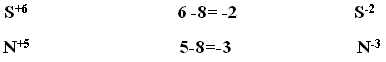
Значение степени окисления между высшим и низшим степенями окислений называется промежуточными:
Высшая
Промежуточные
Низшая
C+4
С+3, С+2,С0 ,С-2
С-4
N+5
N+3, N0,
N-3
Для определения степени окисления атома в соединении следует учитывать ряд правил:
-
Степень окисления простых веществ равна 0:
Н20, СI20, F20, S0, AI0
-
Степень окисления F во всех соединениях равна « -1». Na+1 F-1,
-
Степень окисления металлов в соединения всегда положительна и равна валентности: Na+1 F-1,
-
Водород в большинстве соединений имеет степень окисления +1, кроме соединения с активными металлами, где степень окисления (-1) :Na+1H-1
-
Степень окисления кислорода в большинстве соединений равна (-2) исключение: ОF2, где степень окисления О+2F-1
-
Сумма положительных и отрицательных степеней окисления в соединении равна 0
N2 + 3O3-2
+3*2=+6 и -2*3= - 6; +6+(-6)= 0
Объясняет новый материал, обращаясь к таблице им
Д И Менделеева
Объясняет понятие степени окисления
Приводит примеры
Диктует
Объясняет и диктует правила
По периодической таблице следят за объяснением материала
Слушают, записывают определение
Записывают примеры в тетрадь
Слушают, записывают примеры
Записывают
Участвуют в объяснении , приводят примеры, записывают правила в тетрадь
4
Закрепление изученного, проводим в форме работы по разноуровневым карточкам (приложение)
Организует работу по карточкам
Работают по карточкам, обсуждают результаты
5
Подведение итогов урока, рефлексия.
Выставляет оценки за работу на уроке
Оценивают что нового узнали на уроке.Записывают домашнее задание