- Учителю
- Формы и средства контроля по химии 10 класс
Формы и средства контроля по химии 10 класс
ПОЯСНИТЕЛЬНАЯ ЗАПИСКА
Рабочая программа рассчитана на 35 учебных недель. В 10 классе по программе предусмотрено выполнение 4 контрольных работы и 6 практических работ.
Формы и средства контроля - 10 класс
Практические работы
1. Практическая работа №1 по теме: «Качественное определение углерода, водорода и хлора в органических веществах».
2. Практическая работа № 2 по теме: «Получение этилена и изучение его свойств».
3. Практическая работа № 3 по теме: «Получение и свойства карбоновых кислот».
4. Практическая работа № 4 по теме: «Решение экспериментальных задач на распознавание органических веществ».
5. Практическая работа № 5 по теме: «Решение экспериментальных задач на получение и распознавание органических веществ».
6. Практическая работа № 6 по теме: «Распознавание пластмасс и волокон».
Контрольные работы
1. Контрольная работа №1 по теме: «Предельные углеводороды».
2. Контрольная работа № 2 по теме: «Углеводороды»
3. Контрольная работа №3 по теме: «Кислородсодержащие органические соединения».
4. Итоговая контрольная работа № 4 по темам: «Кислородсодержащие органические соединения», «Азотсодержащие органические соединения».
Критерии оценивания результатов обучения учащихся
Результаты обучения химии должны соответствовать общим задачам предмета и требованиям к его усвоению.
Результаты обучения оцениваются по пятибалльной системе. При оценке учитываются следующие качественные показатели ответов
глубина (соответствие изученным теоретическим обобщениям);
осознанность (соответствие требуемым в программе умениям применять полученную информацию);
полнота (соответствие объему программы и информации учебника).
При оценке учитываются число и характер ошибок (существенные или несущественные).
Существенные ошибки связаны с недостаточной глубиной и осознанностью ответа (например, ученик неправильно указал основные признаки понятий, явлений, характерные свойства веществ, неправильно сформулировал закон, правило и т.п. или ученик не смог применить теоретические знания для объяснения и предсказания явлений, установления причинно-следственных связей, сравнения и классификации явлений и т. п.).
Несущественные ошибки определяются неполнотой ответа (например, упущение из вида какого-либо нехарактерного факта при описании вещества, процесса). К ним можно отнести оговорки, описки, допущенные по невнимательности (например, на два и более уравнения реакций в полном ионном виде допущена одна ошибка в обозначении заряда иона).
Результаты обучения проверяются в процессе устных и письменных ответов учащихся, а также при выполнении ими химического эксперимента.
Оценка теоретических знаний
Отметка «5»:
ответ полный и правильный на основании изученных теорий;
материал изложен в определенной логической последовательности, литературным языком;
ответ самостоятельный.
Отметка «4»:
ответ полный и правильный на основании изученных теорий;
материал изложен в определенной логической последовательности, при этом допущены две-три несущественные ошибки, исправленные по требованию учителя
Отметка «3»:
ответ полный, но при этом допущена существенная ошибка или ответ неполный, несвязный.
Отметка «2»:
при ответе обнаружено непонимание учащимся основного содержания учебного материала или допущены существенные ошибки, которые учащийся не может исправить при наводящих вопросах учителя.
Оценка экспериментальных умений
Оценка ставится на основании наблюдения за учащимся и письменного отчета за работу.
Отметка «5»:
работа выполнена полностью и правильно, сделаны правильные наблюдения и выводы
эксперимент проведен по плану с учетом техники безопасности и правил работы с веществами и оборудованием;
проявлены организационно-трудовые умения (поддерживаются чистота рабочего места и порядок на столе, экономно используются реактивы).
Отметка «4»:
работа выполнена правильно, сделаны правильные наблюдения и выводы, но при этом эксперимент проведен не полностью или допущены несущественные ошибки в работе с веществами и оборудованием.
Отметка «3»:
работа выполнена правильно не менее чем наполовину или допущена существенная ошибка в ходе эксперимента, в объяснении, в оформлении работы, в соблюдении правил техники безопасности при работе с веществами и оборудованием, которая исправляется по требованию учителя.
Отметка «2»:
допущены две (и более) существенные ошибки в ходе эксперимента, в объяснении, в оформлении работы, в соблюдении правил техники безопасности при работе с веществами и оборудованием, которые учащийся не может исправить даже по требованию учителя.
Оценка умений решать экспериментальные задачи
Отметка «5»:
план решения составлен правильно;
правильно осуществлен подбор химических реактивов и оборудования;
дано полное объяснение и сделаны выводы.
Отметка «4»
план решения составлен правильно;
правильно осуществлен подбор химических реактивов и оборудования, при этом допущено не более двух несущественных ошибок в объяснении и выводах.
Отметка «3»:
план решения составлен правильно;
правильно осуществлен подбор химических реактивов и оборудования, но допущена существенная ошибка в объяснении и выводах.
Отметка «2»:
допущены две (и более) существенные ошибки в плане решения, в подборе химических реактивов и оборудования, в объяснении и выводах
Оценка умений решать расчетные задачи
Отметка «5»:
в логическом рассуждении и решении нет ошибок, задача решена рациональным способом.
Отметка «4»:
в логическом рассуждении и решении нет существенных ошибок, но задача решена нерациональным способом или допущено не более двух несущественных ошибок.
Отметка «3»:
в логическом рассуждении нет существенных ошибок, но допущена существенная ошибка в математических расчетах.
Отметка «2»:
имеются существенные ошибки в логическом рассуждении и решении.
Оценка письменных контрольных работ
Отметка «5»:
ответ полный и правильный, возможна несущественная ошибка.
Отметка «4»:
ответ неполный или допущено не более двух несущественных ошибок.
Отметка «3»:
работа выполнена не менее чем наполовину, допущена одна существенная ошибка и две-три несущественные.
Отметка «2»:
работа выполнена менее чем наполовину или содержит несколько существенных ошибок.
При оценке выполнения письменной контрольной работы необходимо учитывать требования единого орфографического режима.
Критерии оценивания письменных контрольных работОтметка
Процент выполнения заданий
«5»
90-100%
«4»
70-90%
«3»
50-70%
«2»
менее 50%
</<br>
Входная контрольная работа по химии для 10 класса
Вариант 1
Часть А. Тестовые задания с выбором ответа.
1 . Знаки химических элементов, имеющих сходное строение внешнего энергетического уровня:
А. В и Si Б. Se и S В. K и Ca Г. Mn и Вr
2 . Номер периода в периодической системе показывает:
А. Число электронных слоев в атоме
Б. Заряд ядра атома
В. Число электронов на внешнем энергетическом уровне
Г. Число электронов в атоме
3 . Формула вещества с ионной связью и ионной кристаллической решеткой:
А. СО2 Б. N2 В. KCl Г. С (алмаз)
4. К окислительно-восстановительным не относятся реакции:
А. Соединения Б. Разложения В. Замещения Г. Обмена
5 . Формула соли, водный раствор которой имеет щелочную среду:
А. К2СО3 Б. Аl(NO3)3 В. CuSO4 Г. NaCl
6 . Аморфным веществом является:
А. Алмаз Б. Стекло В. Кремнезем Г. Сода
7. Условие, необходимое для смещения химического равновесия в реакции N2 + O2 ↔ 2NO - Q в сторону продуктов:
А. Увеличить давление Б. Повысить температуру
В. Применить катализатор Г. Понизить температуру
8. Окислителем в химической реакции СuO + H2 = Cu + H2O является:
А. Н20 Б. О-2 В. Cu+2 Г. Cu0
9. Формула вещества Х в цепочке превращений Na → Х → Na2O:
А. Na2O2 Б. NaOH В. NaH Г. NaCl
10. Превращение, которое нельзя осуществить в одну стадию:
А. О2 → О3 Б. О2 → Н2О В. NH3 → НNO3 Г. О2 → СuO
Часть Б. Задания со свободным ответом.
11 . Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения
Li 1→ Li2O 2→ LiOH 3→ Li2CO3 4→ CO2
Вариант 2
Часть А. Тестовые задания с выбором ответа.
1. Знаки химических элементов, имеющих сходное строение внешнего энергетического уровня:
А. S и Cl Б. Be и B В. Kr и Хе Г. F и O
2. Общее число электронов в атоме элемента определяется в периодической системе по номеру:
А. Группы Б. Периода В. Ряда Г. Порядковому
3 . Вещество с металлической связью:
А. Вода Б. Хлорид натрия В. Йод Г. Кобальт
4. Вещество, способное переходить из твердого состояния в газообразное, минуя жидкое:
А. Бензол Б. Сера В. Вода Г. Йод
5. Тип реакции, с помощью которой можно осуществить
превращение СН3-СН2-СН2-СН3 СН3-СН-(СН3)2
А. Изомеризации Б. Замещения В. Разложения Г. Обмена
6. Вещества, при гидролизе которых получаются карбоновые кислоты:
А. Белки Б. Жиры В. Нуклеиновые кислоты Г. Углеводы
7. Как изменится скорость химической реакции Н2(г) + J2(г) ↔ 2НJ(г) при увеличении давления в 4 раза:
А. Увеличится в 2 раза Б. Увеличится в 8 раз
В. Увеличится в 16 раз Г. Увеличится в 32 раза
8. Ряд формул веществ, в которых степень окисления серы возрастает:
А. H2SO4, H2SO3, S, MgS Б. SO3, Na2S, FeS, SO2
В. CaS, S, H2SO3, K2SO4 Г. S, H2S, SO3, H2SO4
9. Кальций взаимодействует с каждым веществом ряда:
А. Гидроксид натрия, водород, кислород В. Оксид цинка, этанол, фенол (расплав)
Б. Вода, уксусная кислота, хлор Г. Cерная кислота, вода, гидроксид калия
10. Вещества, взаимодействию которых соответствует ионное уравнение СО32- + 2Н+ = Н2О + СО2↑:
А. Карбонат натрия и соляная кислота
Б. Карбонат кальция и уксусная кислота
В. Гидрокарбонат калия и азотная кислота
Г. Карбонат бария и вода
Часть Б. Задания со свободным ответом.
11. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения
NaH ←1 Na 2→ Na2O2 3→ Na2O 4→ NaOH 5→ Na2SO4.
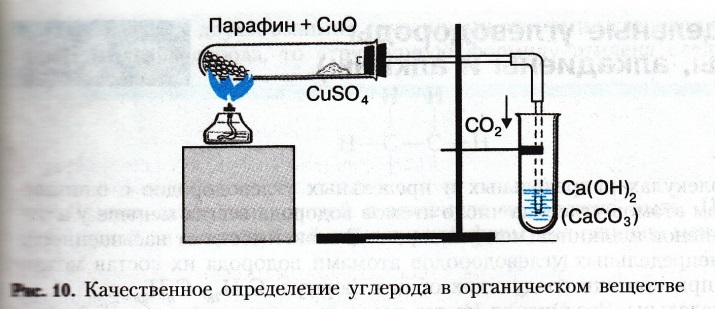
Практическая работа №1 по теме: «Качественное определение углерода, водорода и хлора в органических веществах».
Цель работы: экспериментальным путем доказать наличие атомов углерода, водорода и хлора в органических соединениях.
Оборудование: химический штатив, лапка, муфта, пробка с газоотводной трубкой, нагревательный прибор, спички.
Вещества: парафин, оксид меди (II), сульфат меди (II), медная проволока, дихлорметан
Техника безопасности:
Опасайтесь растрескивания стеклянной посуды при нагревании.
Соблюдайте правила нагревания.
Будьте осторожны в обращении с растворами солей.
Собирайте остатки веществ в специально предназначенную посуду.
Запрещается оставлять неубранными рассыпанные реагенты.
Ход работы
1. В сухую пробирку поместите около 1 г порошка оксида меди(II) и 0,2 г парафина. Пробирку нагрейте до плавления парафина и затем содержимое ее встряхните, чтобы вещества хорошо перемешались. Пробирку закрепите в штативе в горизонтальном положении (рис.) и поместите в нее недалеко от открытого конца немного безводного сульфата меди (II). Пробирку закройте пробкой с газоотводной трубкой, конец которой опустите в другую пробирку с известковой водой. Содержимое пробирки слегка нагрейте и наблюдайте за происходящими изменениями.
Задания для самостоятельных выводов. 1. Почему изменяется цвет сульфата меди(II)? О содержании какого элемента в исследуемом веществе это свидетельствует? 2. О содержании какого элемента свидетельствует помутнение известковой воды? 3. Что образовалось из оксида меди(II) и какие наблюдения это подтверждают? Напишите уравнения всех реакций, которые происходят при этом. Для парафина используйте его усредненную формулу С23Н48.
2. Возьмите спираль из медной проволочки и прокаливайте ее в пламени до тех пор, пока пламя перестанет окрашиваться в зеленый цвет. Прокаленную спираль опустите в пробирку с дихлорметаном, затем вновь поместите спираль в пламя горелки. Наблюдайте зеленое окрашивание пламени, свидетельствующее о наличии хлора в органическом растворителе. При взаимодействии меди с хлором образуется хлорид меди(II), который и дает пламени зеленое окрашивание.
Задание для самостоятельного вывода. От присутствия какого элемента пламя окрашивается в зеленый цвет?
Контрольная работа №1 по теме «Предельные углеводороды».
1. Укажите структурную формулу бутана:
1) CH3 - CH2 2) H3C CH3
CH3 - CH2 C
HC3 CH3
3) CH3 - CH2 - CH2 - CH3
4) H3C CH3 5) CH2
C H5C2 CH3
H3C H
2. Молекулы какого вещества могут иметь разветвленный угольный скелет:
1) C2H4 2) C2H6 3) C5H12 4)C3H8
3.Укажите структурную формулу, соответствующую пропану:
1) С С 2) С С С
С
3) С С С 4) С С С С
С
4. Изомеры - это вещества, имеющие -
1) одинаковое число протонов, но разное число нейтронов;
2) разный качественный и количественный состав, но одинаковое строение;
3) одинаковый качественный и количественный состав;
4) одинаковый качественный, но разный количественный состав.
5. Укажите утверждение, соответствующее теории А.М. Бутлерова:
1) Строение вещества определяет его свойства;
2) Все вещества имеют постоянный качественный и количественный состав;
3) Органические вещества образуются только в природе.
4) Все вещества состоят из молекул.
6. Укажите ряды, в которых записаны только формулы алканов:
1. C2H4, C7H16, C3H6;
2. C2H6, C8H18, C7H16;
3. CH4, C5H10, C3H6;
4. C3H8, C4H10, C6H14;
5. C2H6, C4H10, C5H12.
7. Укажите алкан, молекула которого содержит шесть атомов углерода:
1. C6H14 2) C6H10 3) C6H13 4)C6H12
8. Укажите общую формулу предельных углеводородов (алканов):
1) CnH2n 2) CnH2n+2 3) CnH2n+1 4)CnH2n-2
9. Укажите соответствие между молекулярной и общей формулой органического соединения:
1) C5H12 A) CnH2n-2
2) C3H6 B) CnH2n+2
3) C2H2 C) CnH2n
4) C3H8
10. Гомологом метана является углеводород:
1) C6H6 2) C4H10 3) C3H6 4) C4H6
11. Укажите, чем гомологи отличаются друг от друга:
1) Химическим строением;
2) Качественным составом;
3) Количественным составом;
4) Химическими свойствами.
12. Радикал пропил имеет состав:
1) C3H8 2) - C3H7 3) - C5H4 4) - CH3
13. Укажите вещества, с которыми вступает в реакцию пропан:
1) раствором перманганата натрия при комнатной температуре;
2) водой;
3) металлическим натрием;
4) хлором на свету.
14. С какими из перечисленных веществ реагирует пропан:
1) HCl 2) H2 3) KMnO4 4)Cl2 5) O2
15. Какие из представленных веществ являются изомерами циклогексана:
1) 1,3-диметилгексан, гексан, 3-метилпентен-2;
2) 3-метилпентен -2, метилциклопентан, 2-метилпентен-1;
3) 1,2 диметилциклопентан, 1,3 диметилциклопентан, 3 метилпентен;
4) Гексан, метилциклопентан, 2-метилпентен-1.
16. Какое количество изомерных циклоалканов возможно у вещества, эмпирическая формула которого C5H10
1) 3 2) 6 3) 5 4) 4
17. Какая структурная формула соответствует циклобутану:
1) CH2 CH2 2) CH2 CH CH3
CH3 CH3 CH3 CH3
2) CH3 CH CH2 4) CH2 CH2
CH2 CH2 CH2 CH2
Практическая работа № 2 по теме: «Получение этилена и изучение его свойств».
Цель работы: экспериментальным путём получить этилена и изучить его свойства
Оборудование: химический штатив, лапка, муфта, пробка с газоотводной трубкой, горелка, спички.
Реагенты: в пробирке №1 готовая смесь концентрированной серной кислоты и этилового спирта с несколькими крупинками песка; в пробирке №2 раствор перманганата калия.
Техника безопасности:
-
Опасайтесь растрескивания стеклянной посуды при нагревании;
-
Соблюдайте правила работы с горелками.
-
Собирайте остатки веществ в специально предназначенную посуду.
-
Будьте осторожны в обращении с растворами кислот.
-
Запрещается оставлять неубранными рассыпанные реагенты.
Xoд работы
1. В одну пробирку налейте 2-3 мл этилового спирта и осторожно добавьте 6-9 мл концентрированной серной кислоты. Затем всыпьте немного предварительно прокаленного песка, чтобы избежать толчков жидкости при кипении. Закройте пробирку пробкой с газоотводной трубкой, закрепите ее в штативе и осторожно нагрейте.
2. В другую пробирку налейте 2-3 мл бромной воды. Опустите газоотводную трубку до дна пробирки с бромной водой и пропустите через нее выделяющийся газ.
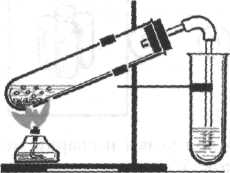
-
В третью пробирку налейте 2-3 мл разбавленного раствора перманганата калия, и пропустите через него газ.
-
Подожгите выделяющийся газ.
Задания для самостоятельных выводов. 1. Какой газ выделяется при нагревании смеси этилового спирта с серной кислотой? Что происходит при пропускании этого газа через бромную воду и раствор перманганата калия? Почему этилен горит более светящимся пламенем, чем метан? Напишите уравнения соответствующих реакций. 2. Чем отличаются свойства этилена от свойств предельных углеводородов?
5.Заполните таблицу:Исходные вещества
Наблюдения
Условия течения реакций
Выводы. Уравнения реакций
1.Получение этилена
2. Взаимодействие с бромной водой
3.Окисление этилена
4. Реакция горения
6.После окончания работы приведите в порядок своё рабочее место
Контрольная работа №2 по теме: «Углеводороды».
Задания к контрольной работе
Для вопросов 1-7 выберите вариант ответа (верный - только один ответ из четырех). Каждый правильный ответ: 1 балл, максимально 7 баллов.
-
Для вопросов 5-7 объясните выбор ответа, записав или уравнение реакции; или определение. Назовите вещества по систематической номенклатуре или составьте их структурную формулу. Каждый правильный дополнительный ответ: 1 балл, максимально 3 балла.
-
Решите задачу 8, запишите ход решения. Оценивается каждый элемент решения, максимально: 3 балла.
Вариант 1
1 Общей формуле алкенов соответствует:
а) СnH2n б) (СH3)n
в) СnH2n -2 г) СnH2n+2
2 Молекулы алкадиенов содержат:
а) только ![]() связи б) одну
связи б) одну
![]() связь
связь
в) две ![]() связи г) бензольное
кольцо
связи г) бензольное
кольцо
3 Ацетилен:
а) летучая жидкость, применяется при сварке металлов
б) вязкая жидкость, применяется для получения резины
в) взрывоопасный газ, применяется при сварке металлов
г) газ, применяется для получения резины
4 Вещество, формула которого
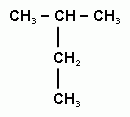 называется:
называется:
а) 3-метилбутан б) 2-метилбутан
в) 2-этилпропан г) пентан
5 Изомером циклобутана является:
а) бутен б) бутин
в) бутан г) бутанол С, 450-500°С
6 В схеме превращений 3 С2Н2 -----------> Х неизвестным веществом Х является:
а) пропан б) гексан
в) циклогексан г) бензол
7 Сумма коэффициентов в реакции горения этана равна:
а) 4 б) 16 в) 19 г) 21
8 Массовая доля углерода в углеводороде составляет 81,82%, относительная плотность паров этого вещества по кислороду равна 1,375. Найти молекулярную формулу улеводорода. Написать его название и структурную формулу.
12-13 баллов - оценка "5", 10-11 баллов - оценка "4", 7-9 баллов - оценка "3", менее 7 баллов - оценка "2".
Ответы и критерии оценивания к Варианту 1
1 Ответы на вопросы с выбором ответа:
1
2
3
4
5
6
7
Ответ
а
в
в
б
а
г
в
Балл
1
1
1
1
1
1
1
2 Ответы на дополнительный вопрос (для вопросов 5-7):
Содержание возможного ответа
Балл
5
Структурная формула циклобутана или бутена
![]() СН2=СН-СН2-СН3
СН2=СН-СН2-СН3
1
6
Структурная формула бензола:
![]()
1
7
Уравнение реакции горения этана:
2С2Н6 +7О2 -> 4СО2 +6Н2О
1
3 Решение задачи:
Баллы
Элементы ответа
Рассчитана относительная молекулярная масса вещества: Мr(вещесва)= 1,375х32=44
Рассчитано молярное соотношение атомов и выведена молекулярная формула:
44х0,8182/12 : 44х0,1818/1 = 3 : 8
Молекулярная формула С3Н8
Дано название составлена структурная формула вещества: Пропан, СН3-СН2-СН3
Ответ правильный и полный, включает все вышеназванные элементы
3
Правильно записаны первый и второй элементы ответов
2
Правильно записан только первый элемент ответа
1
Все элементы ответа записаны неверно (в первом элементе допущена ошибка, повлекшая за собой неправильное решение)
0
Максимальное число баллов: 7+3+3=13 баллов.
Практическая работа № 3 по теме: «Получение и свойства карбоновых кислот».
Цель работы: повторить, систематизировать, практически подтвердить физические и химические свойства карбоновых кислот, научиться их получать на примере уксусной кислоты.
Оборудование: химический штатив, лапка, муфта, пробка с газоотводной трубкой, горелка, спички, пробирки.
Вещества: ацетат натрия, концентрированная серная кислота, раствор уксусной кислоты, стружки магния, гранулы цинка, раствор фенолфталеина, раствор гидроксида натрия, раствор изоамилового спирта, раствор нитрата серебра, раствор аммиака, раствор муравьиной кислоты
Техника безопасности:
Опасайтесь растрескивания стеклянной посуды при нагревании.
Соблюдайте правила нагревания.
Будьте осторожны в обращении с растворами кислот, щелочей.
Собирайте остатки веществ в специально предназначенную посуду.
Запрещается оставлять неубранными рассыпанные реагенты.
Ход работы
1. Получение уксусной кислоты. Поместите в пробирку 2-3 г ацетата натрия и прибавьте 1,5-2 мл концентрированной серной кислоты. Пробирку закройте пробкой с газоотводной трубкой, конец которой опустите в другую пробирку (рис.). Смесь нагревайте на пламени до тех пор, пока в пробирке-приемнике не будет 1,0-1,5 мл жидкости.
Задания для самостоятельных выводов. 1, Какое вещество образовалось в пробирке-приемнике? Какие свойства уксусной кислоты это подтверждают? 2. Составьте уравнение соответствующей реакции.
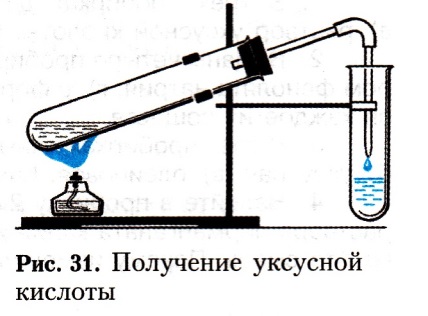
2. Взаимодействие уксусной кислоты с некоторыми металлами. В две пробирки налейте по 1 мл раствора уксусной кислоты. В одну пробирку всыпьте немного стружек магния, а в другую - несколько гранул цинка.
В первой пробирке происходит бурная реакция, а во второй реакция протекает спокойно (иногда она начинается только при нагревании).
Задание для самостоятельного вывода. Как уксусная кислота реагирует с магнием и цинком? Сравните скорость этих реакций и напишите уравнения в молекулярном, ионном и сокращенном ионном виде.
3. Взаимодействие уксусной кислоты с основаниями. Налейте в пробирку 1 - 1,5 мл раствора гидроксида натрия и добавьте несколько капель раствора фенолфталеина. При добавлении уксусной кислоты малиновая окраска фенолфталеина исчезает.
4. Взаимодействие уксусной кислоты со спиртами. В пробирку налейте 2 мл раствора уксусной кислоты. Прилейте 2 мл изоамилового спирта. Затем осторожно добавьте 1 мл концентрированной серной кислоты. Пробирку закройте пробкой с длинной стеклянной трубкой-холодильником. Смесь осторожно подогрейте на водяной бане.
После охлаждения добавьте к содержимому пробирки несколько миллилитров воды. При этом образуются маслянистые капли нерастворимого в воде изоамилового эфира уксусной кислоты с характерным запахом грушевой эссенции.
Задания для самостоятельных выводов. 1. Какие свойства уксусной кислоты сходны со свойствами минеральных кислот? 2. Какие вещества образуются при взаимодействии уксусной кислоты с основаниями? При помощи каких опытов это можно доказать? 3. Какие вещества образуются при взаимодействии уксусной кислоты со спиртами? Напишите уравнение соответствующей реакции.
5. Окисление муравьиной кислоты оксидом серебра(I). В чистую пробирку налейте 2 мл свежеприготовленного раствора с массовой долей нитрата серебра(I) 0,02. Добавьте немного разбавленного раствора аммиака до растворения появившегося осадка. Затем добавьте несколько капель муравьиной кислоты и пробирку со смесью нагрейте в колбе с горячей водой.
Задание для самостоятельного вывода. Почему из всех карбоновых кислот только для муравьиной кислоты характерна реакция «серебряного зеркала»? Напишите уравнение соответствующей реакции.
Практическая работа № 4 по теме: «Решение экспериментальных задач на распознавание органических веществ».
Цель: выбором оптимального варианта решения экспериментальных задач проверить знания характерных свойств изученных классов органических соединений, умения их распознавать и навыки основ лабораторного эксперимента и техники безопасности.
Оборудование : горелка, спички, пробиркодержатель, пробирки
Вещества: пробирки с гексаном, бензолом, раствором уксусной кислоты, пробирки с глицерином, этанолом, формалином, пробирки с растворами муравьионой, уксусной, олеиновой кислот
Техника безопасности :
Соблюдайте осторожность в работе с растворами кислот, солей, щелочей.
Соблюдайте правила нагревания.
Опасайтесь растекания посуды.
Помните о правилах ознакомления с запахом.
Запрещается оставлять не убранными разлитые и рассыпанные реагенты.
Ход работы
Решение экспериментальных задач на распознавание органических веществ
1. В трех пробирках даны следующие вещества: а) гексан; б) бензол; в) раствор уксусной кислоты. Определите каждое из веществ.
2. Выданы четыре пробирки: а) с глицерином; б) с этанолом; в) с раствором фенолята натрия; г) с формалином. Определите, в какой пробирке находится каждое из веществ.
3. В трех пробирках даны следующие карбоновые кислоты: а) муравьиная; б) уксусная; в) олеиновая. Как различить эти вещества?
4. Налейте в пробирку 2 мл этанола, прилейте к нему 2 мл разбавленного раствора перманганата калия и добавьте несколько капель серной кислоты. Нагрейте смесь. Почему изменилась окраска раствора?
Практическая работа № 5 по теме: «Решение экспериментальных задач на получение и распознавание органических веществ».
Цель: выбором оптимального варианта решения экспериментальных задач проверить знания характерных свойств изученных классов органических соединений , умения их распознавать и навыки основ лабораторного эксперимента и техники безопасности.
Оборудование: горелка, спички, пробиркодержатель, пробирки
Вещества: пробирки с этанолом, глицерином, раствор сульфата меди (II), раствор гидроксида натрия, стружки магния, пробирки с раствором фенола и раствором метаналя, йодная вода, аммиачный раствор оксида серебра, этиловый спирт, медная проволока, раствор уксусной кислоты, концентрированная серная кислота, карофель, белый хлеб, яблоко, раствор йода.
Техника безопасности :
Соблюдайте осторожность в работе с растворами кислот, солей, щелочей.
Соблюдайте правила нагревания.
Опасайтесь растекания посуды.
Помните о правилах ознакомления с запахом.
Запрещается оставлять не убранными разлитые и рассыпанные реагенты.
Ход работы
1. В двух пробирках даны вещества: а) этанол; б) глицерин. Проделайте опыты, подтверждающие их характерные свойства. Составьте уравнения соответствующих реакций.
2. В одной пробирке дан раствор фенола, а в другой - раствор метаналя. Проделайте опыты, которые подтверждают их характерные химические свойства. Напишите уравнения соответствующих реакций.
3. В двух пробирках даны вещества: а) глюкоза; б) сахароза. Определите эти вещества при помощи характерных химических реакций и приведите соответствующие уравнения реакций.
4. Из этилового спирта получите: а) простой эфир; б) альдегид; в) кислоту; г) сложный эфир. Составьте уравнения соответствующих реакций.
5. Докажите на опыте, что обычный сахар содержит углерод.
6. Докажите опытным путем, что: а) картофель и белый хлеб содержат крахмал; б) спелое яблоко содержит глюкозу.
7. Определите с помощью характерных реакций каждое из трех предложенных веществ: а) крахмал, сахар, глюкозу; б) глицерин, мыло, крахмал (растворы).
Контрольная работа №3 по теме «Кислородсодержащие органические соединения».
Вариант 1
1. Определите классы соединений, дайте названия веществ, формулы которых:
А. С2Н5СОН Б. НСООН
В. С2Н5СООСН3 Г. СН3ОН
2. Напишите уравнения реакция:
A. Этанола с пропионовой кислотой
Б. Окисления муравьиного альдегида гидроксидом меди (II).
B. Этилового эфира Уксусной кислоты с гидроксидом натрия.
Укажите их тип, условия осуществления и назовите исходные вещества и продукты реакций.
3. Напишите уравнения реакций, при помощи которых можно осуществить превращения по схеме:
СН4 → С2Н2 → СН3СОН → СН3СООН → (CH3COO)2Mg.
Укажите условия осуществления реакций и названия всех веществ.
-
Рассчитайте массу кислоты, полученной при нагревании 55 г 40% -го раствора этаналя с избытком гидроксида меди (II)
Вариант 2
1. Определите классы соединений, дайте названия веществ, формулы которых:
А. СН2ОН-СНОН-СН2ОН Б. С6Н5-СН2ОН
В. СН3ОСН3 Г. СН3СОО СН3
2. Напишите уравнения реакций:
A. Пропионовой кислоты с гидроксидом натрия.
Б. Уксусной кислоты с хлоридо
м фосфора (5).
B. Гидролиза пропилового эфира уксусной кислоты (пропилэтаноата).
Укажите их тип, условия осуществления и назовите исходные вещества и продукты реакций.
3. Напишите уравнения реакций, при помощи которых можно осуществить превращения по схеме:
СН4 → СН3С1 → СН3ОН → НСОН → НСООН.
Укажите условия осуществления реакций и названия всех веществ.
4. Вычислите массу 60%-й уксусной кислоты, затраченной на нейтрализацию 120 г 25% -го раствора гидроксида натрия.
Ответы:
1 вариант
1. А - С2Н5СОН - класс - альдегиды, Название - пропановый альдегид или пропаналь
Б - НСООН - карбоновые кислоты, муравьиная кислота
В. С2Н5СООСН3 - сложные эфиры, метиловый эфир пропановой кислоты
Г. СН3ОН - спирты, метиловый спирт.
2.А - С2Н5ОН +С2Н5СООН=С2Н5СООС2Н5+Н2О -
Б - НСОН+2Сu(OH)2=HCOOH+Cu2O+2H2O -
B - CH3COOC2H5+NaOH=CH3COONa+C2H5OH -
3. СН4 → С2Н2 → СН3 - СОН → СН3СООН → (CH3COO)2Mg.
СН4 = С2Н2 + 3Н2
С2Н2 +Н2О = [Hg]2+→
СН3 СОН
4 m (CH3COH)=55/100*40=22г
CH3COH+2Cu(OH)2= CH3COOH+Cu2O+2H2O
n (CH3COH)=22/44=0,5 моль
n (CH3COH)= n (CH3COOH)=0,5 моль
m (CH3COOH)=0,5*40=30г.
Практическая работа № 6 по теме: «Распознавание пластмасс и волокон».
Цель работы: На основе знания состава и строения полимеров уметь распознавать в лабораторных условиях наиболее употребляемые пластмассы и волокна.
Оборудование: железная ложка для сжигания, горелка, спички, стеклянная палочка, три пронумерованные пробирки с образцами пластмасс, три пронумерованные пробирки с образцами волокон.
Реагенты: концентрированная серная кислота (на демонстрационном столе), универсальная индикаторная бумага, раствор гидроксида натрия, универсальная бумага, вода в пробирке для смачивания индикаторной бумаги.
Техника безопасности: Соблюдайте правила работы с горелками. Будьте осторожны в обращении с растворами кислот. Запрещается оставлять неубранными рассыпанные реагенты.
Ход работы:
-
Запишите тему и цель практической работы.
2.В трех пробирках находятся пластмассы: полистирол, полиэтилен, капрон. Определите, в какой из пробирок находится каждое вещество.
В трех пробирках находятся волокна: хлопок, натуральный шелк, вискоза. Определите, какое волокно находится в каждой пробирке.
-
Проведите распознавание ВМС и результаты наблюдений запишите в тетрадь.
-
Сделайте в тетради 2 таблицы для оформления результатов опытов.
-
Заполните таблицы, используйте таблицу в учебнике
Распознавание пластмасс№ образца
Внешний вид
Отношение к нагреванию
Характер
горения
Исследования продуктов горения
Результат определения: название, элементарное звено
1.
2.
3.
Распознавание волокон№ образца
Характер горения
Окрашивание индикатора продуктами горения
Действие кислот и щелочей
Результат определения:
названия, основа волокна
Н2SO4
(3:2)
NaOH
10%
1.
2.
3.
Итоговая контрольная работа № 4 по темам: «Кислородсодержащие органические соединения», «Азотсодержащие органические соединения»
Вариант 1.
1. Межклассовыми изомерами являются:
1) альдегиды и карбоновые кислоты;
2) одноатомные спирты и фенолы;
3) простые эфиры и одноатомные спирты;
4) карбоновые кислоты и двухатомные спирты
2. Общая формула альдегидов:
1) Cn H2n O2 3) Cn H2n O 2) Cn H2n+1 O2 4) Cn H2n+1 OH
3.Продуктами восстановления альдегидов водородом (катализатор Pt) являются:
1) кетоны 2) сложные эфиры
3) простые эфиры 4) одноатомные спирты
4. Этанол не вступает в реакцию с веществом, формула которого:
1) Na 2) HBr 3) NaOH 4) CH3COOH
5. Формула CH3- CH2 - CH2 - CH2 - OH , а вещество называется:
1) 2-метилпропанол-2 2) бутанол-1
3) 2-метилпропанол-1 4) пропанол-1
6. Аминоуксусная кислота реагирует
1)натрием 2)медью 3) хлоридом натрия 4) серой
7. Гомологом для вещества CH3 - CH2 - OH является:
1) уксусная кислота 2) этаналь
3) пропанол-1 4) диметиловые эфиры
8. Белки распознаются при помощи
1.хлорида железа (III) 2.сульфата меди(II) и гидроксида натрия
3.аммиачного раствора оксида серебра 4.лакмуса
9. Установить соответствие между структурной формулой вещества и названием гомологического ряда к которому оно принадлежит:
Структурная формула вещества Названием гомологического ряда
1) CH3 - CH - CHO А) Предельные амины
CH3 Б) Сложные эфиры
2) CH3 - CH2 - O - CH2 - CH3 В) Простые эфиры
3) CH3 - COO - CH3 Г) Предельные одноатомные спирты
4) CH3 - CH(OH) - CH(OH) - CH3 Д) Многоатомные спирты
5) СН3 - NН2 Е) Альдегиды
10. Для предельных одноатомных спиртов характерны реакции:
1) Этерификации 4) Окисления
2) Дегидратации 5) Полимеризации
3) Гидратации 6) Нейтрализации
11. Напишите уравнения реакции, с помощью которых можно осуществить следующие превращения:
CН3СООН → CH3COO C2Н5 → C2 Н5OH → СО2
12. При восстановлении 500 г нитробензола получили 300 г анилина. Вычислите выход продукта реакции от теоретически возможного.
Контрольная работа №4 по теме:
«Кислородсодержащие органические соединения. Азотсодержащие органические соединения»
Вариант 2.
1. Общая формула СnH2nO2 соответствует:
1) альдегидам 2) фенолам
3) предельным одноатомным спиртам 4) карбоновым кислотам
2. Фенол реагирует с
1) Br2 2) Na2CO3 3) NaCl 4) Cu(OH)2
3. Этанол можно получить из этилена в результате реакции
1) гидратации 3) галогенирования
2) гидрирования 4) гидрогалогенирования
4. При щёлочном гидролизе 2-хлорбутана преимущественно образуется
1) бутанол-2 3) бутаналь 2) бутанол-1
5. При кислотном гидролизе этилацетата образуются
1) этанол и муравьиная кислота 3) метанол и муравьиная кислота
2) этанол и уксусная кислота 4) метанол и уксусная кислота
6. Ацетальдегид не реагирует с
1) аммиачным раствором оксида серебра 3) водородом
2) гидроксидом меди(II) 4) гидроксидом натрия
7. Уксусная кислота реагирует с
1) хлором 3) медью
2) водородом 4) хлоридом натрия
8. Анилин можно получить
1)дегидратацией спиртов 3) восстановлением нитробензола
2)дегидрированием альдегидов 4) гидрированием алкенов
9. Аминоуксусная кислота может вступать в реакции с
1) водородом 4) хлоридом хрома (III)
2) бромоводородом 3) натрием
5) азотом 6) карбонатом натрия
10.Установите соответствие между названием вещества и классом (группой) органических соединений, к которому(-ой) оно принадлежит.
Название вещества Класс органических соединений
А) глицерин 1) альдегиды
Б) анилин 2) простые эфиры
В) бутанол -1 3) ароматический амин
Г) пропаналь 4) многоатомный спирт
5) одноатомный спирт
6) карбоновая кислота
11. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
C6Н6 → С6Н5 Cl → С6Н5ОН → C6 Н2 Br3OH
12. Сколько г анилина можно получить из 125 г нитробензола, если выход анилина составляет 65% по сравнению с теоретическим.