- Учителю
- Разработка урока с презентацией, химия 8 класс. 'Строение атома. Состав атомных ядер. Изотопы. '
Разработка урока с презентацией, химия 8 класс. 'Строение атома. Состав атомных ядер. Изотопы. '
Приложение 1
Познакомьтесь с информацией, которая вам представлена и выступите группой по своей теме:
Группа 1: Представление об атомах как неделимых мельчайших частицах веществ, как уже отмечалось выше, возникло еще в античные времена (Демокрит, Эпикур, Лукреций).
В средние века учение об атомах, будучи материалистическим, не получило признания.
К началу XVIII в. атомистическая теория приобретает все большую популярность.
До конца XIX в. в химии господствовало метафизическое убеждение, что атом есть наименьшая частица простого вещества, последний предел делимости материи. При всех химических превращениях разрушаются и вновь создаются только молекулы, атомы же остаются неизменными и не могут дробиться на более мелкие части.
Различные предположения о строении атома долгое время не подтверждались какими-либо экспериментальными данными. Лишь в конце XIX в. были сделаны открытия, показавшие сложность строения атома и возможность превращения при определенных условиях одних атомов в другие. На основе этих открытий начало быстро развиваться учение о строении атома.
Группа 2 Ирландский физик Стони на основании опытов пришел к выводу, что электричество переносится мельчайшими частицами, существующими в атомах всех химических элементов. В 1891г Стони предложил эти частицы назвать электронами, что по -гречески означает «янтарь»
Через несколько лет в 1904 году Томсон представил свою новую модель атома. Она представляла собой также равномерно заряженную положительным электричеством сферу, внутри которой вращались отрицательно заряженные корпускулы, число и расположение которых зависело от природы атома. 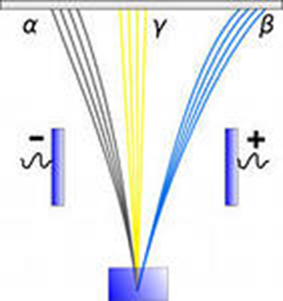
Группа 3 Дж. Томсон сумел определить его массу (она почти в 2000 раз меньше массы атома водорода). Дж. Томсон и Ж. Перрен соединяли полюса источника тока с двумя металлическими пластинками - катодом и анодом, впаянными в стеклянную трубку, из которой был откачен воздух. При подаче на пластины - электроды напряжения около 10 тысяч вольт в трубке вспыхивал светящийся разряд, а от катода (отрицательного) полюса к аноду (положительному) полюсу летели частицы, которые ученые назвали сначала катодными лучами, а в последствии выяснили, что это был поток электронов. Электроны ударяясь об особые вещества, нанесенные, например, на экран телевизора, вызывают свечение. Был сделан вывод - электроны вырываются из атомов материала, из которого сделан катод.
Но не только электроны входят в состав атомов.
Группа 4 Физик Анри Беккерель обнаружил, что природный минерал, содержащий соль урана, тоже испускает неведомое излучение, засвечивая фотопластинки, закрытые от света. Это явления было названо радиактивностью.
Различают три вида радиактивных лучей:
α - лучи, состоит из α - частиц, с зарядом в 2 раза больше заряда электрона, но с положительным знаком
β - лучи представляют собой поток электронов
γ -лучи электромагнитные волны, не несущие электрического заряда
Эти открытия доказали, что атом имеет сложное строение - состоит из более мелких (элементарных) частиц.
Как же устроен атом?
Группа 5 Резерфорд исследовал особенности прохождения альфа-частиц через тонкие металлические пластинки. На основании этих опытов ученый предложил планетарную модель атома: в центре атома - ядро, вокруг которого вращаются электроны. Резерфорд исследовал особенности прохождения альфа-частиц через тонкие металлические пластинки. 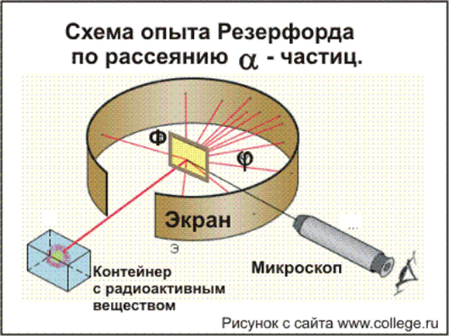
На основании этих опытов ученый предложил планетарную модель атома: в центре атома - ядро, вокруг которого вращаются электроны.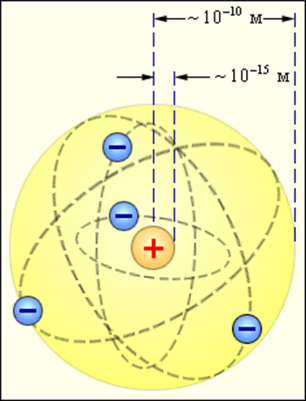
В Солнечной системе планеты вращаются вокруг Солнца
В атоме электроны вращаются вокруг атомного ядра, которое заряжено положительно и притягивает отрицательно заряженные электроны.
Приложение 2
Ф.И. ученика ____________________________________________________________
Задание 1. Выберите верные утверждения:
-
Ядро атома содержит протоны и нейтроны, суммарная масса которых равна массовому числу атома.
-
Нейтрон - это электронейтральная частица с массой равной 1.
-
Ядро атома не имеет заряда.
-
Электрон - это отрицательно заряженная частица с массой, равной 1.
-
Химический элемент - это мельчайшая частица, сохраняющая его химические свойства.
Ответ: __________________________________________________
Задание 2. Тест «Строение атома» (слайд 19)
1. Положительно заряженная частица называется
А) электрон Б) протон В) нейтрон
2. Отрицательно заряженная частица называется…
А) электрон Б) протон В) нейтрон
3. Частица, не имеющая заряд, называется…
А) электрон Б) протон В) нейтрон
4. Ядро атома состоит из
А) протонов и электронов Б) нейтронов В) нейтронов и протонов
5. Вокруг ядра вращаются…
А) электроны Б) нейтроны В) протоны
6. В переводе с греческого «атом» означает:
А) простейший Б) неделимый В) мельчайший
7. Заряд ядра атома серы равен:
А) +3 Б) +26 В) +16
8. Ядро атома лития состоит из 3 протонов и 4 нейтронов. Сколько вокруг ядра вращается электронов?
А) 3 Б) 4 В) 0
Ответы: ___________________________________________________________________
Задание 3. Определите состав атомных ядер у элементов с порядковым номером 16, 14, 26, 30, 35.
____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Задание 4.) Из смеси изотопов:2814 Si, 6429Cu, 188 O, 2311 Na, 115 B, 3717 CL, 2714 Si, 2614 Si 168O 6329 Cu, 3517 CL 178 O, 2211 Na, 105 B.
Выпишите изотопы: хлора ________________________ кислорода ___________________________
Рефлексия: Оцените ваше эмоциональное состояние на уроке?
-
Все понятно
 2. Есть вопросы
2. Есть вопросы  3. Не понравился урок
3. Не понравился урок 