- Учителю
- Конспект урока по химии с раздаточным материалом на темуОсновные химические свойства солей, 9 класс
Конспект урока по химии с раздаточным материалом на темуОсновные химические свойства солей, 9 класс
Итоговый урок - исследование.
Основные химические свойства солей.
Цель: опираясь на знание учащимися:
1). химических свойств кислот; 3). признаков химических реакций;
2). химических свойств щелочей; 4). условий протекания реакции обмена до конца;
имеющихся у учащихся:
1). навыков работы с простейшим лабораторным оборудованием и химическими реактивами;
2). умения составлять и уравнивать схемы химических превращений;
-
развить знания о химических свойствах солей и усовершенствовать навыки лабораторных умений
-
пробудить интерес к исследовательской работе и научить анализу систематизации полученных знаний и переносу информации о частных веществах на классы веществ
План урока:
-
введение: постановка цели урока;
-
проведение текущего инструктажа;
-
переход к работе в группах по исследованию определённых химических свойств солей;
-
подведение итогов групповой работы: заслушивание отчётов о проделанной работе;
-
обобщение полученных результатов и занесение дополнений в схему генетической связи неорганических веществ;
-
рефлексия: выполнение проверочной работы по вариантам
-
взаимопроверка
-
проверка работы
-
выставление оценок за урок
-
подведение итогов урока пояснение домашнего задания.
1 группа
Взаимодействие металлов с растворами солей.
Цель: экспериментальным путём установить правило, согласно которому определяется возможность взаимодействия между металлами и растворами солей.
Задание: провести три опыта
-
между железом и сульфатом меди (II) [железную скрепку залить 1÷2 мл раствора сульфата меди (II) результат опыта оценить после проведения второго опыта ].
-
между медью и сульфатом железа (II) [медную проволоку залить 1÷2 мл раствора сульфата железа (II)]
происходят ли изменения?
-
между натрием и сульфатом меди (II) *помощь учителя * (в пробирку налить 2÷3 мл раствора сульфата меди (II) добавить кусочек металлического натрия размером со спичечную головку).
Проблема: почему не происходит образование металлической меди?
Cоставление отчёта
-
результаты наблюдений оформить в виде таблицы.
-
сделать вывод:
-
о взаимном положении металла и металла, входящего в состав соли, в ряду активности металлов для результативного взаимодействия между раствором соли и металлом.
-
по какому пути идёт взаимодействие между очень активными металлами и растворами солей.
-
Fe + CuSO4
раствор
1).
2).
Fe + CuSO4 →
Опираясь на положение Me в ряду активности металлов
-
Cu + FeSO4
раствор
-
Na + CuSO4
раствор
1).
2).
3).
4).
Выбрать путь, по которому шло взаимодействие веществ в растворе
+H2O +CuSO4 t° Na→…→…→
+CuSO4
Na→
Какое взаимодействие более вероятно первым в случае очень активного Me с H2O или раствором соли
2 группа
Взаимодействие растворов солей с щелочами.
Цель: экспериментальным путём установить правило, согласно которому определяется возможность взаимодействия между растворами солей и щелочей.
Задание: провести три опыта
-
между CuSO4 и KOH (к 1÷2 мл раствора CuSO4 прилить по каплям раствор KOH).
-
между Na2SO4 и KOH (к 1÷2 мл раствора Na2SO4 прилить по каплям раствор KOH). Есть ли признаки протекания реакции обмена до конца?
-
между раствором Na2SO4 и Ba(OH)2. Почему в отличие от опыта 2 есть изменения?
Cоставление отчёта
-
результаты наблюдений оформить в виде таблицы.
-
сделать вывод:
-
если реакция между раствором соли и щёлочи возможна, то какова должна быть активность Me, входящего в состав соли и растворимость соответствующего ему основания?
-
в каком случае наблюдается исключение из правила (а)?
-
CuSO4 + KOH
1).
CuSO4 + KOH →
Рассмотрите активность Me, входящего в состав соли.
-
Na2SO4 + KOH
N a2SO4
+ KOH
a2SO4
+ KOH
Вспомните признаки протекания реакции обмена до конца и растворимость веществ, образованных Na и K (Me 1-2 группы гл. подгруппы).
-
Na2SO4 + Ba(OH)2
1).
Na2SO4 + Ba(OH)2→
Что за вещество образовало осадок? Какую свою составляющую для его образования предоставила соль?
3 группа
Взаимодействие растворов солей с кислотами.
Цель: экспериментальным путём установить правило, согласно которому определяется возможность взаимодействия между раствором соли и кислотой.
Задание: провести три опыта
-
между серной кислотой и хлоридом бария (к 1÷2 мл раствора BaCl2 прилить по каплям раствор H2SO4).
-
между серной кислотой и хлоридом натрия (к 1÷2 мл раствора NaCl прилить по каплям раствор H2SO4). Есть ли изменения?
-
между соляной кислотой и нитратом серебра (к 1÷2 мл раствора HCl прилить по каплям раствор AgNO3).
Cоставление отчёта
-
результаты наблюдений оформить в виде таблицы.
-
сделать вывод о том, в каком случае возможна реакция между раствором соли и раствором кислоты.
1).
BaCl2 + H2SO4 →
Связать результат опыта с признаками протекания реакции обмена до конца
-
NaCl + H2SO4
N aCl
+ H2SO4
aCl
+ H2SO4
См. опыт 1
-
HCl + AgNO3
1).
HCl + AgNO3 →
См. опыт 1
4 группа
Взаимодействие солей в твёрдом виде с кислотами.
Цель: экспериментальным путём установить правило, согласно которому определяется возможность взаимодействия солей, взятых для реакции в твёрдом виде и кислот.
Задание: провести три опыта
-
между карбонатом натрия и соляной кислотой (к порошку Na2CO3 прилить по каплям раствор HCl).
-
между сульфатом натрия и соляной кислотой (к порошку Na2SO4 прилить по каплям раствор HCl). Есть ли изменения?
-
между сульфитом натрия и соляной кислотой (к порошку Na2SO3 прилить по каплям раствор HCl).
Cоставление отчёта
-
результаты наблюдений оформить в виде таблицы.
-
сделать вывод о возможности взаимодействия между твёрдыми солями и кислотами, опираясь на соотношение между силой кислот, вступающих в реакцию и образующихся в результате неё.
Na2CO3 + HCl
1).
Na2CO3 + HCl →
→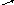
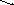 … + …
… + …
Опираясь на соотношение между силой кислот
-
Na2SO4 + HCl
См. опыт 1
-
Na2SO3 + HCl
1).
Na2SO3 + HCl →
→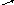
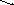 … + …
… + …
См. опыт 1
5 группа
Взаимодействие между растворами солей.
Цель: экспериментальным путём установить правило, согласно которому определяется возможность взаимодействия между растворами солей.
Задание: провести три опыта
-
между сульфатом меди(II) и хлоридом бария (к 1÷2 мл раствора CuSO4 прилить по каплям раствор BaCl2).
-
между нитратом серебра и хлоридом натрия (к 1÷2 мл раствора NaCl прилить по каплям раствор AgNO3).
-
между нитратом натрия и хлоридом бария (к 1÷2 мл раствора NaNO3 прилить по каплям раствор BaCl2).
Cоставление отчёта
-
результаты наблюдений оформить в виде таблицы.
-
сделать вывод о возможности протекания реакции между растворами солей, опираясь на условия протекания реакции обмена до конца.
Na2SO4 и BaCl2
1).
Na2SO4 + BaCl2 →
Опираясь на условия протекания реакции обмена до конца.
-
NaCl и AgNO3
1).
NaCl + AgNO3 →
См. опыт 1
-
NaNO3 и BaCl2
См. опыт 1 и растворимость образовавшихся веществ.
6 группа
Взаимодействие между растворимыми солями и водой.
Цель: экспериментальным путём установить правило, согласно которому определяется возможность взаимодействия растворимых солей с водой.
Задание: провести три опыта
-
между раствором карбоната натрия и метилоранжем (к 1÷2 мл раствора Na2CO3 добавить 2÷3 капли метилоранжа).
-
между раствором хлорида цинка и метилоранжем (к 1÷2 мл раствора ZnCl2 добавить 2÷3 капли метилоранжа).
-
между раствором хлорида натрия и метилоранжем (к 1÷2 мл раствора NaCl добавить 2÷3 капли метилоранжа). Окраска индикатора изменилась или только стала менее интенсивной?
Cоставление отчёта
-
результаты наблюдений оформить в виде таблицы.
-
сделать вывод о взаимодействии с водой определённых видов солей, опираясь на результаты опытов. какая составляющая (по силе) обязательно должна входить в состав соли?
Na2CO3 +
раствор
метилоранж
1).
Какова сила кислоты, кислотный остаток которой входит в состав соли и какова растворимость основания, образованного тем же металлом, что и Me входящий в состав соли?
Да или нет
-
ZnCl2 и
метилоранж
1).
См. п.1
-
NaCl и
метилоранж
Заключение учителя: вернёмся к «Схеме генетической связи между неорганическими веществами» и добавим недостающие взаимодействия:
-
между металлом и солью;
-
между двумя солями.
Свойства разложения солей будут рассмотрены в 9-ом классе.
Рефлексия.
I вариант
Закончите уравнения возможных реакций:
-
Fe + AgNO3 →
Ag + Fe(NO3)2 →
-
NaCl +KOH →
ZnCl2 + KOH →
-
Na2SiO3 + HCl →
NaNO3 + HCl →
-
NaCl + H2SO4 →
Na2SO4 + HCl →
-
AgNO3 + KCl →
NaNO3 + KCl →
II вариант
Закончите уравнения возможных реакций:
-
Fe + Hg(NO3)2 →
Hg + Fe(NO3)2 →
-
Mg(NO3)2 + NaOH →
KNO3 + NaOH →
-
AgNO3 + HCl →
Fe(NO3)2 + HCl →
-
KNO3 + H2SO4 →
K2SO4 + HNO3 →
-
K2SO4 + Ba(NO3)2 →
K2SO4 + NaNO3