- Учителю
- Химия пәнінен зертханалық жұмыстар (9 сынып)
Химия пәнінен зертханалық жұмыстар (9 сынып)

 10 сынып (жаратылыстану-математикалық бағыт)
10 сынып (жаратылыстану-математикалық бағыт)
№1 зертханалық тәжірибе
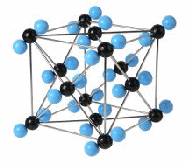
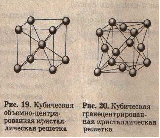
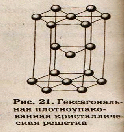
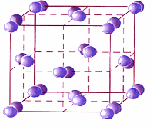
Тақырыбы: «Әртүрлі химиялық байланысы бар зат молекулаларының моделін жасау, кристалдық торлары әртүрлі заттардың қасиеттерін зерттеу»
Мақсаты: Физикалық, химиялық құбылыстарға тән белгілерді түсіндіру, мысалдар келтіріп, құбылыстарды ажырату, химиялық құбылыс, химиялық реакция екенін оның жүру белгілерін меңгерту.
Көрнекілік: әртүрлі кристалды тор үлгілері
Химия кабинетінде қауіпсіздік техникасы ережесін сақтауды ескерту.
Тәжірибенің орындалуы:
1)
1. 2. 3.
4. 5.
Тапсырма: суреттердегі кристалдық тор үлгілерін атын тауып, әрқайсысына сипаттама бер.
2) Ермексаздан және металдан немесе пластмассадан жасалған шарлар мен таяқшалар берілген.
Мұғалімнің тапсырмасы бойынша: а) иондық; ә) атомдық; б) молекулалық кристалдық торы бар заттардың моделдерін жасаңдар.
3)Өздерің моделдерін жасаған заттардың физикалық және химиялық қасиеттеріндегі айырмашылықтардың мәнін түсіндіріңдер.
10 сынып (жаратылыстану-математикалық бағыт)
№2 зертханалық тәжірибе
Тақырыбы: «Гидроксидтерді алу (сілті, қышқыл) және олардың қасиеттерін зерттеу. Тұздар гидролизі»
Мақсаты: Оқушыларға тұздар гидролизінің жүру механизмін түсіндіре отырып, тұздар ерітіндісінде индикаторлардың түсі өзгеруі жайлы білім беру;
Құралдар: сынауықтар
Реактивтер: NH₄CI, Na₂CO³, К₂СО₃ , фенолфталеин немесе лакмус ерітінділері
Жұмыс барысы
Химия кабинетінде қауіпсіздік техникасы ережесін сақтауды ескерту.
Тәжірибенің орындалуы:
-
Кестені толтыру
Не істедік
Не байқадық
Реакция теңдеуі, қорытынды
Судың өте аз мөлшерде сутек Н+ және гидроксид ОН - иондарына диссоциацияланатыны белгілі:
Н₂О ↔ Н+ + ОН -
Диссоциация нәтижесінде Н+ және ОН - иондарының бірдей мөлшері түзіледі. Ерітіндідегі сутек ионы Н+ және гидроксид ОН - ионының мөлшері бірдей болғандықтан су БЕЙТАРАП ортаны көрсетеді. Егер ерітіндідегі гидроксид ионының мөлшері артық болса орта СІЛТІЛІК, ал сутек иондарының мөлшері артық болса орта ҚЫШҚЫЛДЫҚ болып өзгереді. Олай болса сулы ерітіндісінде Н+ ионының не ОН - ионының артық мөлшері жоқ тұздардың ортасы бейтарап болуы керек.
Шындығында да күшті қышқыл мен күшті негіз әрекеттескенде түзілетін натрий хлориді, калий нитраты, калий сульфаты сияқты тұздардың сулы ерітіндісі бейтарап ортаны көрсетеді (электронды оқулық, №6 мысал). Кейбір орта тұздардың, мысалы, темір (ІІІ) хлоридінің NH₄CI судағы ерітінділері қышқылдық ортаны, ал натрий карбонатының Na₂CO³, калий карбонатының К₂СО₃ ерітіндісі сілтілік ортаны көрсетеді. Бұған көз жеткізу үшін осы тұздардың ерітінділеріне фенолфталеин немесе лакмус ерітінділерінің 1 - 2 тамшысын қосамыз
Ас тұзының NaCI ерітіндісіне лакмус түсін өзгертпейді, олай болса орта бейтарап. Ал темір (ІІІ) хлоридінің FeCI₃, мырыш хлоридінің ZnCI₂ және аммоний хлоридінің NH₄CI ерітінділеріне лакмус қызарады, демек, орта қышқылдық. Натрий және калий карбонатының Na₂CO₃, К₂СО₃ ерітіндісіне лакмус көгереді, демек, орта сілтілік.
10 сынып (жаратылыстану-математикалық бағыт)
№3 зертханалық тәжірибе
Тақырыбы: «Қышқыл, негіз және тұздардың сапалық құрамын тәжірибелермен дәлелдеу»
Мақсаты: Әр түрлі тұздар ерітініділерінің ортасын индикатор көмегімен анықтау
Құралдар мен реактивтер: сынауық, кальций оксиді, су, түрлі индикатор, шыны түтікше, натрий гидроксиді, мыс сульфаты, мырыш хлориді.
Жұмыс барысы
Химия кабинетінде қауіпсіздік техникасы ережесін сақтауды ескерту.
Тәжірибенің орындалуы:
-
Кестені толтыру
Не істедік
Не байқадық
Реакция теңдеуі, қорытынды
-
Тапсырмалар:
-
Қышқылдардыңформулаларын көрсетіңдер:а) H2SO4 ә)MgSO4 б) MgO в) HCI
-
Тұздардың формулалары:а)NaCI ә)CaSO4 б)MgSO4 в)NaOH
-
Қышқылдар металдармен және негіздік оксидтермен әрекеттескенде үнемі:а) су ә)сутек немесе басқа газдар б) тұз в) негіз түзіледі
-
Тұз қышқылымен: а)Ag ә)AI б)Fe в)Zn
-
Азот қышқылының мыс (ІІ) гидроксидімен химиялық реакция теңдеуіндегі реакция өнімдерінің формулаларымен олардың алдындағы коэффиценті:а) Cu(NO3)2және 2H2O ә) Сu(NO3)2 жәнеH2 б)CuOжәне 2H2O в)CuOжәне H2O
-
магний хлориді:а) MgO және HCI ә)Mg және HOH б)Mg және O2 в)Mg және HCI аралығындағы орынбасу реакциясының нәтижесінде алынады.
-
Хлорсутек қышқылының тұзы-кальций хлоридініңформуласындағы хлор атомыныңиндексі:а)1 ә)2 б)3 в)4
-
Күкірт қышқылының тұзы-литий сульфаты формуласындағы литий атомының индексі:а) 1 ә) 2 б)3 в)4
-
P→P2O5-+H2O→x айналым тізбегіндегі «х» деп белгіленген заттың формуласы:а)H3PO2ә)H3PO4 б)H3PO3 в)N2
-
Э→ЭО2→H2ЭО3 айналым тізбегіндегі «Э» элементі:а)CIә)S б)N в)P
-
Сұйылтылған күкірт қышқылы төмендегі заттармен әрекеттеседі:а) Mg және Cu(OH)2ә)CO2және NaOH б)FeO және H2S в)P және CuCI2
-
Тұз қышқылы:а) Cu-мен ә) CuO-мен б) Cu(OH)2-мен в) Zn-мен әрекеттеспейді
10 сынып (жаратылыстану-математикалық бағыт)
№4 зертханалық тәжірибе
Тақырыбы: «Химиялық тепе-теңдіктің ығысуы (аммоний не калий тиоционаты мен темір (ІІІ) хлориді концентрациясының өзгеруі бойынша)»
Мақсаты: Бұл жұмыста калий роданиді (KSCN)мен темір (III) хлоридінің ( FeCl₃) әрекеттесуінің қайтымды реакциясы қарастыру
Құралдар мен реактивтер: сынауық, калий роданиді (KSCN)мен темір (III) хлоридінің ( FeCl₃)
Жұмыс барысы
Химия кабинетінде қауіпсіздік техникасы ережесін сақтауды ескерту.
Тәжірибенің орындалуы:
Кестені толтыру
Не істедік
Не байқадық
Реакция теңдеуі, қорытынды
Экзотермиялық болады.
Пробиркаға 4-5мл темір (III)хлоридінің ерітіндісін және сондай көлемде калий роданидінің (KSCN) ерітіндісін құй. Пробиркадағы ерітінділерді араластырып, оны екі пробиркаға бөл. Бір пробирканы салыстыру үшін қалдырып, екіншісін ішінде ыстық суы бар стаканға сал. Ерітінділердің түстерін 2-3 минуттан кейін салыстыр. Байқағандарыңды жазып және Ле-Шателье шартын қолданып, тәжірибе температурасын жоғарылатқанда тепе - теңдіктің қай реакция бағытына(тура немесе кері) ығысатынын көрсет.
Қайтымды жүйенің тура реакциясы:FeCl₃ + 3KSCN→ Fe(SCN)₃ + 3KCl; ∆Н˂0
Тепе-теңдік қай жағына ығысады KSCN, KCL, FeCl₃ -дін қосқанда? Бұл жағдайда әрбір компоненттің концентрациясы қалай өзгереді? Ле-Шателье шартын қолданып, жауапты түсіндір. Берілген реакцияның химиялық тепе-теңдігінің математикалық өрнегін жаз.
10 сынып (жаратылыстану-математикалық бағыт)
№5 зертханалық тәжірибе
Тақырыбы: «Типтік металдар, бейметалдар мен амфотерлі элементтердің химиялық қасиеттері»