- Учителю
- Урок 'Галогены' 10 класс
Урок 'Галогены' 10 класс
Калиничева Екатерина Антоновна - учитель химии высшей квалификационной категории КГУ «Средняя школа №5», г . Петропавловск, Республика Казахстан
Тема: Галогены. Биологическая роль в жизнедеятельности человека.
Цель: обобщить и углубить знания о галогенах, их биологической роли в жизнедеятельности человека.
Задачи:
Обучающие: обобщить и углубить знания о группе неорганических веществ, обладающих сильными окислительными свойствами; выделить основные и особые физические и химические свойства галогенов; используя знания из области биологии, физиологии, медицины, исторические факты, показать важную роль галогенов для нормальной жизнедеятельности человеческого организма; продолжить формирование умений и навыков- составлять уравнения химических реакций, работать с учебной и дополнительной литературой.
Развивающие: обеспечить эмоциональное восприятие происходящего, создавая в ходе урока ситуации, вызывающие удивление, интерес, усиливающие познавательную активность учащихся; учить размышлять, прогнозировать; развивать умения устанавливать причинно - следственные связи строение - свойства - применение; развивать навыки сравнения, обобщения материала, умения делать самостоятельные выводы; развивать умения и навыки экспериментальной работы.
Воспитательные: продолжить воспитание навыков сотрудничества - слушать, общаться и работать индивидуально, в паре, в группах; показать связь изучаемой темы с жизнью; воспитание культуры умственного труда (качественное оформление результатов работы и их представление, фиксация информации по ходу устной беседы и т.п.), культуру участия в беседе, обсуждении; воспитывать аккуратность и наблюдательность при выполнении практических опытов; продолжить формирование у учащихся научно-материального мировоззрения.
Методическая: продемонстрировать возможности метапредметного подхода в обучении, использования на уроке информационно-коммуникационных технологий (ИКТ), педагогики сотрудничества, элементов современных развивающих методик.
Методы обучения:
• Перцептивный аспект (передача знаний): словесные, наглядные, практические.
• Гностический аспект: проблемно-поисковые, исследовательские методы.
• Управленческий аспект: работа над управлением, самостоятельная.
• Мотивационный аспект: учебные дискуссии, неожиданность, занимательность.
• Аспект контроля: устный, письменный, фронтальный, групповой, индивидуальный, текущий, тестовый.
Организационные формы: беседа, самостоятельная и практическая работа, выступления учащихся.
Методические приемы: самостоятельная работа учащихся с учебной и дополнительной литературой, подготовка сообщений, составление опорных конспектов, беседа, демонстрация химических опытов, ролевая игра.
Дидактическое и методическое оснащение урока:
-
Учебник «Химия», 10 класс, Нурахметов Н.Н., Бекишев К.
-
Презентация «Галогены. Физиологическое действие на организм человека».
-
Раздаточный материал.
Оборудование:
-
Периодическая система Д.И.Менделеева.
-
ТСО - компьютер, мультимедийный проектор, интерактивная доска.
3. Штатив с пробирками, штатив с веществами и реактивами.
Вещества и реактивы: раствор йода, картофель, кусочек хлеба, рис, крахмал, вода, горелка, спички.
На столах: инструктивные карточки (лаборатории), технологические карты, опорные конспекты.
Приемы активизации мыслительной деятельности учащихся:
-
Анализ учебной информации.
-
Раскрытие метапредметных связей: химия, биология, история, литература, география, физика, медицина, военное дело.
-
Выдвижение гипотез.
-
Анализ и составление кластера, синквейна.
Тип урока: урок - обобщение и углубление знаний с сочетанием фронтального, парного и индивидуального вида работы учащихся.
Формирование компетентности учащихся на этапах урока.
I. Организационный момент.
II. Ориентировочно-мотивационный этап - формирование компетентности личностного самосовершенствования.
III. Операционно-исполнительский этап - формирование учебно-познавательной, самообразовательной, социальной компетентностей.
Бодрость за одну минуту по Д.В. Керни - формирование компетентного отношения к своему здоровью.
IV. Коррекция и первичная проверка знаний - формирование компетентности личностного самосовершенствования; формирование коммуникативной и познавательной компетентностей.
V. Рефлексивно-оценочный этап - формирование интеллектуальной компетентности.
VI. Домашнее задание - формирование интеллектуальной компетентности и компетентности личностного самосовершенствования
План урока:
1. Обобщение и углубление знаний учащихся.
2. Закрепление изученного материала.
3. Проверка знаний учащихся.
4. Домашнее задание.
Ход урока.
Эпиграф к уроку: «Знать хорошее важнее, чем знать многое» Ж.Ж. Руссо
I. Организационный момент.
Приветствие и представление учителя.
II. Ориентировочно-мотивационный этап.
«Ключом ко всякой науке является вопросительный знак» О. Бальзак
Вопрос: Что объединяет зубную пасту, поваренную соль, бромгексин (таблетки) и йодную настойку (предметы быта)? Ответ: содержат фтор, хлор, бром, йод.
Вопрос: К какому семейству соединений относятся эти вещества? (Галогены.)
Почему необходимо изучать галогены? С ними знакомы все. Тем не менее, эти элементы, в высшей степени, своеобразны и каждому из нас, независимо от образования и профессии, приходится открывать в этих удивительных элементах и веществах что-то новое не один раз. 1- 2 слайды
Тема урока: Галогены. Биологическая роль в жизнедеятельности человека.
Вместе с учащимися формулируется цель и план работы.
1 группа учащихся: литератор, историк, географ, физики (предмет по выбору, ЕНТ; представление подготовленных заранее презентаций)
III. Операционно-исполнительский этап.
«Свои способности человек может узнать, только попытавшись приложить их»
(Сенека Младший)
Галогены - химические элементы. Вопрос: Как вы думаете с чего необходимо начинать изучение химических элементов? (Положения в ПС, строения атома, изменения свойств по группам и периодам, физических и химических свойств.)
1) Общая характеристика галогенов на основании их положения в ПС (физик). Строение внешнего электронного слоя атомов галогенов: …ns 2 пp 5
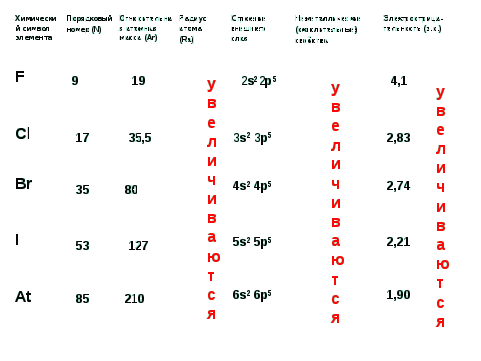
Вывод: Галогены - сильные окислители.
Вопрос: какой из галогенов является самым сильным окислителем? (фтор)
Обоснование: в группах главных подгруппах, сверху вниз, неметаллические (окислительные) свойства ослабевают. Причины: увеличение N, заряда ядра атома элемента Z (справка N= Z), Аr, Ra; не меняется число электронов на внешнем уровне. 3 - 4 слайды
2) Историк (ученик, история открытия). 5 - 10 слайды
Фтор - от греч. «фторос»- разрушающий. В свободном виде получил впервые в 1886 г. французский химик Анри Муассан электролизом смеси жидкого безводного HF и гидродифторида калия KHF2 в платиновом сосуде:
2HF→ H2↑ + F2↑
катод анод
В 1906 году Муассан был удостоен Нобелевской премии за открытие элемента фтора и введение в практику электрической печи, названной его именем. Однако, когда Муассан докладывал Парижской академии наук о своем открытии, один глаз его был закрыт черной повязкой. В истории фтора немало трагических страниц.
Хлор - от греч. «хлорос» - жёлто-зелёный. Открыт шведским аптекарем, химиком К.Шееле в 1774 г. «Я поместил смесь черной магнезии с муриевой кислотой в реторту, к горлышку которой присоединил пузырь, лишенный воздуха, и поставил ее на песчаную баню. Пузырь наполнился газом, который имел желто-зеленый цвет и пронзительный запах». Уравнение реакции:
MnO2+ 4HCl ® Cl2+ MnCl2 + 2H2O (лабораторный способ)
В 1810 году Г. Дэви назвал газ «хлорином»(Chlorine), от греческого «зелёный». Этот термин используется в английском языке, а в других языках закрепилось название «хлор».
В 1825 году французский химик (24-летний лаборант) А.Ж. Балар при действии хлора на рассолы соляных болот Франции (маточных рассолов) выделил темно-бурую жидкость, которую он назвал - «мурид» (от латинского слова «muria», означающего «рассол»). Комиссия Академии, проверив это сообщение, подтвердила открытие Балара и предложила назвать элемент бромом (от «бромос», с греческого «зловонный»). Уравнение реакции:
2NaBr + Cl2 → 2NaCl + Br2
В 1811 году французский химик - технолог, фармацевт Бернар Куртуа открыл йод путём перегонки маточных растворов от своего азотнокислого кальция с серной кислотой. Любимый кот ученого прыгнул на бутылки, содержащие золу морских водорослей в спиртовом растворе и концентрированную серную кислоту. Бутылки разбились, жидкости смешались, с пола стали подниматься клубы сине-фиолетового пара, который и оказался йодом. Чтобы другие химики могли изучать новое вещество, Б. Куртуа подарил его (правда, очень небольшое количество) фармацевтической фирме в Дижоне. В 1813 году Ж.-Л.Гей-Люссак подробно изучил этот элемент и дал ему современное название. Название «йод» происходит от греческого слова «иодэс» - «фиолетовый» (по цвету паров). Уравнение реакции: 2NaI + H2SO4 → Na2SO4 + I2
Попытки найти в природе элемент № 85 - астат («экайиод», Д.И.Менделеев) были безуспешны. Астат - от греч. «астатос» - неустойчивый. Получен учеными Калифорнийского университета Э.Д. Сегре, Д. Корсоном и К.Р. Маккензи в 1940 году искусственным путем при облучении висмута альфа-частицами, радиоактивен (период полураспада равен 8,3 ч). В 1953 году Э.Хайд и А.Гиорсо, американские химики, выделили химическим путем из франция - 233 изотоп Аt - 210.
3) Валентность: В(F) = I; В(Cl, Br, J) = I, III, V, VII (справочник)
(кроме соединений с кислородом и фтором); В(Аt) = I, III, V
Степени окисления: F (-1, 0); Cl, Br, J (-1, 0, +1, +3, +5, +7); Аt(-1, 0)
4) нахождение в природе (географ, ученик): 11 - 14 слайды
кора, w % степень концентрации
F 8∙10 -2 рудообразующие
Cl 4,5∙10-2 рудообразующие
Br 3∙10-5 рассеянные
I »1∙10-4 рассеянные
Состояние: связанные в земной коре, водных растворах и нижних слоях атмосферы. В вулканических газах, верхних слоях атмосферы можно обнаружить свободные атомы и молекулы. At - синтетический элемент. Минеральные формы элементов: CaF2 плавиковый шпат; 3Ca3(PO4)∙CaF2 фторапатит; NaCl галит (0,8 - 3,5 % хлора), каменная соль; KCl сильвин; NaCl∙KCl сильвинит; KCl∙MgCl2∙6H2O карналлит; MgCl2∙6H2O бишофит; Br, I - вода скважин; морская вода; вода соленых озер; морские водоросли; морепродукты. В Казахстане много солевых озёр и залежей каменной соли (галита), который\е служат источниками добычи хлорида натрия. Наибольшие запасы хлорида натрия - озера Арал, Балхаш, реки в Костанае, Павлодаре. В озере Баскунчак (Западный Казахстан) нет воды в нашем традиционном понимании (высыхание произошло 200 млн. лет назад). Все озеро, это огромный кристалл соли, достигающий в поперечнике 16 км и в глубину до 8 км. Несколько миллионов тонн соли добывается здесь ежегодно. И только на месте выработки образуется небольшой слой рапы - концентрированного соляного раствора, который оставляют нетронутым на 50 лет. За это время все пространство полностью закристаллизовывается. Длинные полосы пересекают всю плоскость озера - это следы выборки соли. По расчетам ученых, если со дна добыть всю поваренную соль на поверхность земли, то высота ее достигнет 1 км, а окружность составит более 100 км.
Галогены - простые вещества:
1) химическая формула: F2→ Cl2 → Br2 → J2 → At2, химическая связь: ковалентная неполярная (к.н.); кристаллическая решетка: молекулярная
2) физические свойства. Вопрос: 1) Можно ли галогены распознать по физическим свойствам? 2) Почему в основу распознавания нельзя положить
запах?
Литератор (ученик): 15 - 17 слайды
Я - фтор, светло-желтый газ. Меня применяли даже в войну,
Во мне горит вода. Я - резкий, удушливый газ.
Всех, кто стоит мне на пути Мой запах и желто-зеленый цвет
Окислю я всегда. Очень опасен для вас! (хлор)
В парах моих сгорает медь. Единственный похож я на металл,
Я бурый, прямо как медведь. Хотя металлом вовсе не являюсь.
Открыт давно я был Баларом В пробирку положите мой кристалл,
И «бромосом» меня назвал он. При нагревании легко я возгоняюсь.
(бром) (йод)
Я - самый редкий на Земле,
Ну что сказать вам обо мне,
Меня всего шестнадцать сотых грамм,
За это в книгу Гинесса попал. (астат)

![]()
Фтор. Резкий, характерным запах, напоминающий запах смеси хлора! с озоном. Немного тяжелее воздуха, с необыкновенной химической активностью, т.к. энергия связи молекулы фтора, необходимая для разрыва ее на отдельные атомы, равна 159 кДж/моль (в сравнении - энергия диссоциации молекул кислорода и хлора соответственно равна 495 и 243 кДж /моль).
Хлор. Неприятный, удушливый с резким запах, ядовит! В 2,5 раза тяжелее воздуха, в 1 объеме воды при 20 °С растворяется около 2 объемов хлора. Жидкий хлор хранят и транспортируют в стальных баллонах.
Бром. С неприятным, удушливым запахом, пары брома имеют желто-бурый цвет, в 1л воды при 20° C растворяется 35 г брома, при температуре -7,25° C бром затвердевает, превращаясь в красно-коричневые игольчатые кристаллы со слабым металлическим блеском.
Йод. Резкий запах, плохо растворим в воде (0,3 г в 1 л), йодный раствор в спирте - бурый, в парообразное состояние переходит при комнатной t°, не плавясь (возгонка, сублимация - …)(видеоопыт).
Астат. Кристаллы, черно-синего цвета, температура плавления 227 °С, температура кипения 317 °С, следовательно, подобно йоду, астат легче возгоняется, чем плавится (физико-химические константы рассчитаны по аналогии с таковыми же для соседних элементов по ПС, так как астат не может быть получен в массовых количествах). 18 - 22 слайды
Вывод: все галогены обладают запахом, вдыхание их вызывает сильнейшее раздражение дыхательных путей и тяжелые отравления.
2 группа (химики, теоретики + экспериментаторы) 23 - 27 слайды
3) химические свойства.
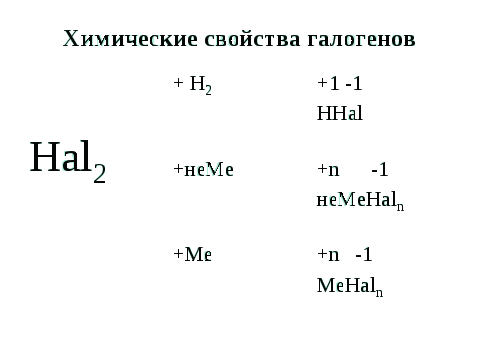
Взаимодействие с простыми веществами:
эл. ток Si + 2F2 → SiF4
О2 + 2F2 → 2ОF2 Хе + F2 → XeF2 (облучение)
фторид кислорода 2P + 3Cl2 → 2PCl3
Н2 + F2 → 2HF (взрыв) 2Na + Cl2 → 2NaCl
плавиковая кислота Cu + Cl2 → CuCl2
свет 2Fe + 3Cl2 → 2FeCl3
Н2 + Cl2 → 2HCl↑ 2Al + 3Br2 → 2AlBr3
H2 + Br2 = 2HBr + Q 2Al + 3J2 → 2AlJ3
H2 + I2 → 2HI - Q Hg + I2 → HgI2
Что можно сказать о скорости химических реакций взаимодействия галогенов с водородом? Какой фактор химической реакции оказывает влияние на скорость?
(природа реагирующих веществ). В одно время галогены называли солеродами. Вопрос: Почему такое название дано этим веществам? Как это название соотносится с названием поваренной соли? (Рождают соли при взаимодействии с металлами.) В 1811 г. И.К. Швейгер предложил химикам называть эти элементы галогенами («галос» - соль, «генес» - рождаю).
Взаимодействие со сложными веществами:
2H2O + 2F2 → 4НF↑ + О2↑
2F2 + 2NaOH → 2NaF + H2O + OF2↑
2F2 + SiO2 → SiF4 + O2↑
Cl2 + H2O → HCl + HClO Cl2 + СО → СОCl2 (фосген)
Cl2 + 2KOH →KClO + KCl + H2O
холод.
3Cl2 + 6KOH →KClO3 + 5KCl + 3H2O
горяч.
2KI + Cl2 → 2KCl + I2 N2H4 + 2F2 → N2 + 4НF (в качестве топлива ракет)
Cu + Br2 → Cu + Br2
2NH3 + 3Br2 →N2 + 6HBr (при попадании брома на кожу, чтобы предотвратить ожог кожи бромом, ее смачивают раствором аммиака в воде).
J2 + H2SO3 + H2O → H2SO4 + 2HJ
J2 + р-р крахмала → синее окрашивание, качественная реакция (опыт)
4) получение (история открытия).
В лаборатории: 16 HCl + 2КMnO4 → 2MnCl2 + 8H2O + 5Cl2↑ + 2КCl
В промышленности: электролиз раствора или расплава солей соляной кислоты
2NaCl + 2H2O → Н2↑ + Cl2↑ +2NaОН 28 слайд
5) применение. 29 - 42 слайды
Фтор широко применяют при получении различных фторидов;
в производстве тефлона (антипригарное покрытие), других фторопластов, фторкаучуков; фторсодержащих органических веществ и материалов, которые широко применяют в технике, особенно в тех случаях, когда требуется устойчивость к агрессивным средам, высокой температуре и т. п.; для создания ракетного топлива (фтор - окислитель, горючее - водород).
В качестве фреонов и хладоагентов - в холодильных и морозильных установках, в аэрозольных баллонах; в производстве зубной пасты.
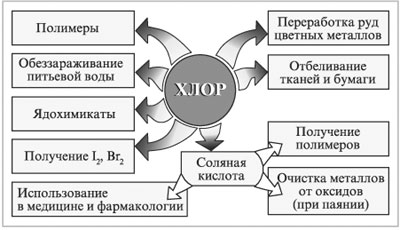
Хлор: производство хлорсодержащих органических соединений (60-75%), неорганических веществ (10-20%); для отбелки целлюлозы и тканей (5-15%); для санитарных нужд и обеззараживания (хлорирования) воды; производство соляной кислоты; производство органических растворителей; пластмасс, клеев, каучуков; производство кожзаменителей.
Военная страничка.

22 апреля 1915 года немцы использовали свойства хлора как боевого отравляющего вещества против англичан (Ипр). Результат этой газовой атаки: из строя было выведено 15 000 человек, из которых 5 000 погибло. Были нарушены правила, выработанные на Гаагской конференции, запрещающие использование на войне ядовитых веществ. Защита от нового вида оружия - противогаз с активным углем, который хорошо поглощал отравляющие вещества в парообразном и газообразном состоянии (Н.Д. Зелинский, 1915 год).
Вторая мировая война. «Катюша» - оружие Победы. По боевому предназначению снаряды «Катюш» подразделялись на осколочно-фугасные, зажигательные и химические (не были применены в боевых действиях, но первоначально именно они считались основными для оснащения пусковых установок). Грядущая война в 30-годах рассматривалась советским руководством как военный конфликт, в котором будут применяться боевые отравляющие вещества (БОВ, единственное средство массового поражения), как в Первой мировой и системы залпового огня типа «Катюши», накрывающие одновременно большие площади, предназначались в первую очередь для использования химических боеприпасов. Пироксилин - тротиловый пороховой состав, служивший топливом установки, изобрел Тихомиров. Но он умер, не дождавшись не то что награды, но и патента на свое изобретение. Автором устройства твердотопливного реактивного снаряда был И.Граве. Не раз сидевший по тюрьмам, он в 1942 году был удостоен Сталинской премии 1-й степени и ордена Ленина. В ходе войны ему присвоено звание полковника и он награжден еще четырьмя боевыми орденами. Третьим «отцом» можно вполне правомерно назвать И.Гвая. Именно он разработал пусковую установку БМ-13 и ряд последующих. Ему и принадлежит идея установки пусковых станков на мобильные лафеты. Под руководством Бориса Слопимера НИИ-3 успешно действовал всю войну. Он награжден пятью орденами, в том числе - тремя боевыми. Подлинных творцов одного из самых мощных боевых систем Великой отечественной войны назвали только в 1991 году, когда звания Героев Социалистического труда были присвоены Лангемаку, Клейменову, Гваю, Слопимеру, Петропавловскому и Шварцу. Всем - посмертно. Награждение не афишировалось и сегодня мало кто знает и помнит этих выдающихся творцов оружия Победы. Да будут же помянуты они по заслугам в день ее 70-летия!
90 % отравляющих веществ - соединения хлора. Фосген (СОCl2). Бесцветный газ с запахом заплесневелого сена , ядовит только при вдыхании паров.
Действие: токсический отёк лёгких. При очень высоких концентрациях отёк лёгких не развивается. Отравленный делает глубокие вдохи, падает на землю, корчится и бьётся в судорогах, кожа на лице становится от фиолетово-синей до темно-синей, и очень быстро наступает смерть. Газ Иприт S(CH2CH2Cl)2
12 июля 1917 года, у бельгийского города Ипр англо-французские войска были обстреляны минами, содержавшими маслянистую жидкость. Так впервые Германией был применён иприт (горчичный газ). Иприт - бесцветная жидкость с запахом чеснока или горчицы. Боевое токсическое отравляющее вещество кожно-нарывного действия. Поражает слизистые оболочки глаз, носоглотки и верхних дыхательных путей. При воздействии паров иприта на глаза появляется ощущение песка в глазах, слезотечение, светобоязнь, затем происходят покраснение и отёк слизистой оболочки глаз и век, сопровождающийся обильным выделением гноя. Первая помощь: глаза и нос следует обильно промыть, а рот и горло прополоскать 2 % раствором питьевой соды или чистой водой. Во время Второй мировой войны был секретный завод, на котором начиняли ипритом авиабомбы (г. Дзержинск). Вывод: применение отравляющих газов наносит вред не только живой силе противника, но и всей природе.
На данный момент применение сильнейших смертельных боевых газов запрещено международными соглашениями. Это третье бесчеловечное оружие после ядерного и биологического. Запрещено! Но как мы знаем, к сожаленью на войне правил не существует…
Бром: для получения ряда неорганических и органических веществ;
соединения брома используют в качестве топливных добавок, пестицидов, ингибиторов горения; в фотоделе (AgBr) как светочувствительный материал; в медицине в качестве успокоительного средства. Успокаивающее действие бромистых препаратов основано на их способности усиливать процессы торможения в центральной нервной системе.
Йод: для получения высокочистого титана (Ti), циркония (Zr), гафния (Hf), ниобия (Nb) и других металлов (так называемое иодидное рафинирование металлов); в иодных лампах накаливания, имеющих вольфрамовую спираль и характеризующихся большим сроком службы; применяют в пищевых добавках; в фотоделе; в аналитической химии - иодометрии; в медицине в качестве антисептического и кровеостанавливающего средства, однако обрабатывать иодной настойкой можно только небольшие раны, так как иод может вызвать омертвение ткани, что при больших ранах увеличит сроки их заживления, препараты йода используются для рентгенологических исследований почек, кровеносных сосудов и сердца.
3 группа (биологи). Биологическая роль галогенов в жизнедеятельности человека. 43 - 51 слайды
Г Галоген
,
Суточная
потреб -ность
Содержание
(организм)
Недостаток
Избыток
Продукты
Фтор
2-3 мг
во всех органах и тканях; в зубах, костях, волосах и ногтях
кариес (разрушение зубной эмали), ослабевание костей, выпадение волос
флюороз (пятнистость эмали зубов), замедление роста, деформация скелета
питьевая вода, морская рыба, чай, лук, чеснок, грецкие орехи
Хлор
2 г
ткани: мышечная, костная; кровь, лимфа; в составе желудочного сока (соляная кислота)
мышечная слабость, сонливость, вялость, ослабление памяти, потеря аппетита, сухость во рту, выпадение зубов и волос
задержка воды в тканях, повышение кровяного давления, боли в голове и груди, диспепсичес- кие расстройства, сухой кашель, слезотечение, резь в глазах
поварен-ная соль,
бобовые, злаки, свекла
Бром
0,5-2 мг
в крови, мозге (больше всего), печени, почках
бессонница, снижение уровня роста эритроцитов в крови.
кожное заболевание - бромодерма, нарушение работы нервной системы, апатия, сонливость, ослабление памяти.
Хлебобу-лочные изделия, молоко, творог, сыр, минеральная вода, красная смороди-на
Йод
100-200 мкг
щитовидная железа, кровь
гипотиреоз; кретинизм; у детей - отсталость в физическом, умственном развитии; у взрослых - микседема (зоб); снижение обмена веществ, выпадение волос, вялость, слабость, сухая желтоватая кожа
гипертиреоз - увеличение обмена веществ, учащение пульса, возбудимость
морская рыба (200 г в день), морепро-дукты,морская капуста (1 столовая ложка - в день)
томаты, морковь, хурма, яйца, молоко, хлеб, йодиро-ванная соль
Вывод: галогены, в биологическом плане, незаменимы в жизнедеятельности человека.
«Физиолог - это физико-химик, имеющий дело с явлениями живого организма»
И.М. Сеченов
Галоген
Физиологическое действие
ТБ, первая помощь
Фтор
очень токсичен. Вдыхание: тяжелое воспаление легких,
отек легких. Контакт с конц. (выше 19 мг/л) - труднозаживающие ожоги
защитные щитки, контроль температуры опыта, работа в атмосфере инертного газа.
Хлор
Раздражение слизистых оболочек дыхательных путей, отек легких. Допустимая концентрация: не выше 0,001 мг/л. Первые признаки отравления: кашель.
Нюхать смесь равных объемов этилового спирта и 10 % раствора аммиака. Противогаз (1915 г., Н.Д. Зелинский).
Бром
токсичен. Жидкий: вызывает тяжелые, долго не заживающие ожоги кожи. При длительном применении бромистых препаратов (средства, успокаивающие н.с., снотворные): насморк, кашель, кожные сыпи.
При работе с бромом следует пользоваться защитной ![]() спецодеждой, противогазом, специальными перчатками. Склянки с бромом располагают в ёмкостях с песком, который предохраняет склянки от разрушения при встряхивании. Покой, тепло, вдыхание распыленного тиосульфата натрия (Na2S2O3) и раствора гидрокарбоната натрия; при попадании на руки - смыть разбавленным раствором аммиака (соды), мазь (гидрокарбонат натрия)
спецодеждой, противогазом, специальными перчатками. Склянки с бромом располагают в ёмкостях с песком, который предохраняет склянки от разрушения при встряхивании. Покой, тепло, вдыхание распыленного тиосульфата натрия (Na2S2O3) и раствора гидрокарбоната натрия; при попадании на руки - смыть разбавленным раствором аммиака (соды), мазь (гидрокарбонат натрия)
Йод
очень ядовит. Смертельная доза 3 г. Вызывает поражение почек и сердечно-сосудистой системы. При вдыхании паров появляется головная боль, кашель, насморк, может быть отёк лёгких. При попадании внутрь появляется общая слабость, повышение температуры, рвота, понос, бурый налёт на языке, боли в сердце и учащение пульса. Через день появляется кровь в моче. Через 2 дня появляются почечная недостаточность и миокардит. Без лечения наступает летальный исход.
ПДК Йода в воде 0,125 мг/дм³, в воздухе 1 мг/м³. Использование как антисептика в небольших количествах.
Обобщение знаний (фрейм)
Изучили мы отменно
элементы галогены
(А по-русски - солероды),
Все - от фтора и до йода.
Даже новенький астат
Быть в семействе этом рад. 52 - 54 слайды
IV. Коррекция и первичная проверка знаний. Тестовые задания (ЕНТ) 2014-2015 г
V. Рефлексивно-оценочный этап. Составление синквейна. 55 слайд
VI. Домашнее задание: § 7.13, 7.14, упр. 8,9; стр. 257, 258. 56 слайд
Литература:
С.А.Барков «Галогены и подгруппа марганца», издательство «Просвещение», 1976 г.
Б.Я. Розен, Ф.С. Шарипова «Химия - союзник медицины», 1984 г.
«Химия», еженедельное приложение к газете «Первое сентября» № 33, 1997 г.
Н.Е. Кузьменко, В.В. Еремин. 2500 задач по химии с решениями: Сборник для поступающих в ВУЗы. - М.: Оникс 21 век. Мир и образование, 2003.
Г.П. Хомченко. Пособие по химии для поступающих в ВУЗы. - М: Новая волна, 2004.
Н.Е. Кузьменко, В.В. Еремин. Химия ответы на вопросы. Теория и примеры решения задач.- М: экзамен, 1998.
Е.А. Еремина, В.В. Еремин, Н.Е. Кузьменко. Справочник школьника по химии.- М: Дрофа, 1996.
Республиканский научно-методический журнал «Химия в Казахстанской школе» № 2 (32), 2010 г.
http://schoolchemistry.by.ru/
http://www.chem.isu.ru/
http://www.xumuk.ru/
http://www.womenfolk.ru/dietyi-i-pitanie/
http://www.ukrhealth.com/
http://himia.ucoz.ru/
http://ru.wikipedia.org - сведения о галогенах
http://ru.wikipedia.org - портрет Бернара Куртуа
http://ru.wikipedia.org - фото йода
http://www.baby24.lv/ru/info-h/412 - сведения о роли галогенов в организме
http://images.yandex.ru- картинки, фото, портреты
http:/, files.school-collection.edu.ru- видеоопыты ![]()
![]()