- Учителю
- Панорамный урок по химии для 8 класса по теме « классификация кислот. Способы получения кислот и их химические свойства»
Панорамный урок по химии для 8 класса по теме « классификация кислот. Способы получения кислот и их химические свойства»
Средняя общеобразовательная школа №32
Тема : « Классификация кислот. Способы получения кислот и их химические свойства »
Полулях Н.Е.
Уральск 2014год

Ф.И.О: Полулях Нина Евгеньевна
Дата рождения: 17 января 1958года
Место работы: СОШ № 32
Должность: учитель химии
Стаж работы: 31 лет
Преподаваемый предмет: химия
Тема урока: «Классификация кислот. Способы получения кислот и их химические свойства » 8 класс, неорганическая химия
Цели:
Образовательная:
-
Обобщить, систематизировать и дополнить знания учащихся по классу кислот.
-
Познакомить учащихся с классификацией кислот и способами получения.
-
Проверить усвоение материала по классу оснований.
Развивающая:
-
Развивать умения учащихся логически мыслить, обобщать, систематизировать, выделять главное, основное.
-
Развивать навыки в написании уравнений, решении задач, проведении практического эксперимента.
-
Развивать интерес к предмету, творческие способности учащихся.
Воспитывающая:
Воспитывать патриотизм, дисциплинированность, умение организовать свою
работу на уроке.
Оборудование: Интерактивная доска, компьютер, штатив с пробирками
под номерами с веществами для определения, ZnCI2 , NaOH, HCI,
универсальная индикаторная бумага, метиловый оранжевый, штатив с
пробирками.
Методы: Проблемное обучение (методическая тема учителя),
использование ИКТ, беседа с использованием флипчартов, выполнение
эксперимента.
План
-
Орг. момент.
II. Актуализация прежних знаний.
-
Решение задачи (работа учащегося у доски)
-
Выполнение экспериментального задания .
-
Закончить уравнения реакций (работает 1 ряд, взаимопроверка при помощи ИАД) на время.

Ф/чарт № 3 Метод: « Шторка», «Часы с
обратным отсчетом
4.Вывод.
III. Формирование новых знаний и способов действия.
Постановка цели. Д/З § 47 упр. № 7,9 стр.127

Ф/чарт № 2
Объяснение новой темы: «Кислоты»
А) Определение. Ф/чарт № 4 Метод: « Прожектор»

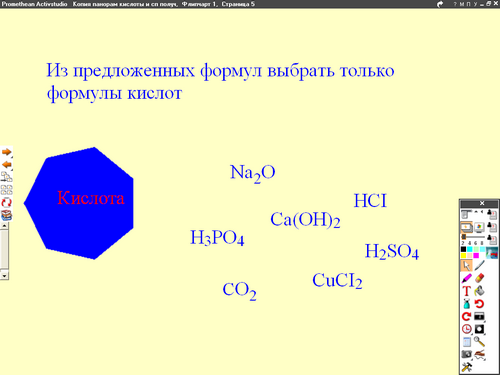
Задание 1. Из предложенных формул веществ выбрать кислоты.
Ф/чарт № 5 Метод: « Вернись, если не содержит»
Задание 2.Определить класс веществ.
Ф/чарт № 6 Метод: « Бери и тяни»

Б). Классификация кислот
-
по составу (наличию или отсутствию кислорода)
Задание 3. Выбрать формулы только кислородсодержащих кислот.
Ф/чарт №7 Метод: «Работа со слоями»

-
по числу атомов водорода в молекуле
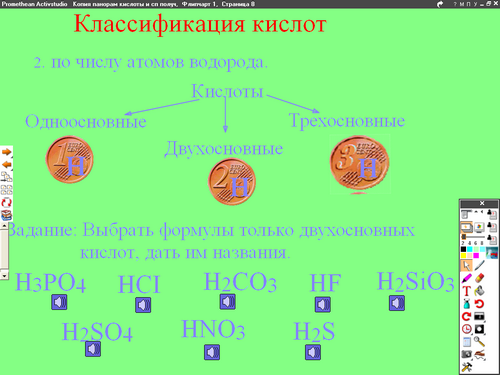
Задание 4. Выбрать формулы только двухосновных кислот
Ф/чарт № 8 Метод: «Работа со звуком»
В). Получение. Ф/чарт №9 Метод: «Использование видео»
Г). Физические свойства. Ф/чарт №10 Метод: «Использование картинки»
Д). Техника безопасности при работе с кислотами.
Ф/чарт №10 Метод: «Использование видео»

Е). Химические свойства.
-
Действуют на индикатор
2) Взаимодействуют с
а) Металлами
б) Основными оксидами

в) Основаниями
д) Солями

Ф/чарт № 11, 12 Метод: « Использование видео» объяснение сопровождается показом видеоматериала по каждому пункту плана о химических свойствах.
IV. Формирование умений и навыков
Задание 6. Закончить уравнения реакций.

Ф/чарт № 13 Метод: «Скрыть, чтобы показать»
Задание 7. Получить соль хлорид железа(II) 4-мя способами.

Ф/чатр № 14 Метод: «Сотри и убедись».
Задание 8. Экспериментальным путем определить вещества NaOH , NaCI, HCI.
V. Рефлексия.
Ход урока.
I. Орг. момент.
II. . Актуализация прежних знаний. Работа учащихся у доски:
1.Решить задачу. Рассчитайте какой объем водорода образуется при растворении в воде лития массой 28г.
2.Вам даны: хлорид цинка, гидроксид натрия и соляная кислота. Получить гидроксид цинка и доказать его амфотерность. Написать уравнения соответствующих реакций. ( Экспериментальное задание).
3.Завершить уравнения реакций:
А) K2O + H2O = 2KOH
Б) Ca(OH)2 + CO2 = CaCO3
B) AICI3 + 3KOH = AI(OH)3 + 3KCI
Г) AI(OH)3 + 3 HNO3 = AI(NO3)3 + 3H2O
Д) Fe(OH)3 → FeO + H2O
(Работает 1 ряд, взаимопроверка с помощью ИАД)
Ф/чарт № 3 Метод: « Шторка», «Часы с
4.Вывод. обратным отсчетом»
III. Формирование новых знаний и способов действия.
Постановка цели. Д/З: § 47 упр.№ 7,9 стр.127
Ф/чарт № 2
1.Определение: «Кислоты - соединения, состоящие из атомов водорода, способных замещаться на металл и кислотного остатка.
Ф/чарт № 4 Метод: « Прожектор»
Задание 1. Из предложенных формул веществ выбрать кислоты.
Na2O, H3PO4, Ca(OH)2, HCI, CO2, H2SO4, CuCI2
Кислота
Ф/чарт № 5 Метод: « Вернись, если не
содержит»
Задание 2. Определить класс веществ.
Даны формулы веществ, их необходимо классифицировать( разложить по корзинкам с названием класса.
HCI, CO2, H3PO4, H2S, NaOH, Na2O, Ca(OH)2, CuCI2
Ф/чарт № 6 Метод: « Бери и тяни».
2. Классификация кислот.
а) по составу (наличию или отсутствию кислорода)
Задание 3. Выбрать формулы только кислород содержащих кислот.
Кислоты
К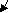
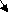 ислородсодержащие Бескислородные
ислородсодержащие Бескислородные
Задание 3. Выбрать формулы только кислородсодержащих кислот.
Дать им названия.
Даны: H2CO3, HCI, HNO3, HF, H2SO3, H3PO4
Кислородсодержащие
Ф/чарт №7 Метод: «Работа со слоями»
2) по числу атомов водорода в молекуле
КИСЛОТЫ

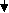

ОДНООСНОВНЫЕ ДВУХОСНОВНЫЕ ТРЕХОСНОВНЫЕ
Задание 4. Выбрать формулы только двухосновных кислот, дать им названия.
Даны: H3PO4, HCI , H2CO3, HF, H2SiO 3 , H2SO4, HNO3, H2S.
Ф/чарт № 8 Метод: «Работа со звуком». Правильно - хлопают. Не правильно - возмущаются.
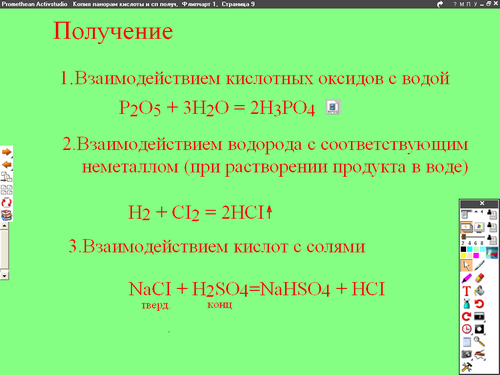
3 . Получение.
1). При взаимодействии кислотных оксидов с водой.
P2O5 + 3 H2O = 3 H3PO4
2). При взаимодействии водорода с соответствующими неметаллами ( при
растворении в воде).
H2 + CI2 =2HCI
3). Взаимодействием кислот с солями
NaCI + H2SO4 = NaHSO4 + HCI
Ф/чарт №9 Метод: «Использование видео»
4). Физические свойства.
А) Жидкости H2SO4, HNO3, HCI
Б) Твердые ортофосфорная H3PO4 , борная H3BO3
Ф/чарт №10 Метод: «Использование картинки»
5) Техника безопасности.
При разбавлении кислоты наливай кислоту в воду, а не наоборот!
Ф/чарт №10 Метод: «Использование видео»
6). Химические свойства.
1) Действуют на индикатор
2) Взаимодействуют с
а) Металлами ( металлы, стоящие в ряду Бекетова до водорода, вытесняет его из растворов кислот, кроме азотной ).
Zn + 2HCI = ZnCI2 + H2↑
б) Основными оксидами
CuO + H2SO4 = CuSO4 + H2O
в) Основаниями
NaOH + HCI = NaCI + H2O
Cu(OH)2 + H2SO4 = CuSO4 + 2 H2O
д) Солями (более сильная кислота вытесняет менее сильную)
HNO3
H2SO4, HCI, H2SO3, H2CO3, H2S, H2SiO 3
H3PO4
Ф/чарт № 11, 12 Метод: « Использование видео»
IV. Формирование умений и навыков.
Задание 6. Закончить уравнения реакций.
-
Mg + H2SO4 = MgSO4 + H2 ↑
2. CaO + 2HCI = CaCI2 + H2O
3. H3PO4 + 3KOH = K3PO4 + 3 H2O
Ф/чарт № 13 Метод: «Скрыть, чтобы показать»
Задание 7. Получить соль хлорид железа(II) 4-мя способами, используя в каждом случае HCI.
1. 2HCI + Fe = FeCI2 + H2 ↑
2HCI + FeO = FeCI2 + H2O
2HCI + Fe(OН)2 = FeCI2 + 2 H2O
2HCI + FeСO3 = FeCI2 + H2O + СО2↑
Ф/чарт № 14 Метод: «Сотри и убедись».
Задание 8. Экспериментальным путем определить вещества NaOH , NaCI, HCI.
V. Рефлексия.