- Учителю
- Урок химии в 7 классе «Простые химические реакции – действие разбавленных кислот на карбонаты, получение и изучение свойств углекислого газа».
Урок химии в 7 классе «Простые химические реакции – действие разбавленных кислот на карбонаты, получение и изучение свойств углекислого газа».
Предмет: Химия. 7 класс
Тема: Простые химические реакции - действие разбавленных кислот на карбонаты, получение и изучение свойств углекислого газа.
Цели обучения: - Изучить действие кислот на карбонаты и сделать общие выводы.
- Понимать и выполнять качественное испытание углекислого газа.
Ожидаемые результаты: Посредством химического эксперимента на основании наблюдений, анализа результатов эксперимента учащиеся делают выводы о способах получения углекислого газа, его свойствах, и действии углекислого газа на известковую воду. Путем сравнения способов получения водорода и углекислого газа действием разбавленных кислот на металлы и карбонаты ученики делают выводы о разных продуктах химических реакциях, полученных действием разбавленных кислот.
Ход урока:
-
Организационный момент: 1) Приветствие. 2) Определение отсутствующих. 3) Проверка готовности учащихся и кабинета к уроку
-
Опрос домашнего задания: Презентация видеоролика по теме: «Простые химические реакции, водород». Проведение взаимооценивания домашнего задания, техника «Две звезды и одно пожелание». Цель: Взаимооценивание, повторение изученного материала по теме простые химические реакции; водород способы получения и свойства.
Деление класса на группы. Стратегия: по счёту.
-
Изучение нового материала. Организует работу в группах для изучения теоретического ресурса по теме простые химические реакции - углекислый газ, получение и изучение свойств углекислого газа. Учитель организует взаимоконтроль изученного, ФО - техника - составить одно предложение, в котором необходимо выразить ответ на поставленный учителем вопрос.
- Что нового вы узнали о свойствах кислот?
-
Что вы узнали об углекислом газе?
Цель: оценить качество каждого ответа быстро и в целом. Отметить идентифицируют ли ученики основные понятия пройденного материала и их взаимосвязи.
-
Учитель организует повторение правил техники безопасности при работе с кислотами и щелочами (известковой водой) - химический диктант - 4 мин. ФО - техника - самоконтроль по образцу - вставить пропущенные слова, работа с текстом. Цель проверить уровень знаний правил проведения безопасного эксперимента.
Диктант
ТЕХНИКА БЕЗОПАСНОСТИ ПРИ РАБОТЕ С КИСЛОТАМИ
Кислоты вызывают химический ………………….кожи и других тканей.
По быстроте действия и по скорости разрушения тканей тела кислоты располагаются в следующем порядке, начиная с наиболее сильных: ………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
При разбавлении кислот, ……………… льют по ………………… палочке с предохранительным резиновым кольцом внизу.
Склянку с кислотой нельзя ……………… руками к груди, т.к. возможно ………………… и …………..
Первая помощь. Пораженный кислотой участок кожи ………. струей холодной ………….. в течение ………………. мин. После ………………… на обожженное место накладывают пропитанную водным раствором …………. марлевую повязку или ватный тампон. Через 10 мин. повязку ……….., кожу …………., и смазывают глицерином для уменьшения болевых ощущений.
-
Выполнение лабораторного опыта: «Получение углекислого газа и изучение его свойств».
Учащиеся выполняют эксперимент, заполненяют таблицу наблюдений и выводов, производят запись видео наблюдений для размещения в YouTube для того, чтобы их увидели родители.
-
Рефлексия занятия: учитель просит выразить отношение к формам проведениям урока, высказать свои пожелания уроку. Учащиеся заполняют цветные стикеры -«Светофор»
«Красный» - тема мне не ясна, осталось много вопросов.
«Желтый» - тема мне понятна, но остались вопросы.
«Зеленый» - тема мне понятна.
-
Домашнее задание: Изучить теоретический ресурс . Письменно сравнить результаты действия разбавленных кислот на металлы и карбонаты, сравнить газы водород и углекислый газ - мини - эссе. Оформить видеоролик и разместить его на YouTube. Группам оценить видеоролики других учащихся ФО - техника - «Две звезды и одно пожелание».
Использованная литература:
-
Активные методы преподавания и обучения
-
Формативное оценивание в начальной школе. Практическое пособие для учителя/ Сост. О. И. Дудкина, А. А. Буркитова, Р. Х. Шакиров. - Б.: «Билим», 2012. - 89 с.
-
Оценивание учебных достижений учащихся. Методическое руководство/Сост.Р. Х. Шакиров, А.А. Буркитова, О.И. Дудкина. - Б.: «Билим», 2012. - 80 с.
Приложение 1
Теоретический ресурс
Углекислый газ
Молекула СО2
Физические свойства
Оксид углерода (IV) - углекислый газ, газ без цвета и запаха, тяжелее воздуха, растворим в воде, при сильном охлаждении кристаллизуется в виде белой снегообразной массы - «сухого льда». При атмосферном давлении он не плавится, а испаряется, минуя жидкое агрегатное состояние - это явление называется сублимация, температура сублимации -78 °С. Углекислый газ образуется при гниении и горении органических веществ. Содержится в воздухе и минеральных источниках, выделяется при дыхании животных и растений. Мало растворим в воде (1 объем углекислого газа в одном объеме воды при 15 °С).
Получение
Получают углекислый газ действием сильных кислот на карбонаты:
metal carbonate + acid → a salt + carbon dioxide + water
CaCO3 + 2HCl = CaCl2 + CO2 + H2O
карбонат кальция + соляная кислота = 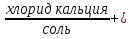 углекислый газ
углекислый газ + вода
+ вода
calcium carbonate + hydrochloric acid → calcium chloride + carbon dioxide + water
Na2CO3 + 2HCl = 2NaCl + CO2 + H2O
карбонат натрия + соляная кислота = 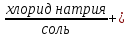 углекислый газ
углекислый газ + вода
+ вода
sodium carbonate + hydrochloric acid → sodium chloride + carbon dioxide + water
Химические свойства
Качественна реакция
Качественной реакцией для обнаружения углекислого газа является помутнение известковой воды:
Ca(OH)2 + CO2 = CaCO3↓ + H2O.
известковая вода + углекислый газ =  + вода
+ вода
В начале реакции образуется белый осадок, который исчезает при длительном пропускании CO2 через известковую воду, т.к. нерастворимый карбонат кальция переходит в растворимый гидрокарбонат:
CaCO3 + H2O + CO2 = Сa(HCO3)2.
= Сa(HCO3)2.

Приложение 2
Лабораторный опыт №7
«Получение углекислого газа и его распознавание»
Цель работы: экспериментально получить углекислый газ и провести опыт, характеризующий его свойства.
Оборудование и реактивы: штатив с пробирками, штатив лабораторный, пробирки, газоотводная трубка с резиновой пробкой, прибор для получения углекислого газа, мел (карбонат кальция),карбонат меди (II), карбонат натрия, раствор уксусной кислоты, известковая вода.
Ход работы:
-
Подготовьте заранее пробирку с 3 мл известковой воды.
-
Соберите прибор для получения газа (как показано на рисунке 1). Поместите в пробирку несколько кусочков мела, налейте до 1/3 объема пробирки уксусной кислоты и закройте пробкой с газоотводной трубкой, конец которой направлен вниз. Сделайте вывод о способе получения углекислого газа (_______________________?).
-
Погрузите газоотводную трубку в пробирку с известковой водой так, чтобы конец газоотводной трубки был ниже уровня раствора. Пропускайте углекислый газ до выпадения осадка. Если продолжать дальше пропускать углекислый газ то осадок исчезнет. Сделайте вывод о химических свойствах углекислого газа.
По итогам проведенных опытов заполните таблицу, сделайте вывод.
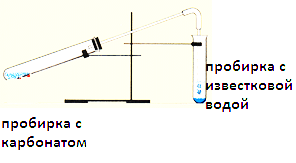
Образец выполнения работы
-
Собрали прибор для получения углекислого газа, поместили в пробирку кусочки мела и прилили соляную кислоту. Наблюдаю: выделение пузырьков газа.
Углекислый газ можно получить действием уксусной кислоты на:
-
мел (карбонат _______________________,
-
карбонат __________________________
-
карбонат __________________________)
Запись уравнения реакции:
карбонат кальция + уксусная кислота =  углекислый
углекислый
-
газ
 + вода
+ вода -
карбонат _______+ уксусная кислота =
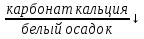 углекислый газ
углекислый газ + вода
+ вода -
карбонат _______+уксусная кислота =
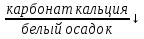 углекислый газ
углекислый газ + вода
+ вода -
газ
 + вода
+ вода -
карбонат _______+ уксусная кислота =
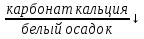 углекислый газ
углекислый газ + вода
+ вода -
карбонат _______+уксусная кислота =
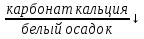 углекислый газ
углекислый газ + вода
+ вода
2. Газоотводную трубку поместили в пробирку с известковой водой. Выпадает белый осадок, затем он растворяется
Запись уравнения реакции:
Известковая вода + __________газ =
= 

Углекислый газ взаимодействует с известковой водой с образование вначале карбоната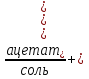 , затем гидрокарбоната кальция.
, затем гидрокарбоната кальция.
Вывод: Получили углекислый газ и изучили его свойства.