- Учителю
- Урок по химии в 10 классе по теме 'Железо и его соединения'
Урок по химии в 10 классе по теме 'Железо и его соединения'
Железо и его соединения.
Задачи: 1.Охарактеризовать железо по его положению в Периодической системе химических элементов Д. И. Менделеева; познакомить с физическими и химическими свойствами железа как простого вещества; записывать уравнения, характеризующие химические свойства железа и его соединений;
2.Продолжить формирование умений устанавливать взаимосвязь между составом, строением и свойствами веществ; развивать у школьников следующие интеллектуальные умения и приемы умственной деятельности (анализ, синтез, сравнение); развивать познавательный интерес школьников, используя для этого данные о биологическом значении соединений железа; обучение учащихся формировать умение экспериментировать, наблюдать, анализировать опыты, делать выводы.
3.Способствовать формированию научного мировоззрения учащимся на основе сведений об истории использования железа разными народами мира, его значении в жизни человека.
Умения:
-
составлять формулы различных веществ и давать им названия
-
проставлять в них степени окисления
-
составлять уравнения реакций и определять их типы, указывать окислитель и восстановитель.
Навыки:
-
самостоятельной работы
-
работы в парах по предложенному заданию
Тип урока: Изучения нового материала. Сообщение новых знаний и их совершенствование.
Формы работы: фронтальная, индивидуальная, работа в парах
Ход урока
I.Организационный момент. Эмоциональный настрой.
Сегодня, ранним утром, солнце заглянуло к нам в класс. Каждому из вас оно оставило тёплый лучик, чтобы растопить неуверенность, разбудить желание работать, помогать друг другу, узнавать новое!
Какой раздел химии мы изучаем? (Металлы.)
II. Повторение и проверка знаний. Актуализация знаний.
Викторина «Металлы»
• Какой металл самый легкий?
(Литий.)
• Какой металл самый тяжелый?
(Осмий.)
• Самый распространенный на Земле металл.
(Алюминий.)
• Если бы существовал приз за активность, то атому, какого металла его присудили бы? (Цезия.)
• Какой драгоценный металл является одним из самых лучших катализаторов для различных химических процессов? (Платина.)
• Гуси спасли Рим, а погубил Рим, по мнению токсикологов, металл. Какой это металл и что вам об этом известно? (Свинец.)
• Какой металл и почему называют «металлом хирургов»? (Тантал.)
• Что означает выражение: «Металл, принесенный в жертву "рыжему дьяволу"»? (Железо.)
• Без какого элемента-металла невозможна фотография? (Серебро.)
• Какой металл называют «металлом консервной банки»? (Олово.)
• Назовите металл, который первым стал известен человеку. (Золото.)
• Какой металл чаще всего подвергается коррозии? (Железо.)
? По какому признаку химические элементы относят к металлам? По количеству электронов на последнем энергетическом уровне: от одного до трех. По характерным физическим свойствам….
III.Мотивация
Очень древний я металл,
Счёт столетьям потерял.
Был нескромным я не в меру,
Тысячи лет до нашей эры.
А за блеск, мерцавший холодом,
Люди там платили золотом!
Я давно в названии века,
В организме человека.
Называют мной характер,
Из меня почти весь трактор.
Очень в яблоке полезно,
И зовут меня … ().
IV.Изучение нового материала
Характеристику любого элемента мы начинаем всегда по его положению в периодической таблице. Железо находится в побочной подгруппе VIII группы. Это d-элемент, у которого заполняется электронами предпоследний энергетический уровень:
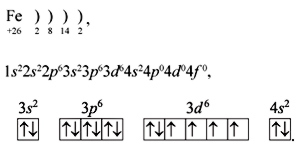
Задание 1.Дайте характеристику железа как химического элемента по положению в периодической таблице.
Хим.знак
N
Z
Число р
в ядре
Число ē
в атоме
Ar
Число n
в ядре
Число
внеш. ē
Электронное
семейство
Химич.
активность
Fe
Из истории…
Восточная легенда повествует о том, как египетский султан и полководец XII века Саладин (Салах-ад-дин) состязался в ловкости и воинском искусстве с английским королем Ричардом I по прозвищу Львиное Сердце. Могучим ударом меча Ричард разрубил пополам копье одного из рыцарей, продемонстрировав тем самым высокую прочность клинка и собственную силу. В ответ Саладин подбросил в воздух тонкий шелковый платок и рассек его на лету своей саблей, что говорило не только о ловкости султана, но и об удивительной остроте его оружия.
Первое железо, попавшее еще в глубокой древности в руки человека, было, по-видимому, не земного, а космического происхождения: железо входило в состав метеоритов, упавших на нашу планету. Не случайно на некоторых древних языках железо именуется «небесным камнем». В то же время многие крупные ученые еще в конце XVIII века не допускали и мысли о том, что Вселенная может «снабжать» Землю железом.
На поверхность земного шара ежегодно выпадают тысячи тонн метеоритного вещества, содержащего до 90 % железа. Самый крупный метеорит найден в 1920 году в юго-западной части Африки. Это метеорит Гоба, весящий около 60 тонн.
Задание № 2 Карточка «Физические свойства»
1.Агрегатное состояние -
2.Цвет -
3.Металлический блеск есть/нет (подчеркнуть)
4.Плотность -
5.Легкий / тяжелый (подчеркнуть)
6. Температура плавления -
7. Особое свойство -
Физминутка - игра «Встали - сели»
- Железо имеет переменную валентность (да) - Является легким металлом (нет) - Обладает магнитными свойствами (да) - В природе в чистом виде не встречается (нет) - Относится к d -элементам (да)
Рассмотрим химические свойства железа Железо - металл средней активности
Взаимодействие с простыми веществами: а) с галогенами железо образует галогениды, в которых оно имеет степень окисления +3: 2Fe + 3Cl2 = 2FeCl3
б) с серой - сульфид железа (II): Fe + S = FeS в) в кислороде раскаленное железо сгорает с образованием железной окалины: 3Fe + 2O2 = Fe3O4 ?Чем является железо в данных уравнениях реакций? Окислитель или восстановитель?
Взаимодействие со сложными веществами.
г) при высокой температуре (700-900⁰С) железо реагирует с парами воды:
3Fe + 4H2O = Fe3O4 + 4H2↑
д) железо может вытеснять металлы, стоящие в электрохимическом ряду напряжений правее него, из водных растворов их солей, например:
Fe + CuSO4 = FeSO4 + Cu
е) железо растворяется в разбавленных соляной и серной кислотах:
Fe + 2HClразб. = FeCl2 + H2↑
Fe + H2SO4разб. = FeSO4 + H2↑
При добавлении к раствору хлорида железа (ІІІ) раствора желтой кровяной соли образуется темно-синий осадок (берлинская лазурь).
4FeCl3 + 3K4[Fe(CN)6] = Fe4[Fe(CN)6]3+ 12KCl.
Это качественная реакция нa ионы Fe3+.
При взаимодействии раствора сульфата железа(ІІ) с раствором красной кровяной соли образуется темно-синий осадок (турнбулева синь):
3FeSO4 + 2K3[Fe(CN)6] = Fe3[Fe(CN)6]2+ 3K2SO4.
Это качественная реакция на ионы Fe2+ .
V.Закрепление
А) Задача: Не так давно в Моравском музее г. Брно появился новый экспонат - небольшой топор, найденный археологами при раскопках древнего поселения Мстенице, относящегося к раннему средневековью. Масса топора - 6 кг. Оказалось, что в отличие от других железных изделий, найденных при раскопках, топор изготовлен из природно-легированного железа, содержащего 2,8% никеля и 0,6% кобальта. Такой состав свидетельствует о небесном происхождении материала, которым воспользовался средневековый мастер из Мстенице. Сколько килограммов железа в этом топоре?
К доске выходит ученик и решает задачу.
Р е ш е н и е
l) m(Ni) = 0,028•6 = 0,168 кг;
2) m(Со) = 0,006•6 = 0,036 кг;
3) m(Fe) = 6 - (0,168 + 0,036) = 6 - 0,204 = 5,796 (кг).
Ответ. Железа в топоре 5,796 кг.
Б) Установите соответствие:
Тип реакции Исходные вещества
1) соединения а) Fe(OH)3 →
2) разложения б) Fe + H2SO4 →
3) замещения в) Fe + ZnSO4 →
4) обмена г) Fe(OH)3 + NaOH →
д) Fe + Cl2 →
е) Fe + O2 →
В) Установите соответствие:
Исходные вещества Продукты реакции
1) Fe + H2SO4 → а) Fe(OH)3 + NaCl
2) Fe + Cl2 → б) Fe(OH)2 + NaCl
3) Fe + HCl → в) FeCl2
4) FeCl2 + NaOH → г) FeCl2 +H2
д) FeCl3
VI. Рефлексия - формула ПОПС
Я считаю, что железо является типичным металлом
Потому что обладает характерными физическими свойствами …
Я могу это доказать…
В уравнениях химических реакций является …
Отсюда я делаю вывод, что железо - это металл.
VII.Домашнее задание: параграф по учебнику, кроссворд по железу.
Оценки за урок.