- Учителю
- Поурочные разработки курса химии 11 класса
Поурочные разработки курса химии 11 класса
Урок по теме «Амины».
Цели урока:
Образовательные:
1. восприятие уч-ся и первичное осознание нового учебного материала, осмыс-
ливание связей и отношений в объектах изучения.
2.Сформировать представление о строении и свойствах нового класса органических
соединений: изучить состав, строение, химические свойства аминов, взаимное влияние
атомов в молекулах аминов.
3.Выявить зависимость свойств органических соединений от строения.
4. Приобщить учащихся к самостоятельному поиску.
5.Развивать эмоциональную сферу учащихся через проведение лабораторных и демонстрационных опытов.
6.Рзвивать познавательную активность, умение наблюдать окружающий мир, задумываться над его внутренней сутью, причинами изменений, анализировать условия, определяющие различные тенденции его развития.
Развивающие:
1.развитие способности комплексного применения знаний;
2.работа над формированием логического мышления при составлении шаростержневых моделей молекул. Развитие общеучебных умений.
3.Учебно-информационные умения (составлять таблицы, приводить информацию в систему);
4.Учебно - логические умения:
-анализ и синтез;
-сравнение;
-обобщение и классификация;
-определение понятий (основное : химическое строение; новое: аминогруппа; опорные: гомология, изомерия).
Воспитывающие:
1.содействие толерантности у учащихся как в общественной потребности;
2.способствовать созданию на уроке ситуации успеха в обучении, как основы саморазвития и самореализации;
3.развитие творческих способностей, духовное совершенство личности в процессе общения с учителем, одноклассниками (соседом по парте);
4. Учебно-управленческие умения (владеть различными средствами самоконтроля, оценивать свою учебную деятельность, определять проблемы собственной учебной деятельности и устанавливать их причины).
Оборудование:
- проектор, ноутбук (компьютер), ДВД - плейер, экран, видеоролики с демонстрационным экспериментом (4 мин. 30 сек.):
-горение аммиака в кислороде и диметиламина,
-взаимодействие аммиака и диметиламина с водой ,
-взаимодействие аммиака и диметиламина с кислотами.
- шаростержневые модели молекулы аммиака и метильной группы.
- .
На столах учащихся: 1. шаростержневые модели молекул.
2. в чашках Петри кусочки селёдки.
На кафедре: 1.демонстрационный штатив;
2. в пробирке - кусок селёдки;
3.реактивы: вода, фенолфталеин.
Ход урока.
Этапы урока
Время
Полный конспект
Знания
Умения
Примечания
1.организация начала занятия.
1мин.
1.Приветствие уч-ся, проверка учителем подготовки уч-ся к работе на занятии (наличие тетради, учебника, таблицы).
2.готовность оборудования.
3.включение уч-ся в деловой ритм.
2.проверка домашнего задания.
Не проверяется, т.к. накануне была проведена контрольная работа по теме «Кислородосодержащие органические вещества» и была сделана работа над ошибками.
3.подготовка уч-ся к усвоению новых знаний.
5 мин.
Во вступительной части урока учитель предлагает учащимся назвать классы органических веществ, которые им уже известны. Он напоминает, что в курсе органической химии, в начале, рассматривались сравнительно простые по составу вещества, состоящие только из двух элементов - углерода и водорода, а затем более сложные соединения, в состав которых могут входить другие элементы - такие как кислород и азот.
Затем учитель предлагает провести первый шаг исследования - определить количественный состав нового класса соединений. Для этого необходимо решить задачу, на нахождение молекулярной формулы вещества ( №1).
-
Определите молекулярную формулу органического вещества, массовые доли углерода, азота и водорода в котором соответственно равны: 38,7%; 45,15%; 16,15%. Относительная плотность его паров по водороду равна 15,5.
Ученик выполняет это задание на доске. Во время самостоятельной работы, учитель оказывает дифференцированную помощь слабоуспевающим ученикам: одним можно предложить отпечатанные алгоритмы решения подобных задач; другим выдать памятки "Обрати внимание на… и реши. " Затем проверяет правильность решения задачи на доске и ставит ученику оценку.
1.повторение классов соединений.
2.знание алгоритма решения задач на нахождение молекулярной формулы вещества по качественному составу вещества.
1.решение задач на нахождение молекулярной формулы вещества по качественному составу вещества.
Цель вводного блока - создание мотивационно-целевой установки на изучение нового материала.
4.изучение нового материала.
20 мин.
На следующем этапе урока, учитель предлагает исследовать качественный состав вещества. Для этого необходимо составить структурные формулы веществ, формула которых была определена в ходе решения задачи. Учащиеся делают вывод, что в состав веществ не может входить нитрогруппа, так как отсутствует кислород. Значит, должна быть какая-то другая функциональная группа, содержащая атом азота. Затем на экране проектора возникают эти формулы, правильность написания своих формул каждый проверяет сам ( №2). Учитель поясняет, что такая группа, действительно, существует, записывает её состав и название:
-NH2 - аминогруппа - функциональная группа.
Вывод первых исследований: В исследуемый класс соединений входит углеводородный радикал и аминогруппа.
После обсуждения, учитель, предлагает дать определения этого класса веществ. Для облегчения работы учащихся, на экране проектора возникает слайд с изображением формулы углеводорода, в молекуле которой, с помощью компьютерной программы, происходит замена атома водород на аминогруппу. И второе изображение молекулы аммиака, в которой происходит замена атома водород на углеводородный радикал ( №3).
Учащиеся записывают тему урока: "Амины" и определения в тетрадь. Амины - производные углеводородов, в молекулах которых, атом водорода замещен на аминогруппу. И амины можно считать производными аммиака, в молекулах которых, один или несколько атомов водорода замещены на углеводородный радикал.
RNH2, R2NH, R3N
Простейший представитель - метиламин:
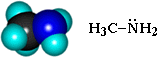 (показать на шаростержневой модели)
(показать на шаростержневой модели)
Учитель обращает внимание, на второе определение, объясняя, что дальнейшее исследование будет основываться на втором определении.
Затем учитель знакомит учащихся с классификацией аминов: -по характеру радикала (предельные, непредельные, ароматические); - по числу углеводородных радикалов в молекуле аминов (первичные, вторичные, третичные) ( №4).
Учитель комментирует слайд №4: Амины классифицируют по двум структурным признакам.
-
По количеству радикалов, связанных с атомом азота, различают первичные, вторичные и третичные амины.
-
По характеру углеводородного радикала амины подразделяются на алифатические (жирные), ароматические и смешанные (или жирноароматические).
АМИНЫ
Первичные
Вторичные
Третичные
Алифатические (жирные)
CH3NH2
Метиламин
(CH3)2NH
Диметиламин
(CH3)3N
Триметиламин
Ароматические
C6H5NH2
Фениламин(анилин)
(C6H5)2NH
Дифениламин
(C6H5)3N
Трифениламин
Смешанные
-
C6H5-NH-СН3
Метилфениламин
C6H5-N(СН3)2
Диметилфениламин
Во время показа слайда, учитель поясняет, что в школьной программе изучаются в основном моноамины предельного и ароматического ряда - первичные амины и записывает на доске общую формулу гомологического ряда аминов - производных предельных углеводородов.:
СnН2n +1NН2, n>1
Учитель обращает внимание учащихся на таблицу "Строение аминов" и следующий (№5) , на которых приведены формулы аминов: первичных, вторичных, третичных и предлагает назвать эти соединения. Затем на экране появляются названия веществ. Учитель знакомит уч-ся с изомерией аминов.
(слайд №6,7,8)
1.Структурная изомерия
- углеродного скелета, начиная с С4H9NH2:
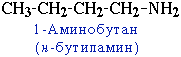
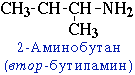
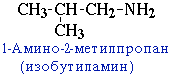
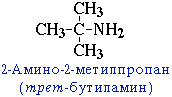
- положения аминогруппы, начиная с С3H7NH2:
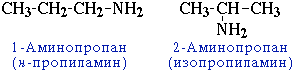
:
2.Пространственная изомерия
Возможна , начиная с С4H9NH2:
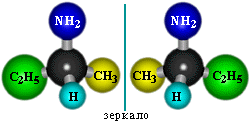
В качестве разминки, учитель предлагает ученикам составить молекулы аминов с помощью шаростержневых моделей (работа с шаростержневыми моделями):
1. метиламин (имеет запах аммиака);
2.диметиламин;
3.триметиламин (имеет запах селёдочного раствора). Учитель обращает внимание на чашки Петри, которые лежат на столах уч-ся, в них - кусочки селёдки, именно запах селёдочного раствора придаёт триметиламин.
Учитель просит зарисовать структурные формулы этих веществ в тетрадь и подписать их названия, а так же определить: какой это амин - первичный, вторичный или третичный?
Учитель: Каждое вещество имеет определенные свойства, и следующая часть урока посвящена физическим свойствам аминов. Учитель сообщает учащимся, что амины образуются при гниении рыбы, могут содержаться и в селёдочном рассоле, амины по запаху сходны с аммиаком. И на экране возникает (№9) с физическими свойствами аминов. Учитель рассказывает, что низшие амины из-за запаха долгое время принимали за аммиак, пока в 1849 г. Ш. Вюрц не выяснил, что в отличие от аммиака, они горят на воздухе с образованием углекислого газа. В ходе беседы можно вспомнить условия горения аммиака. Учащиеся делают вывод данного этапа исследования о сходстве аминов и аммиака (например, запах, растворимость в воде первых членов гомологического ряда аминов). Отсюда возникает вопрос о возможном химическом сходстве этих соединений.
Следующий этап - изучение свойств аминов ( в сравнении со свойствами аммиака, уч-ся заполняют таблицу в процессе изучения нового материала)
В молекуле аммиака из пяти валентных электронов атома азота три участвуют в образовании ковалентных связей с атомами водорода, одна электронная пара остаётся свободной. Электронное строение аминов аналогично строению аммиака. У атома азота в них так же имеется неподелённая пара электронов.
Учитель: Амины, являясь производными аммиака, имеют сходное с ним строение и проявляют подобные ему свойства, т. к. имеют неподелённую электронную пару на азоте (для написания хим. уравнений реакций учитель по одному приглашает уч-ся к доске)
Химические свойства
Аммиак ( №10)
Амины ( №11).
I. Окисление
Аммиак на воздухе не горит. Но в чистом кислороде он сгорает, окисляясь до азота. В колбу нальем 50 мл концентрированного раствора аммиака и закроем пробкой с горелкой для сжигания газов. Осторожно нагреем раствор аммиака и подадим в горелку кислород. Поднесем зажженную лучинку к отверстию горелки. Аммиак загорается и горит желтовато- зеленым пламенем.
4NH3 + 3O2= 2N2 + 6H2O
(видеофрагмент: 1 мин 38 сек.)
Учитель повторяет с уч-ся строение молекулы аммиака - связь ковалентная полярная, образована за счёт спаривания электронов и образования общих электронных пар.
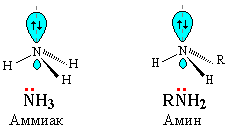
В молекуле аммиака из пяти валентных электронов атома азота три участвуют в образовании ковалентных связей с атомами водорода, одна электронная пара остаётся свободной. Электронное строение аминов аналогично строению аммиака. У атома азота в них так же имеется неподелённая пара электронов.
Амины, особенно ароматические, легко окисляются на воздухе. В отличие от аммиака, они способны воспламеняться от открытого пламени. 4СH3NH2 + 9O2 = 4CO2 + 10H2O + 2N2
Тренировка:
1. 4С2Н5NH2+ 15O2 = 8CO2 + 14H2O + 2N2
2. 4(СН3)2NH +15 O2 = 8CO2 + 14H2O + 2N2
(видеофрагмент: 50 сек.)
Электронное строение аминов аналогично строению аммиака. У атома азота в них так же имеется неподелённая пара электронов.
Взаимодействие с водой
Во время просмотра, учитель обращает внимание учащихся на неподелённую электронную пару атома азота. Учащиеся вспоминают, что в водном растворе, неподелённая пара электронов атома азота, взаимодействует с протоном и присоединяет его. Причем, химическая связь возникает не за счёт спаривания электронов двух атомов, а по донорно-акцепторному механизму: азот (донор) предоставляет протону (акцептору) в общее пользование свою пару электронов. В результате молекула аммиака превращается в катион аммония, а в растворе накапливаются гидроксид-ионы, обуславливая щелочную среду водного раствора аммиака.
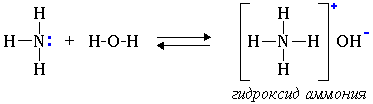
(видеофрагмент: 44 сек.)
Атомы азота в молекулах аминов также имеют неподелённую пару электронов. Пространственное строение аминов, также как и в случае аммиака, не препятствует взаимодействию протона с неподелённой парой электронов атома азота. Очевидно, это сказывается на их свойствах ,при взаимодействии аминов с водой образовались гидроксид -ионы.
Учащиеся записывают уравнение реакции на примере метиламина, показывая, как образуется новая N-H связь (по донорно-акцепторному механизму) и ионы метиламмония и гидроксид -ионы ( №12).
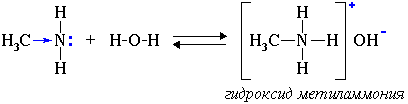
Учитель (или ученик) с кафедры демонстрирует опыт: к пробирке с селёдкой добавляет воду и по капля капает фенолфталеин. Образуется малиновое окрашивание. Вывод: образуется основание - щёлочь, поэтому фенолфталеин стал малиновым.
Тренировка:
1.С2Н5NH2 + H2О = [С2Н5NH3] ОН
2.(СН3)2NH + H2O = [(СН3)2NH2]ОН
Вывод: Низшие представители аминов взаимодействуют с водой аналогично аммиаку, так как имеют сходное с ним строение. Как в аммиаке, так и в аминах атом азота имеет неподеленную пару электронов, поэтому амины подобно аммиаку проявляют свойства оснований.
Взаимодействие с кислотами.
При добавлении соляной кислоты к раствору аммиака появляется белый дым - выделяется соль - хлорид аммония.
NH3 + HCl = NH4Cl↑
Добавление азотной кислоты в стакан с аммиаком приводит к появлению белого нитрата аммония.
NH3 + HNO3 = NH4 NO3↓
При добавлении серной кислоты появляются белые кристаллы сульфата аммония.
2NH3 + H2SO4 = (NH4)2SO4↓
(видеофрагмент)
Следующее свойство иллюстрирует способность аминов взаимодействовать с кислотами
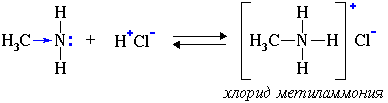
Тренировка:
1. С2Н5NH2 + HCI = [С2Н5NH3] CI
2.(СН3)2NH + HCI = [(СН3)2NH2] CI
получение
Затем учитель предлагает рассмотреть основные способы получения аминов ( №13)
1.Соли аминов - твердые вещества, хорошо растворимые в воде. При нагревании щелочи вытесняют из них амины:
![]()
2. Нагревание галогеналканов с аммиаком:
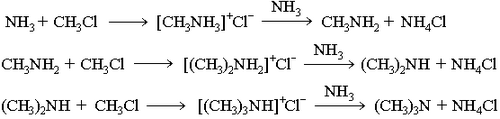
3.восстановление нитросоединений:
CH3NO2 + 3H2 = 2H2O+ CH3NH2
C2H5NO2 + 3H2 =2H2O+ C2H5NH2
1.знать строение аминов.
2.Знать функциональную группу аминов.
3.Знать изомерию аминов.
4.знать физические и химические свойства аминов, способы их получения.
5.Знать механизм образования обычной ковалентной полярной связи и связи по донорно-акцепторному механизму.
1.уметь составлять структурную и электронную формулы метиламина, объяснять их сходство с аммиаком.
3.уметь составлять и называть по систематической номенклатуре структурные формулы изомеров, приобретение навыков работы с конструктором для моделирования молекул веществ, уметь определять первичные, вторичные и третичные амины.
4.уметь составлять уравнения химических реакций, доказывающих основные свойства аминов. Указывать тип реакций.
5.Уметь называть способы получения аминов и области их применеия.
6.Умение составлять таблицу и сравнивать свойства веществ.
5.первичная проверка усвоения знаний.
5 мин.
Учитель уч-ся задаёт вопросы:
1.наличием чего обусловлены химические свойства аминов и аммиака?
(наличием неподелённой электронной пары азота).
2.Какой характер соединений носят амины? (органические основания)
Уч-ся записывают вывод в тетрадь: Амины - органические основания.
Но при сходстве свойств этих веществ как оснований между ними имеются и различия. Амины-производные предельных углеводородов - оказываются более сильными основаниями, чем аммиак. Поскольку они отличаются от аммиака наличием в молекулах углеводородных радикалов, очевидно, сказывается влияние этих радикалов на атом азота.
Учитель напоминает уч-ся 4 положение теории химического строения А.М.Бутлерова: «Атомы и группы атомов, входящие в состав молекулы, взаимно влияют друг на друга. Наибольшее влияние оказывают те атомы, которые стоят непосредственно друг с другом. Влияние атомов или групп атомов несвязанных непосредственно ослабевает по мере их удаления друг от друга».
Углеводородный радикал смещает электронную плотность к азоту, вследствие этого электронная плотность на азоте возрастает, и он прочнее удерживает присоединённый протон (катион) водорода. Гидроксильные группы воды от этого становятся более свободными и щелочные (основные) свойства раствора усиливаются.
Далее учитель предлагает учащимся сравнить основные свойства аммиака и аминов И в конечном итоге, на экране проектора ( № 14), на котором изображены молекулы аммиака, метиламина и фениламина (анилина). В ходе обсуждения делают вывод о влиянии углеводородного радикала на аминогруппу: радикал отталкивает электронную плотность, тем самым, увеличивая отрицательный заряд на атоме азота, следовательно, амины предельного ряда сильнее притягивают к себе протоны (катионы) из воды и кислот, т. е. являются более сильными основаниями. Слабые основные свойства ароматических аминов объясняется влиянием групп атомов в органических веществах, а именно бензольного кольца на аминогруппу (бензольное кольцо, наоборот, притягивает к себе электроны атома азота, тем самым уменьшая электронную плотность на атоме азота, следовательно, уменьшается способность присоединения протона(катиона) водорода и основные свойства уменьшаются).
Вывод, вытекающий из этого этапа урока: основания обладают свойством присоединять протон (катион), а кислоты - отщеплять его, поэтому аммиак и амины - основания, причем основные свойства аминов предельного ряда выражены сильнее.
Таким образом, основные свойства изменяются в ряду:
C6H5NH2 < NH3 < RNH2 < R2NH < R3N (в газовой фазе)
1.установление правильности и осознанности усвоения нового учебного материала,
2.выявление пробелов, неверных представлений и их коррекция.
3.знание теории Бутлерова.
1.уметь составлять уравнения химических реакций, доказывающих основные свойства аминов. Указывать тип реакций.
2.Уметь называть способы получения аминов и
6.первичное закрепление знаний.
6 мин.
Учитель предлагает уч-ся сделать превращение (одну или две цепочки в зависимости от оставшегося времени) :
1.Карбид алюминия > метан > нитрометан > метиламин > хлорид метиламмония > метиламин > гидроксид метиламмония .
2.карбид кальция > ацетилен > этан > нитроэтан > этиламин > бромид этиламмония > этиламин > азот.
Учитель предлагает выступить ученику с заранее подготовленным материалом по теме «Применение аминов»:
1.метиламин - используется в синтезе лекарственных препаратов, красителей, поверхостно - активных веществ (ПАВ), дубильных веществ, ракетных топлив.
2.диметилами - применяется в качестве ускорителя вулканизации каучука и в производстве лекарственных веществ (например, аминазин).
3.высшие амины применяются в качестве ингибиторов коррозии металлов.
1.Уметь составлять уравнения хим. реакций, подтверждающих взаимосвязь изученных классов органических соединений. 2.уметь составлять уравнения химических реакций, доказывающих основные свойства аминов. Указывать тип реакций.
3.Уметь называть способы получения аминов и его соединений.
7.контроль и самопроверка знаний.
4 мин.
Контрольные вопросы (учитель раздаёт на парты заготовленные листы с тестами) 1. Какие из приведенных ниже веществ относятся к аминам?
а) CH3-N-CH3 б) CH3-CH2-CH3
|
CH3
в) С6H5-NH2 г) C2H5-NO2
2. Какие амины проявляют более основные свойства:
а) метиламин или фениламин.
б) метиламин или диметиламин. Почему?
3. Какую реакцию на индикатор показывают амины жирного ряда?
: кислотную
: нейтральную
: щелочную
: не действуют на индикатор
4. Вещество CH3-NH-CH(CH3)2 относится к ряду …
: фенолов
: ароматических аминов
: алифатических аминов
: нитросоединений
5. Задача (если остаётся время или весь класс отвечает на тесты, а один ученик на доске решает данную задачу): При сжигании органического вещества массой 9 г. образовалось 17,6 оксида углерода (IV), 12,6 г. воды и азот. Относительная плотность вещества по водороду равна 22,5. Найдите молекулярную формулу вещества? (ответ: диметиламин или этиламин)
Учитель просит уч-ся зарисовать структурные формулы возможных аминов.
1.знание алгоритма решения задач на нахождение молекулярной формулы вещества по по продуктам сгорания вещества.
1.умение работать с тестами.
2. решение задач на нахождение молекулярной формулы вещества по продуктам сгорания вещества.
3.знание определения изомеров и умение составлять структурные формулы изомеров.
8.подведение итогов занятия, рефлексия.
2 мин.
Учитель даёт анализ и оценку успешности цели изучения аминов и намечает перспективу последующей работы
9.информация о домашнем задании.
2
мин.
Учитель задаёт домашнее задание:
1.таблицы - стр. 92-93;
2. учебник: параграф №40, письменно упражнения № 1,2,4 (просит уч-ся открыть учебник, ознакомиться с текстом письменного дом. задания, если у уч-ся возникнут вопросы, то учитель комментирует задания)
3.проверка соответствующих записей.
1.обеспечение понимания цели, содержания и способов выполнения домашнего задания.
19